콩 추출물의 라디칼 소거 및 항염증 활성


This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study compared the antioxidant and anti-inflammatory capacities of acetone extracts from commercially available soybeans with reddish (Gangnang-kong, Ultari-kong, and Lentils), black (Heuk-tae, Seori-tae, and Seomok-tae), and yellow (Baek-tae and Chickpea) seed coats. Reddish soybeans had the highest 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical-, superoxide-, and peroxynitrite-scavenging activities as well as the highest cupric reducing antioxidant capacities, followed by black soybeans; yellow soybeans showed the lowest value. The oxygen radical absorbance capacities and total phenolic contents of reddish and black soybeans were similar and higher than those of yellow soybeans were. Supercoiled DNA strand breakage induced by the hydroxyl radical was inhibited more by reddish soybeans compared to black or yellow soybeans. Lipopolysaccharide-induced NO production in RAW 264.7 cells was inhibited more by reddish or black soybeans than yellow soybeans. The antioxidant activities, including DPPH radical scavenging, superoxide scavenging, and cupric reducing antioxidant capacity, were strongly correlated with the total phenolic and total flavonoid contents. The anti-inflammatory capacity was strongly correlated with the total flavonoid content. Therefore, these findings show that reddish or black soybeans had more potent antioxidant and anti-inflammatory effects than yellow soybeans, possibly due to their high phenolic contents.
Keywords:
soybeans, radical scavenging, antioxidant, anti-inflammatoryI. 서론
슈퍼옥시드(superoxide), 히드록실 라디칼(hydroxyl radical), 과산화수소 등과 같은 반응산소종(reactive oxygen species, ROS)과 산화질소(nitric oxide), 퍼옥시니트리트(peroxynitrite) 등과 같은 반응질소종(reactive nitrogen species, RNS)은 미토콘드리아에서 세포대사의 부산물로서 생성되며, 과다한 세포의 ROS와 RNS 생성은 지질과산화, 단백질 불활성화, DNA 변성 등을 야기시켜 세포의 기능장애를 유발하고, 동맥경화증, 관절염, 당뇨병, 암, 파킨슨 질병 등 수많은 질병을 일으키는 것으로 보고되고 있다(Valko et al. 2007). 항산화제는 ROS와 RNS에 의해 유도되는 산화 스트레스로 인해 생성되는 산화물질들을 방어하는 물질이다. 최근 들어 건강에 대한 관심이 높아지면서 식물계에 널리 분포되어 있는 식이 항산화제에 대한 연구가 활발히 이루어지고 있다.
콩은 두과(Leguminosae)에 속하는 식물로써, 단백질과 지방이 풍부하고, 칼륨, 인, 칼슘, 마그네슘, 아연 등의 미네랄과 티아민, 리보플라빈, 니아신, 엽산 등의 비타민 공급원이며, 콩으로부터 분리된 생리활성물질에는 플라보노이드, 이소플라본, 펩티드, 피틴산, 콩 지질 등이 있다(Liu 1997). 콩의 주요 성분인 이소플라본의 저콜레스테롤혈증 효과(Potter 1998), 항종양 효과(Barnes et al. 1996), 골다공증 예방 효과(Adlercreutz & Mazur 1997) 등 다양한 질환에 대한 예방효과들이 많이 보고되고 있다. 최근에는 콩의 라디칼 소거활성, 환원력 등의 항산화 활성에 관한 연구도 활발히 진행되고 있으며(Prakash et al. 2007; Xu & Chang 2008; Szymczak et al. 2017), 콩의 종피 색깔에 따라 항산화 활성이 다른 것으로 보고되고 있다(Slavin et al. 2009; Kumar et al. 2010; Cho et al. 2013). 검은색 콩이 노란색 콩이나 녹색 콩에 비해 총페놀 함량과 총플라보노이드 함량이 높으며, 2,2-diphenyl-1-picrylhydrazyl (DPPH) 라디칼, 2,2’-azino-bis(3-ethylbenzothiazoline-6- sulfonic acid(ABTS) 라디칼 및 히드록실 라디칼 소거활성 그리고 철이온 환원력이 높게 나타났고, 총페놀 또는 총플라보노이드 함량과 항산화 활성 간 유의적 상관관계가 보고된 바 있다(Myung & Hwang 2008; Slavin et al. 2009; Kumar et al. 2010; Lee et al. 2014). 그러나 이소플라본 함량과 종피 색깔 또는 항산화 활성 간에 유의적 상관관계는 관찰되지 않았으며(Myung & Hwang 2008; Kumar et al. 2010; Cho et al. 2013), 검은색 콩과 노란색 콩의 품종 간 항산화 활성의 차이가 없다고 보고된 바 있다(So et al. 2001; Ryu & Moon 2003).
따라서 본 연구에서는 시중에 유통되고 있는 콩들의 총페놀 및 총플라보노이드 함량, 라디칼 소거활성, 환원력 및 염증 유발에 의해 유도된 산화질소 생성 억제를 측정하고, 콩들 간의 항산화 및 항염증 활성을 비교·조사하였다.
II. 연구방법
1. 재료 및 시약
시중에 유통되고 있는 붉은색 콩 3종(강낭콩, 울타리콩 및 렌틸콩), 검은색 콩 3종(흑태, 서리태 및 서목태), 노란색 콩 2종(백태 및 병아리콩) 등 총 8종의 콩을 구입하여 실험에 사용하였다. pBR322 DNA는 KOSCHEM(Seoul, Korea)으로부터 구입하였고, GelRed 염색시약은 Biotium (Hayward, CA, USA)으로부터 구입하였으며, 우태아혈청은 Lonza(Walkersville, MD, USA)로부터 구입하여 사용하였다. 그 외 실험에 사용된 시약들은 분석급으로 Sigma-Aldrich Co.(St. Louis, MO, USA)로부터 구입하였다.
2. 시료의 추출
건조된 콩 시료들을 분쇄기(Hanil HMF-3260S, Hanil Electric, Seoul, Korea)를 사용하여 분쇄한 후 500 μm 체로 걸렀다. 분쇄한 시료 1 g에 5 mL의 80% 아세톤 용액을 첨가하고 10분간 혼합한 후, 초음파 분쇄기(Sonic Dismenbrator Model 100, Fisher Scientific, Pittsburgh, PA, USA)를 사용하여 25W에서 3분간 분쇄하였다. 초음파 분쇄된 혼합물은 12,000×g에서 10분간 원심분리하여 상등액을 수거하고, 분석 시까지 –20℃에서 보관하였다.
3. 분석
총페놀 함량은 Singleton et al.(1999)의 방법에 따라 측정하였다. 추출물에 0.08 N Folin-Ciocalteu 시약을 첨가하고, 실온에서 6분 방치한 다음, 3% 탄산나트륨 용액을 첨가하고 실온에서 90분 방치한 뒤, 760 nm에서 흡광도를 측정하였다. 갈산을 사용하여 표준곡선을 작성하였고, 총페놀 함량은 mg 갈산 등가물(GAE)/g 건조중량으로 표기하였다.
총플라보노이드 함량은 Liu et al.(2002)의 방법에 따라 측정하였다. 추출물에 0.15% 아질산나트륨 용액을 첨가하고, 실온에서 6분간 방치한 다음, 0.6% 염화알루미늄 용액을 첨가하고 실온에서 5분간 방치한 뒤, 0.2 N 수산화나트륨 용액을 첨가한 후 510 nm에서 흡광도를 측정하였다. 표준시약으로 카테킨을 사용하여 표준곡선을 작성하였고, 총플라보노이드 함량은 mg 카테킨 등가물(CE)/g 건조중량으로 표기하였다.
DPPH 라디칼 소거활성은 Malterud et al.(1993)의 방법에 따라 측정하였다. DPPH 용액(0.12 mM)을 추출물과 혼합하고, 517 nm에서 30분 동안 분광광도계(Epoch, BioTek, Winooski, VT, USA)를 사용하여 흡광도를 측정하였다. DPPH 라디칼 소거활성은 다음 식으로 계산하였다.
DPPH 라디칼 소거활성(억제 %)=[1-(추출물의 흡광도/추출물 무첨가군의 흡광도)]×100
또한, 양성 대조군으로 α-토코페롤을 사용하여 DPPH 라디칼 소거활성을 비교하였다.
슈퍼옥시드 소거활성은 Liu et al.(1997)의 방법에 따라 측정하였다. 추출물에 62 μM nitro blue tetrazolium과 98 μM β-nicotinamide adenine dinucleotide 용액을 혼합하고, 20 mM Tris와 33 μM phenazine methosulfate 용액을 각각 첨가한 후, 560 nm에서 10분 동안 흡광도를 측정하였다. 슈퍼옥시드 소거활성은 다음 식으로 계산하였다.
또한, 양성 대조군으로 카테킨을 사용하여 슈퍼옥시드 소거활성을 비교하였다.
퍼옥시니트리트 소거활성은 Kooy et al.(1997)의 방법에 따라 측정하였다. 추출물에 0.05 mM diethylenetriaminepentaacetic acid 용액을 혼합하고, 10 uM dichlorofluorescin 용액과 1 uM 5-amino-3-(4-morpholinyl)-1,2,3-oxadiazolium chloride 용액을 각각 첨가한 후, 여기(excitation) 파장 488 nm와 방출(emission) 파장 525 nm에서 30분 동안 형광광도계(GEMINI XS, Molecular Devices, Sunnyvale, CA, USA)를 사용하여 형광도를 측정하였다. 퍼옥시니트리트 소거활성은 다음 식으로 계산하였다.
또한, 양성 대조군으로 시스테인을 사용하여 퍼옥시니트리트 소거활성을 비교하였다.
ORAC는 Huang et al.(2002)의 방법에 따라 측정하였다. 추출물에 6×10-5 mM 플루오레세인 용액을 첨가하고, 37℃에서 10분 가열한 다음, 19 mM 2,2’-Azobis(2-methylpropionamidine) dihydrochloride(AAPH) 용액을 첨가한 뒤, 여기 파장 485 nm와 방출 파장 530 nm에서 60분 동안 형광도를 측정하였다. 표준시약으로 사용한 Trolox와 추출물의 곡선면적(area under the curve)을 측정하였으며, ORAC는 표준시약 농도와 곡선면적 간의 회귀곡선을 이용하여 nmol/mL Trolox 등가물로 표기하였다. 또한, 양성 대조군으로 아스코르브산을 사용하여 ORAC를 비교하였다.
CUPRAC는 Apak et al.(2004)의 방법에 따라 측정하였다. 추출물에 2.44 mM 염화제일구리, 1.83 mM neocuproine 및 0.24 M 초산암모늄 용액을 첨가하고, 실온에서 1시간 방치한 후, 450 nm에서 흡광도를 측정하였다. Trolox를 사용하여 표준곡선을 작성하였고, CUPRAC는 nmol/mL Trolox 등가물로 표기하였다. 또한, 양성 대조군으로 α-토코페롤을 사용하여 CUPRAC를 비교하였다.
히드록실 라디칼에 의한 슈퍼코일 DNA 밴드의 절단은 Hiramoto et al.(1996)의 방법에 따라 실시하였다. 슈퍼코일 pBR322 DNA 0.2 μg에 추출물을 첨가하고, 0.1 mM 과산화수소 용액과 0.1 mM 황산제일철 용액과 함께 37℃에서 1시간 배양하였다. 배양 후, 0.01% GelRed 염색시약이 포함된 0.8% 아가로스에서 전기영동을 실시하였다. 자외선 하에서 사진을 촬영한 후, DNA 밴드의 밀도는 Image J 1.44 프로그램(NIH, Bethesda, MD, USA)을 사용하여 측정하였으며, 슈퍼코일 DNA 밴드의 절단 억제효과는 슈퍼코일 DNA 밴드의 보유율을 측정함으로써 조사하였다.
RAW 264.7 세포(KCLB No. 40071, 한국세포주은행)를 well당 세포수가 0.5×105 되도록 24-well 플레이트에 분주하고, 37℃, 5% 이산화탄소 배양기에서 배양하였다. 24시간 경과 후, 추출물이 포함된 배지로 교체하고 2시간 전처리하였다. 염증을 유발하기 위해, 지질다당류(lipopolysaccharide, LPS)가 포함된 배지로 교체하고 24시간 배양하였다.
산화질소 농도는 Stuehr & Nathan(1989)의 방법에 따라 측정하였다. 배양한 후, 상등액을 취하고 동량의 Griess 시약(1% sulfanilamide/0.1% naphthylethylene diamine dihydrochloride/5% 인산용액)을 첨가하고, 실온에서 10분 방치한 후, 550 nm에서 흡광도를 측정하였다. 아질산 나트륨을 사용하여 표준곡선을 작성하였고, 콩추출물의 LPS에 대한 염증 억제 효과는 산화질소 생성을 측정함으로써 조사하였다.
4. 통계 분석
IBM SPSS 통계프로그램(Version 25, IBM Corporation, Armonk, NY, USA)을 사용하여, 추출물별 및 종피 색깔별 활성은 일원 분산분석을 실시하여 조사하였고, 평균값의 차이는 Duncan’s multiple range test를 실시하여 p<0.05에서 유의성을 조사하였다. 또한 페놀 화합물 함량과 항산화 활성 및 항염증 효능 간의 상관관계를 파악하기 위하여 상관분석을 실시하여 조사하였다.
III. 결과 및 고찰
1. 총페놀 및 총플라보노이드 함량
페놀 화합물 또는 폴리페놀은 페놀산과 같은 단순 구조부터 탄닌과 같은 고도로 중합된 구조 화합물에 이르기까지 식물계에 광범위하게 존재하며, 유리 라디칼 소거와 금속이온 킬레이트 등의 항산화 활성, 항염증 활성 및 항돌연변이 활성 등에 기인하여 순환계 질병과 암 발생율을 감소시킨다고(Bravo 1998; Zhang & Tsao 2016) 알려져 있다.
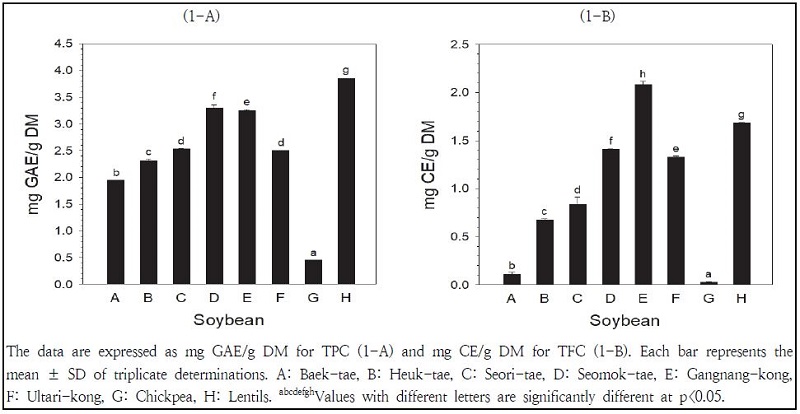
콩추출물의 총페놀 함량은 Fig. 1-A에 나타나 있다. 렌틸콩의 총페놀 함량이 가장 높았고, 병아리콩의 총페놀 함량이 가장 낮게 나타났다. 붉은색 콩의 총페놀 함량(3.20 ± 0.59 mg GAE/g DM)이 검은색 콩의 총페놀 함량(2.72 ± 0.45 mg GAE/g DM)에 비해 높은 경향으로 (P>0.05) 나타났고, 노란색 콩의 총페놀 함량(1.20 ± 0.82 mg GAE/g DM)이 가장 낮게 나타났다. 붉은색 콩의 총페놀 함량은 렌틸콩>강남콩>울타리콩 순으로 높게 나타났으며, 검은색 콩의 총페놀 함량은 서목태>서리태>흑태 순으로 높게 나타났다. 노란색 콩에서는 병아리콩의 총페놀 함량이 백태에 비해 낮게 나타났다.
플라보노이드는 과일, 채소 및 음료에 널리 포함되어 있는 폴리페놀 구조를 가지는 식물의 2차 대사산물(Bravo 1998)로써, 플라본, 플라보놀, 플라바논, 칼콘, 안토시아닌, 이소플라보노이드 등으로 분류(Tsao 2010)되며, 특히 이소플라보노이드는 콩 등의 두과식물에 주로 존재하며, 항산화와 항염증을 포함한 다양한 생물학적 활성(Panche et al. 2016)이 보고되고 있다.
콩추출물의 총플라보노이드 함량은 Fig. 1-B에 나타나 있다. 강낭콩의 총플라보노이드 함량이 가장 높았고, 병아리콩의 총플라보노이드 함량이 가장 낮게 나타났다. 붉은색 콩의 총플라보노이드 함량(1.70 ± 0.33 mg CE/g DM)이 검은색 콩의 총플라보노이드 함량(0.97 ± 0.33 mg CE/g DM)에 비해 높게 나타났고, 노란색 콩의 총플라보노이드 함량(0.07 ± 0.05 mg CE/g DM)이 가장 낮게 나타났다. 붉은색 콩의 총플라보노이드 함량은 강낭콩>렌틸콩>울타리콩 순으로 높게 나타났으며, 검은색 콩의 총플라보노이드 함량은 서목태>서리태>흑태 순으로 높게 나타났다. 노란색 콩에서는 병아리콩의 총플라보노이드 함량이 백태에 비해 낮게 나타났다. 노란색 콩에 비해 검은색 콩의 총페놀 및 총플라보노이드 함량이 높게 나타난 본 연구결과는 기존에 보고된 연구결과(Myung & Hwang 2008; Lee et al. 2014)와 일치하고 있다.
2. 라디칼 소거활성
콩추출물(5 mg/mL)의 DPPH 라디칼 소거활성은 Fig. 2-A에 나타나 있다. 렌틸콩의 소거활성이 가장 높았고, 병아리콩의 소거활성이 가장 낮게 나타났다. 붉은색 콩의 소거활성(79.9 ± 8.2%)이 검은색 콩의 소거활성(69.7 ± 7.64%)에 비해 높게 나타났고, 노란색 콩의 소거활성(16.7 ± 4.7%)이 가장 낮게 나타났다. 붉은색 콩에서 렌틸콩>강낭콩>울타리콩 순으로, 그리고 검은색 콩에서는 서목태>서리태>흑태 순으로 DPPH 소거활성이 높게 나타났다. 서목태의 소거활성은 강낭콩과 유사하게 나타났다. 노란색 콩에서는 병아리콩의 소거활성이 백태에 비해 낮게 나타났다.
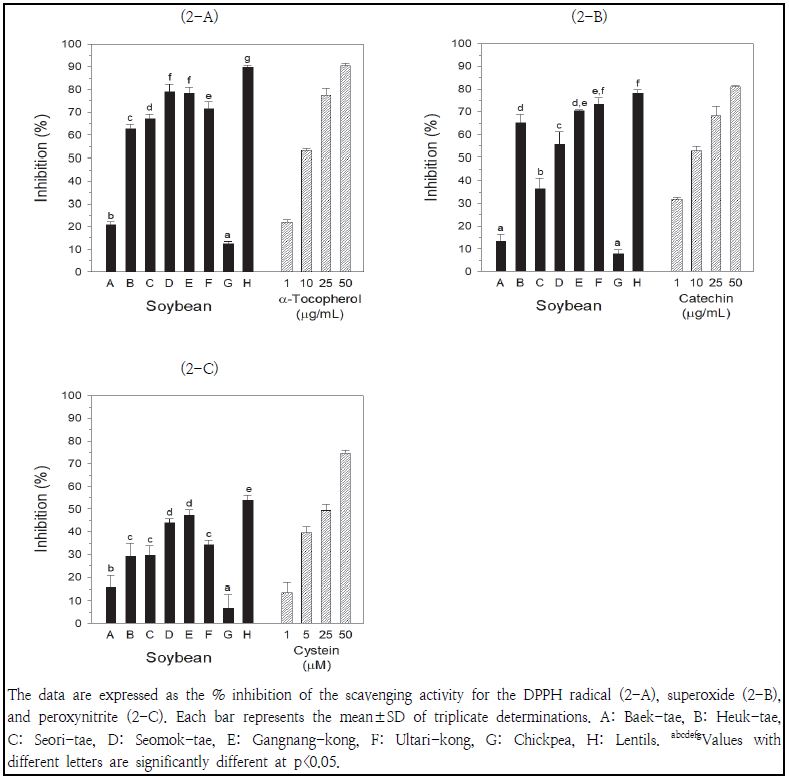
Scavenging activities of the DPPH radical (2-A), superoxide (2-B), and peroxynitrite (2-C) of various soybean extracts.
양성 대조군으로 사용한 α-토코페롤의 소거활성은 1, 10, 25 및 50 μg/mL 농도에서 각각 21.9, 53.1, 77.5 및 90.4%로 측정되어, 백태와 렌틸콩 추출물의 DPPH 라디칼 소거활성(20.9와 89.8%)은 각각 1과 50 μg/mL 농도의 α-토코페롤과 유사하게 나타났다. So et al.(2001)은 검은색 콩과 노란색 콩의 DPPH 소거활성에 차이가 없다고 보고한 바 있으나, 본 연구의 결과는 흑태, 서리태, 쥐눈이콩 등의 검은색 콩이 백태 등의 노란색 콩에 비해 DPPH 소거활성이 높다고 보고된 연구결과(Myung & Hwang 2008; Lee et al. 2014)와 유사하였다.
콩추출물(20 mg/mL)의 슈퍼옥시드 소거활성은 Fig. 2-B에 나타나 있다. 렌틸콩과 울타리콩의 소거활성이 가장 높았고, 백태와 병아리콩의 소거활성이 가장 낮게 나타났다. 붉은색 콩의 소거활성(74.0 ± 3.7%)이 검은색 콩의 소거활성(52.5 ± 13.3%)에 비해 높게 나타났고, 노란색 콩의 소거활성(10.5 ± 3.8%)이 가장 낮게 나타났다. 붉은색 콩에서는 렌틸콩이 강낭콩에 비해 소거활성이 높게 나타났으며, 울타리콩의 소거활성은 렌틸콩이나 강낭콩의 소거활성과 유사하게 나타났다. 검은색 콩에서는 흑태>서목태>서리태 순으로 소거활성이 높게 나타났다. 흑태의 소거활성은 강낭콩과 유사하게 나타났다. 노란색 콩에서는 백태와 병아리콩 간에 소거활성의 차이는 없었다. 양성 대조군으로 사용한 카테킨의 소거활성은 1, 10, 25 및 50 μg/mL 농도에서 각각 31.8, 52.7, 68.2 및 81.0%로 측정되어, 흑태와 렌틸콩 추출물의 슈퍼옥시드 소거활성(65.3과 78.1%)은 각각 25과 50 μg/mL 농도의 카테킨의 소거활성과 유사하게 나타났다. Lee et al.(2010)은 검은색 콩의 안토시아닌 추출물이 농도 의존적으로 슈퍼옥시드를 소거시켰으며, 0.5% 안토시아닌 추출물은 슈퍼옥시드를 100% 소거하였다고 보고한 바 있다. 콩의 조추출물을 사용한 본 연구에서는 2%(20 mg/mL) 흑태 추출물의 슈퍼옥시드 소거활성이 65.3%로 나타났다.
퍼옥시니트리트는 생체내에서 슈퍼옥시드 라디칼과 산화질소의 반응에 의해 생성되는 반응질소종으로서, DNA, 단백질, 지질 등을 산화시키고 니트로화(nitration)시킴으로써 세포 손상을 유발시키는 강력한 산화제이다(Pacher et al. 2007).
콩추출물(0.2 mg/mL)의 퍼옥시니트리트 소거활성은 Fig. 2-C에 나타나 있다. 렌틸콩의 소거활성이 가장 높았고, 병아리콩의 소거활성이 가장 낮게 나타났다. 붉은색 콩의 소거활성(45.2 ± 8.7%)이 검은색 콩의 소거활성(34.3 ± 8.0%)에 비해 높게 나타났고, 노란색 콩의 소거활성(11.4 ± 7.1%)이 가장 낮게 나타났다. 붉은색 콩의 소거활성은 렌틸콩>강낭콩>울타리콩 순으로 높게 나타났으며, 검은색 콩에서는 서목태의 소거활성이 흑태와 서리태에 비해 높게 나타났다. 서목태의 소거활성은 강낭콩과 유사하게 나타났다. 노란색 콩에서는 병아리콩의 소거활성이 백태에 비해 낮게 나타났다. 양성 대조군으로 사용한 시스테인의 소거활성은 1, 5, 25 및 50 μM 농도에서 각각 13.5, 39.7, 49.3 및 74.5%로 측정되어, 백태와 렌틸콩 추출물의 퍼옥시니트리트 소거활성(16.0과 53.9%)은 각각 1과 25 μM 농도의 시스테인과 유사하게 나타났다.
3. ORAC
ORAC 분석법은 Trolox를 표준물질로 사용하여, 추출물이 AAPH에 의해 생성된 퍼옥실 라디칼로 인한 플루오레세인의 산화적 분해(형광도 감소)로부터 보호 정도를 측정하는 방법이다(Huang et al. 2002).
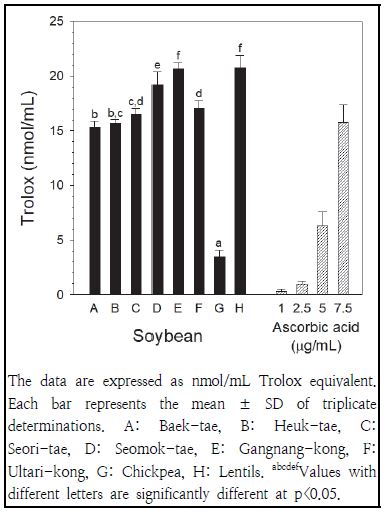
콩추출물(0.2 mg/mL)의 ORAC은 Fig. 3에 나타나 있다. 렌틸콩과 강낭콩의 효능이 가장 높았고, 병아리콩의 효능이 가장 낮게 나타났다. 붉은색 콩의 효능(19.5 ± 2.0 nmol/mL)이 검은색 콩의 효능(17.1 ± 1.7 nmol/mL)에 비해 높은 경향으로 (p>0.05) 나타났고, 노란색 콩의 효능(9.4 ± 6.4 nmol/mL)이 가장 낮게 나타났다. 붉은색 콩에서 렌틸콩과 강낭콩의 효능은 울타리콩에 비해 높게 나타났으며, 검은색 콩에서는 서목태의 효능이 흑태와 서리태에 비해 높게 나타났다. 노란색 콩에서는 병아리콩의 효능이 백태에 비해 낮게 나타났다. 양성 대조군으로 사용한 아스코르브산의 효능은 1, 2.5, 5 및 7.5 μg/mL 농도에서 각각 0.3, 1.0, 6.3 및 15.8 nmol/mL Trolox로 측정되어, 병아리콩(3.5 nmol/mL)을 제외한 나머지 콩들(15.3∼20.8 nmol/mL)의 효능은 7.5 μg/mL 농도의 아스코르브산과 비교하여 유사하거나 높게 나타났다. 본 연구의 결과는 검은색 콩이 갈색, 녹색 및 노란색 콩에 비해 퍼옥실 라디칼 소거활성이 높게 나타났다고 보고된 연구결과(Slavin et al. 2009)와 일치하고 있다.
4. CUPRAC
CUPRAC 분석법은 구리(II)-neocuproine을 산화제로서 사용하여 추출물의 구리이온에 대한 환원력을 측정하는 방법이다(Apak et al. 2004).
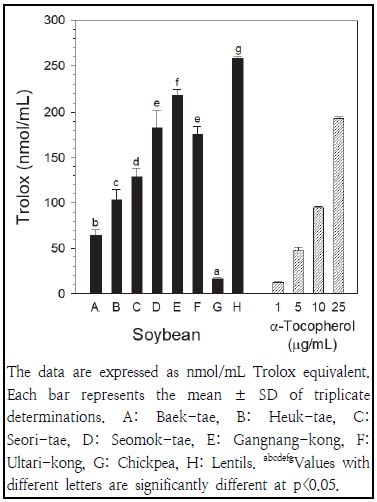
콩추출물(4 mg/mL)의 CUPRAC은 Fig. 4에 나타나 있다. 렌틸콩의 환원력이 가장 높았고, 병아리콩의 환원력이 가장 낮게 나타났다. 붉은색 콩의 환원력(217.0 ± 36.2 nmol/mL)이 검은색 콩의 환원력(138.6 ± 37.3 nmol/mL)에 비해 높게 나타났고, 노란색 콩의 환원력(40.3 ± 26.4 nmol/mL)이 가장 낮게 나타났다. 붉은색 콩의 환원력은 렌틸콩>강낭콩>울타리콩 순으로 높게 나타났으며, 검은색 콩의 환원력은 서목태>서리태>흑태 순으로 높게 나타났다. 서목태의 환원력은 울타리콩과 유사하게 나타났다. 노란색 콩에서는 병아리콩의 환원력이 백태에 비해 낮게 나타났다. 양성 대조군으로 사용된 α-토코페롤의 환원력은 1, 5, 10 및 25 μg/mL 농도에서 각각 12.1, 47.5, 94.5 및 193.3 nmol/mL Trolox로 측정되어, 렌틸콩의 환원력(258.0 nmol/mL)은 25 μg/mL 농도의 α-토코페롤 환원력에 비해 높게 나타났다. Lee et al.(2014)은 흑태, 서리태 등의 검은색 콩이 백태인 노란색 콩에 비해 철이온 환원력(ferric reducing antioxidant power)이 높게 나타났다고 보고한 바 있어, 본 연구에서 관찰된 검은색 콩의 높은 환원력 결과와 유사한 경향을 나타내었다.
5. 슈퍼코일 DNA 밴드 절단 억제효과
콩추출물(40 mg/mL)이 히드록실 라디칼에 의해 유도된 슈퍼코일 DNA 밴드 절단에 미치는 효과는 Fig. 5과 Table 1에 나타나 있다. 과산화수소와 황산제일철 처리에 의해 생성되는 히드록실 라디칼 존재하에, pBR322 DNA의 슈퍼코일 형태는 선형 형태로 전환되었다(lane 1 vs 2, Fig. 5). 히드록실 라디칼 존재하에 콩추출물 첨가 시 울타리콩과 서리태의 슈퍼코일 DNA 밴드의 보유율이 가장 높게 나타났다. 붉은색 콩의 슈퍼코일 DNA 밴드 보유율(71.4 ± 17.8%)이 검은색 콩과 노란색 콩의 DNA 밴드 보유율(29.1 ± 39.6 및 3.6 ± 0.4%)에 비해 높게 나타났으며, 서리태를 제외한 검은색 콩들의 슈퍼코일 DNA 밴드 보유율은 노란색 콩의 보유율과 유사하게 낮게 나타났다. 본 연구에서 콩추출물이 히드록실 라디칼의 산화 스트레스에 의해 유도된 DNA 밴드 절단을 억제시킨 결과와 유사하게, Wei et al.(1996)은 콩의 주요 이소플라본인 제니스테인이 Fenton 반응에 의해 유도된 DNA 손상을 억제시켰다고 보고한 바 있다.
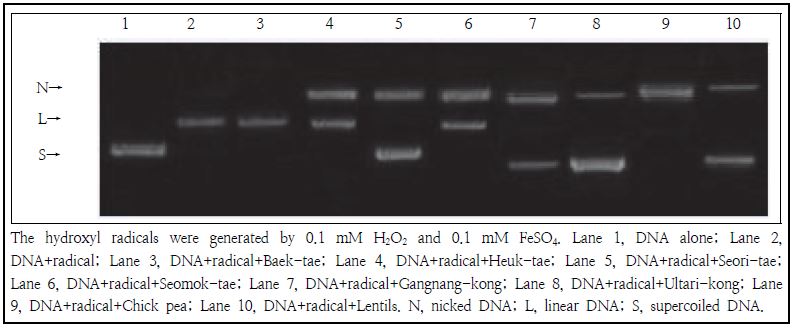
Electrophoresis of pBR322 DNA treated with hydroxyl radicals in the presence of various soybean extracts.
6. 염증 억제효과
염증은 미생물 감염, 조직 손상 등에 의해 유도되는 생체 반응으로써 선천성 면역반응에 의해 개시된다(Barton 2008). 산화질소는 순환계, 면역계 등에서 생물학적 활성을 조절하는 신호물질로 작용하는 라디칼이며(Moncada et al. 1991), 특히 E. coli LPS 처리에 의해 대식세포는 과다한 산화질소를 생성하여 염증을 유발시킨다고(Stuehr & Marletta 1985) 알려져, 천연물추출물의 항염증 연구의 모델로써 사용되고 있다.
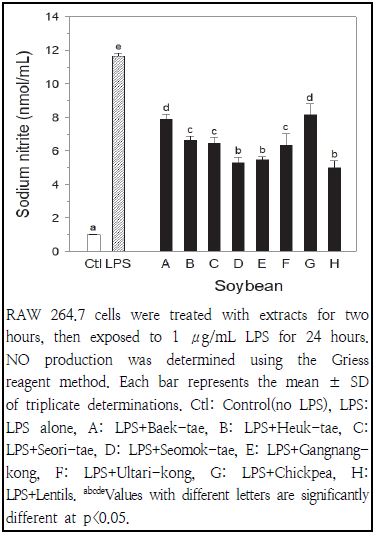
콩추출물(4 mg/mL)의 첨가가 LPS로 유발된 대식세포에서 산화질소 생성에 미치는 효과는 Fig. 6에 나타나 있다. RAW 264.7 세포에 LPS 무처리 및 1 μg/mL 농도의 LPS 처리시 생성된 산화질소 농도는 각각 1.0 및 11.7 nmol/mL로 나타나, 염증 유발을 확인하였다. 렌틸콩, 서목태 및 강낭콩이 LPS에 의한 유도된 산화질소 농도를 가장 높게 감소시켜(5.0, 5.3 및 5.5 nmol/mL) 항염증 효과가 가장 높았다. 반면에, 병아리콩과 백태 처리에 의해 생성된 산화질소 농도가 각각 8.2 및 7.9 nmol/mL로 가장 높게 나타나, 항염증 효과가 가장 낮았다. 붉은색 콩과 검은색 콩 처리 간에 LPS에 의해 유도된 산화질소의 농도는 차이가 없었다(5.6 ± 0.7 vs 6.1 ± 0.7 nmol/mL, p>0.05). 붉은색 콩이나 검은색 콩의 항염증 효과(56.8 ± 6.8과 51.9 ± 6.5% 억제)가 노란색 콩의 항염증 효과(34.1 ± 4.6% 억제)에 비해 높은 것으로 나타났다. 본 연구결과와 유사하게, 5 mg/mL 농도의 콩추출물이 RAW 264.7 세포에서 LPS에 의한 산화질소 생성을 18.5% 억제시켰고(Wu et al. 2012), 검은색 콩의 안토시아닌추출물과 콩 이소플라본이 농도 의존적으로 LPS에 의해 유발된 산화질소 생성을 억제시켰다고(Sheu et al. 2001; Lee et al. 2010) 보고된 바 있다.
7. 총페놀과 총플라보노이드 함량, 항산화 활성 및 항염증 효능 간 상관관계
페놀 화합물 함량과 항산화 활성 및 항염증 효능 간의 상관관계를 분석한 결과는 Table 2에 나타나 있다. DPPH 소거활성, 슈퍼옥시드 소거활성 및 CUPRAC와 총페놀 함량 간에 양의 상관관계(r=0.913, 0.798 및 0.938, p<0.01)가 나타났으며, 총플라보노이드 함량 간에도 양의 상관관계(r=0.899, 0.857 및 0.947, p<0.01)가 관찰되었다. 그러나 ORAC 및 퍼옥시니트리트 소거활성과 총페놀 또는 총플라보노이드 함량 간에는 유의적인 상관관계가 관찰되지 않았다(p>0.05). LPS로 유발된 산화질소 생성과 총페놀 함량 간에는 유의적 상관관계가 나타나지 않았으나(p>0.05), 산화질소 생성과 총플라보노이드 함량 간에 음의 상관관계(r=-0.489, p<0.05)가 나타났다. 산화질소 생성과 ORAC 또는 퍼옥시니트리트 소거활성 간에 음의 상관관계(r=-0.801 또는 -0.915, p<0.01)가 관찰되었다. 본 연구에서 관찰된 페놀 화합물 함량과 라디칼 소거활성 또는 환원력과의 높은 상관관계는 기존에 보고된 연구결과(Kumar et al. 2010; Lee et al. 2014)와 일치하고 있으나, Szymczak et al.(2017)은 총페놀 함량과 라디칼 소거활성 또는 환원력 간에 유의적인 상관관계가 관찰되지 않았다고 보고한 바 있다. 또한, 본 연구에서 항염증 효능과 총플라보노이드 함량 간의 높은 상관성은 콩의 안토시아닌이 농도 의존적으로 LPS에 의해 유발된 산화질소 생성을 억제시켰다는 연구결과(Lee et al. 2010)와 일치하고 있다.
IV. 요약 및 결론
본 연구에서는 시중에 유통되고 있는 붉은색(강낭콩, 울타리콩 및 렌틸콩), 검은색(흑태, 서리태 및 서목태) 및 노란색 콩(백태와 병아리콩)들의 아세톤추출물의 항산화 활성과 항염증 효능을 비교·조사하였다. 붉은색 콩의 DPPH 라디칼, 슈퍼옥시드 및 퍼옥시니트리트 소거활성과 구리 환원력은 검은색 콩에 비해 높게 나타났고, 노란색 콩의 소거활성이 가장 낮게 나타났다. 붉은색 콩과 검은색 콩 간의 산소라디칼 흡수 효능과 총페놀 함량의 차이는 없었으며, 노란색 콩에 비해 산소라디칼 흡수 효능과 총페놀 함량이 높게 나타났다. 히드록실 라디칼에 의해 유도된 슈퍼코일 DNA 밴드의 절단은 검은색 콩이나 노란색 콩에 비해 붉은색 콩에 의해 보다 더 억제되었다. LPS에 의해 유도된 RAW 264.7 세포의 산화질소 생성은 노란색 콩에 비해 붉은색과 검은색 콩에 의해 보다 더 억제되었다. 항산화 활성 중에서 DPPH 소거활성, 슈퍼옥시드 소거활성 및 구리환원력과 총페놀 함량 또는 총플라보노이드 함량 간에 상관관계가 높게 나타났다. 항염증 효능과 총플라보노이드 함량 간의 상관성도 높게 나타났다. 따라서 본 연구 결과들은 붉은색 콩과 검은색 콩의 항산화 및 항염증 효과가 노란색 콩의 효과에 비해 높음을 나타내며, 이러한 효과는 높은 페놀 화합물 함량에 기인한 것으로 사료된다.
Acknowledgments
This research was supported by Sangji University Research Fund, 2018
References
-
Adlercreutz H, Mazur W(1997) Phyto-oestrogens and Western diseases. Ann Med 29(2), 95-120.
[https://doi.org/10.3109/07853899709113696]

-
Apak R, Güçlü K, Özyürek M, Karademir SE(2004) Novel total antioxidant capacity index for dietary polyphenols and vitamins C and E, using their cupric ion reducing capability in the presence of neocuproine: CUPRAC method. J Agric Food Chem 52(26), 7970-7981.
[https://doi.org/10.1021/jf048741x]

-
Barnes S, Sfakianos J, Coward L, Kirk M(1996) Soy isoflavones and cancer prevention. Underlying biochemical and pharmacological issues. Adv Exp Med Biol 401, 87-100.
[https://doi.org/10.1007/978-1-4613-0399-2_7]

-
Barton GM(2008) A calculated response: control of inflammation by the innate immune system. J Clin Invest 118(2), 413-420.
[https://doi.org/10.1172/JCI34431]

-
Bravo L(1998) Polyphenols: chemistry, dietary sources, metabolism, and nutritional significance. Nutr Rev 56(11), 317-333.
[https://doi.org/10.1111/j.1753-4887.1998.tb01670.x]

-
Cho KM, Ha TJ, Lee YB, Seo WD, Kim JY, Ryu HW, Jeong SH, Kang YM, Lee JH(2013) Soluble phenolics and antioxidant properties of soybean (Glycine max L.) cultivars with varying seed coat colours. J Funct Foods 5(3), 1065-1076.
[https://doi.org/10.1016/j.jff.2013.03.002]

-
Hiramoto K, Ojima N, Sako KI, Kikugawa K(1996) Effect of plant phenolics on the formation of the spin-adduct of hydroxyl radical and the DNA strand breaking by hydroxyl radical. Biol Pharm Bull 19(4), 558-563.
[https://doi.org/10.1248/bpb.19.558]

-
Huang D, Ou B, Hampsch-Woodill M, Flanagan JA, Prior RL(2002) High-throughput assay of oxygen radical absorbance capacity(ORAC) using a multichannel liquid handling system coupled with a microplate fluorescence reader in 96-well format. J Agric Food Chem 50(16), 4437-4444.
[https://doi.org/10.1021/jf0201529]

-
Kooy NW, Royall JA, Ischiropoulos H(1997) Oxidation of 2’,7’-dichlorofluorescin by peroxynitrite. Free Radic Res 27(3), 245-254.
[https://doi.org/10.3109/10715769709065763]

-
Kumar V, Rani A, Dixit AK, Pratap D, Bhatnagar D(2010) A comparative assessment of total phenolic content, ferric reducing-anti-oxidative power free radical-scavenging activity, vitamin C and isoflavones content in soybean with varying seed coat colour. Food Res Int 43(1), 323-328.
[https://doi.org/10.1016/j.foodres.2009.10.019]

- Lee HJ, Do WN, Kim YH(2010) In vitro biological activities of anthocyanin crude extracts from black soybean. Korean J Crop Sci 55(1), 65-69
-
Lee LS, Choi EJ, Kim CH, Kim YB, Kum JS, Park JD(2014) Quality characteristics and antioxidant properties of black and yellow soybeans. Korean J Food Sci Technol 46(6), 757-761.
[https://doi.org/10.9721/KJFST.2014.46.6.757]

-
Liu F, Ooi VEC, Chang ST(1997) Free radical scavenging activities of mushroom polysaccharide extracts. Life Sci 60(10), 763-771.
[https://doi.org/10.1016/S0024-3205(97)00004-0]

- Liu K(1997) Soybeans: chemistry, technology and utilization. 1st ed. New York: Chapman & Hall, pp25-113
-
Liu M, Li XQ, Weber C, Lee CY, Brown J, Liu RH(2002) Antioxidant and antiproliferative activities of raspberries. J Agric Food Chem 50(10), 2926-2930.
[https://doi.org/10.1021/jf0111209]

-
Malterud KE, Farbrot TL, Huse AE, Sund RB (1993) Antioxidant and radical scavenging effects of anthraquinones and anthrones. Pharmacol 47(suppl 1), 77-85.
[https://doi.org/10.1159/000139846]

- Moncada S, Palmer RMJ, Higgs EA(1991) Nitric oxide: physiology, pathophysiology, and pharmacology. Pharmacol Rev 43(2), 109-142
- Myung J, Hwang I(2008) Functional components and antioxidative activities of soybean extracts. Korea Soybean Digest 25(1), 23-29
-
Pacher P, Beckman JS, Liaudet L(2007) Nitric oxide and peroxynitrite in health and disease. Physiol Rev 87(1), 315-424.
[https://doi.org/10.1152/physrev.00029.2006]

-
Panche AN, Diwan AD, Chandra SR(2016) Flavonoids: an overview. J Nutr Sci 5, e47.
[https://doi.org/10.1017/jns.2016.41]

-
Potter SM(1998) Soy protein and cardiovascular disease: the impact of bioactive components in soy. Nutr Rev 56(8), 231-235.
[https://doi.org/10.1111/j.1753-4887.1998.tb01754.x]

-
Prakash D, Upadhyay G, Singh BN, Singh HB (2007) Antioxidant and free radical-scavenging activities of seeds and agri-wastes of some varieties of soybean(Glycine max). Food Chem 104(2), 783-790.
[https://doi.org/10.1016/j.foodchem.2006.12.029]

-
Ryu SH, Moon GS(2003) Antioxidative and antiaging effects of dietary yellow and black soybean in rats. J Korean Soc Food Sci Nutr 32(4), 591-597
[https://doi.org/10.3746/jkfn.2003.32.4.591]

-
Sheu F, Lai HH, Yen GC(2001) Suppression effect of soy isoflavones on nitric oxide production in RAW 264.7 macrophages. J Agric Food Chem 49(4), 1767-1772.
[https://doi.org/10.1021/jf001198+]

-
Singleton VL, Orthofer R, Lamuela-Raventós RM(1999) Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent. Methods Enzymol 299, 152-178.
[https://doi.org/10.1016/S0076-6879(99)99017-1]

-
Slavin M, Kenworthy W, Yu L(2009) Antioxidant properties, phytochemical composition, and antiproliferative activity of Maryland-grown soybeans with colored seed coats. J Agric Food Chem 57(23), 11174-11185.
[https://doi.org/10.1021/jf902609n]

- So EH, Kuh JH, Park KY, Lee YH(2001) Varietal difference of isoflavone content and antioxidant activity in soybean. Korean J Breed 33(1), 35-39
-
Stuehr DJ, Marletta MA(1985) Mammalian nitrate biosynthesis: mouse macrophages produce nitrite and nitrate in response to Escherichia coli lipopolysaccharide. Proc Natl Acad Sci USA 82(22), 7738-7742.
[https://doi.org/10.1073/pnas.82.22.7738]

-
Stuehr DJ, Nathan CF(1989) Nitric oxide: a macrophage product responsible for cytostasis and respiratory inhibition in tumor target cells. J Exp Med 169(5), 1543-1555.
[https://doi.org/10.1084/jem.169.5.1543]

-
Szymczak G, Wojciak-Kosior M, Sowa I, Zapala K, Strzemski M, Kocjan R(2017) Evaluation of isoflavone content and antioxidant activity of selected soy taxa. J Food Compos Anal 57, 40-48.
[https://doi.org/10.1016/j.jfca.2016.12.015]

-
Tsao R(2010) Chemistry and biochemistry of dietary polyphenols. Nutr 2(12), 1231-1246.
[https://doi.org/10.3390/nu2121231]

-
Valko M, Leibfritz D, Moncol J, Cronin MTD, Mazur M, Telser J(2007) Free radicals and antioxidants in normal physiological functions and human disease. Int J Biochem Cell Biol 39(1), 44-84.
[https://doi.org/10.1016/j.biocel.2006.07.001]

-
Wei H, Cai Q, Rahn RO(1996) Inhibition of UV light- and Fenton reaction-induced oxidative DNA damage by the soybean isoflavone genistein. Carcinog 17(1), 73-77.
[https://doi.org/10.1093/carcin/17.1.73]

-
Wu SH, Shu XO, Chow WH, Xiang YB, Zhang X, Li HL, Cai Q, Ji BT, Cai H, Rothman N, Gao YT, Zheng W, Yang G(2012) Soy food intake and circulating levels of inflammatory markers in Chinese women. J Acad Nutr Diet 112(7), 996-1004.
[https://doi.org/10.1016/j.jand.2012.04.001]

-
Xu B, Chang SK(2008) Characterization of phenolic substances and antioxidant properties of food soybeans grown in North Dakota-Minnesota region. J Agric Food Chem 56(19), 9102-9113.
[https://doi.org/10.1021/jf801451k]

-
Zhang H, Tsao R(2016) Dietary polyphenols, oxidative stress and antioxidant and anti-inflammatory effects. Curr Opin Food Sci 8, 33-42.
[https://doi.org/10.1016/j.cofs.2016.02.002]