노간주나무 열매 추출물의 영양성분 분석 및 유방암 세포에서의 증식 억제 효과 연구


This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study examined the chemical profile and antioxidant effects of Juniperus rigida Sieb. et. Zucc. (JS) fruit extract. The carbohydrate content was high, and leucine, lysine, and histidine were the major total essential amino acid components in the JS fruit extract. The major organic acids were malic acid, citric acid, and tartaric acid. Saturated fatty acids (stearic acid, capric acid, heptadecanoic acid, and tricosanoic acid) and monounsaturated fatty acids (cis-11-eicosenoic acid and palmitoleic acid) were detected in the JS fruit extract. The order of mineral content was Ca>K>Mg. The total polyphenol and flavonoid contents were 84.22 mg TAE/g and 136.24 mg RE/g, respectively. Furthermore, the JS fruit extract (0.05, 0.1, 0.2 mg/mL) had a growth inhibitory effect on MCF-7 and HCC38 breast cancer cells; the effect was greater in the MCF-7 cell line than in the HCC38 cell line. The present study showed that JS fruit extracts play a major role in the antioxidant and anti-cancer effects in breast cancer cells.
Keywords:
Juniperus rigida Sieb. et. Zucc. chemical composition, antioxidant activity, cell growth, breast cancerI. 서론
현대인들은 평균 수명의 증가로 인해 질병 없이 건강한 삶을 유지하기 위한 관심이 높아지고 있다. 이와 더불어 식물 유래 기능성 재료 및 식품 시장은 최근 소비자 인식 증가와 건강한 식습관 추구의 라이프 스타일의 변화로 인해 크게 성장하였다(Lee et al. 2019a). 최근 천연물 내의 여러 다양한 생리활성물질들이 질병의 예방 및 치료 등과 같은 건강에 유익한 효과를 주는 것으로 밝혀지면서 새로운 천연소재의 발굴 및 개발에 대한 관심이 높아지고 있는 실정이다(Lee et al. 2019b).
향나무과의 일종인 다년생 수목인 노간주 나무속은 측백나무과에 속하며 한국, 중국, 시베리아에 주로 분포되어 있다. 노간주나무(Juniperus rigida Sieb. et. Zucc.)는 추위에 강하고 해풍에 잘 견디는 특성으로 해안이나 간척지 부근에서 방풍림 또는 풍치림으로 이용되고 있다(Adams 2000). 노간주나무의 열매는 두송실이라고 부르며 거풍제습과 이뇨작용이 있어 관절염에 외용약으로 쓰거나 부조, 통풍, 요로 생식기 질환에 사용한다(Mashima 1970). 서양에서는 두송실을 이용하여 술을 담궈 마시거나 향으로 이용하였다(Kim 1996). 노간주나무의 열매는 α-pinene, myrene, careen, limonene, p-cymene 등이 함유되어 있다고 알려져 있다(Jo et al. 1999). 지금까지 노간주나무를 이용한 연구로는 노간주나무 열매의 지질의 일반성분과 지방산 분석(Shin 2003), 섬유아세포를 이용한 주름개선 및 흑세포종에서의 미백효과(Jun et al. 2013; Lee et al. 2013), 항산화 및 항당뇨 효과 (Kim et al. 2014) 등으로 노간주나무 열매를 이용한 연구는 미비한 상황이다.
인체에서 생성되는 반응성 산소종은 내인성 항산화 방어에 의해 완전히 제거되기 힘들며 DNA, 지질, 단백질 등에 대한 지속적인 산화적 손상을 일으켜 암을 포함한 퇴행성 질환 발병에 영향을 미친다(Halliwell 1996). 식물 유래 항산화제는 이러한 질병을 예방하는 데 중요하다고 보고되고 있으며, 최근 암의 예방 및 치료를 위해 천연물의 효능에 대한 연구가 활발히 진행되고 있다. 기존 항암제의 반복적인 사용은 내성을 일으킬수 있으나 천연물 내의 생리활성물질은 독성 및 부작용이 적어 잠재적인 암 치료를 위한 대체 물질로 제안되고 있다(Kim et al. 2018)
따라서 본 연구는 노간주나무 열매의 에탄올 추출물을 이용하여 이화학적 성분 및 항산화 활성을 분석하고자 하였으며, 유방암세포주를 이용한 세포의 증식에 미치는 영향에 대해 살펴보았다.
Ⅱ. 연구방법
1. 실험재료 및 시료추출
본 연구에 사용된 노간주나무 열매는 2019년 12월에 ㈜청명약초에서 건조된 열매의 형태로 구입하여 사용하였다. 건조된 노간주나무 열매를 분쇄기(HR1378, Philips N.V., Karner, Slovenia)를 이용하여 분쇄한 후 분말화하여 시료무게의 50배인 80% ethanol을 첨가하고 65℃ heating mantle(Mtops ms-265, Seoul, Korea)의 환류냉각관을 부착하여 3시간씩 3회 추출한 후 Whatman filter paper(Whatman No. 2)로 여과 시켰다. 여과액을 rotary vacuum evaporator(VACUUM NVC-1100, EYELA Co., Ltd., Tokyo, Japan)를 이용하여 감압·농축하고 농축된 노간주나무 열매를 24시간 냉동시킨 후 동결건조기(ED 8512, Ilshin, Yangju, Korea)를 이용하여 72시간 동안 동결건조하였다. 건조된 노간주나무 열매 추출물은 –70℃ deep freezer(MDFU52V, Sanyo Electric Co., Ltd., Osaka, Japan)에 보관하면서 사용하였다.
2. 일반성분 분석
노간주나무 열매의 일반성분 분석은 Association of Official Analytical Chemists(A.O.A.C 2005)에 따라 실시하였다. 수분 함량은 105℃ 상압건조법, 조지방은 Soxhlet법, 조회분은 550℃ 회화법을 이용하여 3회 반복하여 분석하였고, 조단백질은 원소 분석기(Thermo Quest, Flash 2000, Milan, Italy)를 이용하여 전질소량을 정량한 값에 질소계수인 6.25를 곱하여 분석하였으며, 탄수화물은 전체 100%에서 수분, 조단백질, 조지방, 조회분의 값을 제한 값으로 표시하였다.
3. 지방산 분석
노간주나무 열매의 지방산 분석은 Wungaarden의 방법(1967)에 따라 분석을 시행하였다. 원통여지에 시료 2 g을 담아 chloroform-methanol을 이용하여 추출·여과한 다음 감압·농축시킨 후 중량법으로 함량을 측정하였다. 가지형 플라스크에 추출한 시료 약 100 mg을 취하고 1N-KOH·ethanol 용액 4 mL를 섞어 유지방울이 없어질 때까지 교반하였다. 유지방울이 없어지면 14% BF3-Methanol 5 mL를 가한 뒤 환류냉각기를 부착하여 5분간 80℃에서 methylester화 하였다. NaCl 포화용액 3 mL과 hexane 1 mL를 첨가하여 흔들어 섞은 후 시험관에 옮겨 정치하였고, 상층을 분리하여 무수 Na2SO4를 넣어 탈수시킨 후 0.5 mL를 vial에 채취해 Gas chromatography (GC-71A, Shimadzu, Kyoto, Japan)로 분석하였다.
4. 유기산 분석
노간주나무 열매의 유기산 분석은 시료 0.5 g을 cap이 달린 삼각플라스크에 넣고 증류수 20 mL를 가한 후, 환류냉각기가 부착된 추출기에서 4시간 가량 80℃ 수욕상에서 가열시키고 Whatman membrane filter paper(1 μm)를 이용해 여과하여 30 mL로 정용하였다. 이를 Whatman membrane filter(0.45 μm)로 여과한 후에 prominence HPLC(Shimadzu, Kyoto, Japan)를 이용해 분석하였다.
5. 구성 아미노산 분석
노간주나무 열매의 구성아미노산 분석은 분해관에 건조된 시료 0.5 g에 6N HCl 3 mL를 혼합하고 탈기하여 121℃에서 24시간 동안 가수분해시킨 후, glass filter로 여액을 여과한 후에 감압·농축하고 sodium phosphate buffer(pH 7.0)를 이용해 10 mL로 정용하였다. 용액 1 mL을 취하여 membrane filter(0.2 μm)로 여과한 다음 아미노산자동분석기(S433-H, SYKAM, Eresing, Germany)를 이용하여 분석하였다.
6. 무기질 분석
노간주나무 열매의 무기질 분석은 A.O.A.C 방법(2005)에 따라 실시 하였다. 시료 0.5 g에 20% HNO3 10 mL와 60% HClO4 3 mL를 가하여 투명하게 변할 때까지 가열한 후에 0.5 M HNO3를 이용해 50 mL로 정용하였다. 각각의 항목별 표준용액을 혼합하고 8 mL씩 vial 병에 취하게 한 다음 0.5 M HNO3를 대조군으로 하여 유도결합플라즈마 분광분석기(ICP-OES, PerkinElmer, MA, USA)를 이용하여 분석하였다.
7. Total flavonoid 함량
Total flavonoid 함량은 Davis법을 일부 변형시켜 Chae et al.의 방법(2002)에 따라 측정하였다. 1.5 mL tube에 diethylene glycol(Sigma, St, Louis, MO, USA) 0.5 mL와 농도별로 희석한 노간주나무 열매 에탄올 추출물 0.5 mL를 첨가 후 충분히 섞어주었다. 1N NaOH를 10 µL를 넣고 37℃에서 1시간 반응시킨 후 UV-spectrophotometer(Bio-Rad, Hercules, CA, USA)로 420 nm에서 흡광도 값을 측정하였다. 표준검량곡선으로 rutin을 표준물질로 이용하였으며 total flavonoid 함량(mg rutin equivalent (RE)/100 g)을 산출하였다.
8. Total polyphenol 함량
Total polyphenol 함량은 Folin-Denis의 방법(1912)에 따라 측정하였다. 노간주나무 열매 에탄올 추출물 0.2 mL와 Folin reagent(Sigma-Aldrich Inc., St. Louis, MO, USA) 0.2 mL를 혼합한 후 실온에서 3분 동안 반응시킨다. 10% Na2CO3용액 0.4 mL를 첨가하고 40분 동안 암소에서 반응시킨 후에 UV-spectrophotometer (Bio-Rad Laboratories, Inc., Hercules, CA, USA)를 이용하여 760 nm에서 흡광도를 측정하였다. 표준검량곡선으로 tannic acid(Sigma, St. Louis, MO, USA)를 표준물질로 이용하였으며 노간주나무 열매 추출물의 total polyphenol 함량을 산출하였다.
9. DPPH 라디칼 소거능 측정
2,2-diphenyl-1-picrylhydrazyl(DPPH) 라디칼 소거능은 Blois의 방법(1958)을 다음과 같이 사용하여 측정하였다. 1.5 mL tube에 0.2 mM DPPH(Sigma-Aldrich, Louis, MO, USA) 시약 900 μL와 농도별로 희석한 노간주나무 열매 시료를 각각 0.1 mL 첨가하였으며 무첨가 시료군에는 에탄올을 사용하였다. 37℃ heating block에 30분간 반응시킨 후 96 well plate에 200 μL씩 분주하여 UV-spectrophotometer(Bio-rad, Hercules, CA, USA)를 이용해 517 nm에서 흡광도를 측정하였다. 시료 농도별 소거능값으로 표준곡선을 이용하여 IC50값을 산출하였다.
10. ABTS+ radical 소거능 측정
2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS) 라디칼 소거능은 Re 등의 방법(1999)을 변형하여 다음과 같이 측정하였다. 7 mM ABTS와 2.4 mM potassium persulfate를 1 : 1 비율로 혼합한 다음 암소에서 24시간 반응시켜 라디칼의 생성을 유도하였다. 반응이 끝난 ABTS+ radical 용액을 734 nm에서 흡광도 값이 0.7~1.0로 되도록 메탄올로 희석하여 사용하였다. 각각의 tube에 희석한 ABTS+ radical 용액 900 μL와 0.125, 0.25, 0.5, 1 mg/mL 농도별로 희석한 노간주나무 열매의 시료 추출물 100 μL를 혼합하여 37℃ heating block에서 30분 동안 반응시킨 후, UV-spectrophotometer (Bio-rad, Hercules, CA, USA)를 이용해 734 nm에서 흡광도를 측정하였다. 시료 농도별 소거능값으로 표준곡선을 이용하여 IC50값으로 산출하였다.
11. 환원력(Reducing power)
노간주나무 열매의 환원력은 Wong et al.(2009)의 방법을 일부 변형하여 측정하였다. 노간주나무 열매 추출물을 0.125, 0.25, 0.5, 1 mg/mL 농도별로 희석하여 tube에 담고 0.2M phosphate buffer(pH 6.6)과 1% potassium ferricyanide를 각각 200 μL씩 첨가한 후 50℃에서 20분간 반응시켰다. 그 후 10% trichloroacetic acid(TCA) 200 μL을 첨가하여 원심분리하였다. 원심분리한 상층액에 0.1% FeCl 용액을 첨가하고 실온에서 10분 동안 방치시킨 후 700nm에서 흡광도를 측정하였다.
12. 세포배양
본 실험에 사용된 인체 유방암세포주인 MCF-7과 HCC38은 한국세포주은행(Korean Cell Line Bank, Seoul, Korea)으로부터 분양받아 사용하였다. 10% fetal bovine serum(FBS)과 1% penicillin/streptomycin을 포함한 RPMI1640 배지(Gibco-BRL, Grand Island, NY, USA)를 사용하였으며, 37℃, 5% CO2 incubator(MCO-18AIC, Sanyo, Osaka, Japan)에서 계대 배양하여 사용하였다.
13. MTS assay
세포배양용 96 welll plate에 MCF-7과 HCC38 (2×103 cells/well) 세포주를 분주하고 24시간 배양한 후, 노간주나무 열매 추출물을 0.1, 0.2, 0.4, 0.8 mg/mL 농도로 처리하였다. 24시간 또는 48시간 처리 후, 각 well에 CellTiter 96® AQueous One Solution Cell Proliferation Assay(MTS) 용액(Promega Co., CA, USA)을 20 µL 첨가하여 37℃, 5% CO2 incubator (MCO-18AIC, Sanyo, Osaka, Japan)에서 반응시키고 UV-spectrophotometer(Bio-Rad, Hercules, CA, USA)를 이용하여 490 nm 흡광도로 측정하였다.
14. 통계처리
실험으로 얻어진 결과치는 평균(mean)과 표준편차(SD)로 나타내었으며 모든 실험은 독립적으로 3회 반복을 통해 얻었다. 각 실험군 간의 유의성 검증은 GraphPad Prism 6 program GraphPad Software, Inc., La Jolla, CA, USA)을 이용하였고, 각 시료간의 통계적 유의성은 p<0.05 수준에서 Student t-test를 이용하여 유의성을 검정하였다.
Ⅲ. 결과 및 고찰
1. 일반성분 분석
노간주나무 열매의 일반성분을 분석한 결과는 Table 1과 같다. 노간주나무 열매의 수분은 6.71%, 조회분 4.50%, 조단백질 3.65%, 조지방 19.27%, 탄수화물 64.87%로 나타났다. 노간주나무 열매의 주요 성분은 탄수화물이었으며, 일반성분 중에서 조단백질 함량이 가장 낮은 것으로 나타났다. 측백나무에 속하는 메타세콰이어나무 열매의 일반성분 함량을 살펴보면, 수분은 8.21%, 조회분 3.55%, 조단백질 2.52%, 조지방 14.43%로 본 연구와 유사한 결과를 보였다(Bae et al. 2013).
2. 구성 아미노산 분석
노간주나무 열매의 구성 아미노산 함량분석은 Table 2와 같다. 노간주나무 열매에서 필수아미노산 8종, 비필수아미노산 8종이 검출되어 총 16종의 아미노산이 검출되었다. 노간주나무 열매의 총 필수아미노산 함량은 1,358.89 mg/100g으로 나타났으며 leucine(256.39 mg/100g), lysine(250.48 mg/100g), histidine(195.27 mg/100g) 순으로 높게 검출되었다. Bae et al.(2013)는 메타세콰이어나무 열매에서 총 필수아미노산 함량이 573.557 mg/100g으로 조사하였으며 본 연구와 다소 차이를 나타내었다. 노간주나무 열매의 비필수아미노산의 총 함량은 2,305.53 mg/100g으로 aspartic acid(527.34 mg/100g), glutamic acid(448.92 mg/100g), arginine(391.72 mg/100g) 순으로 높은 함량을 보였다. 전체 아미노산에 대한 필수아미노산 함량 비율은 60.11%로 나타나 영양학적인 우수함을 나타내었다.
3. 유기산 함량 분석
노간주나무 열매의 유기산 함량은 Table 3과 같다. 노간주나무 열매에서 검출된 유기산은 총 6가지이며 malic acid(7,385.90 ppm), citric acid(5,170.95 ppm), tartaric acid(588.90 ppm), acetic acid(464.52 ppm), succinic acid(272.21 ppm), formic acid(61.71 ppm) 순으로 검출되었다.
4. 지방산 분석
노간주나무 열매의 지방산 분석은 Table 4와 같다. 노간주나무 열매의 포화지방산 4종, 단일불포화지방산 2종을 포함하여 총 6종의 지방산이 검출되었다. 포화지방산 중, stearic acid. capric acid, heptadecanoic acid, tricosanoic acid 순으로 많이 검출되었으며, 단일불포화지방산은 cis-11-eicosenoic acid, palmitoleic acid 순으로 높은 함량을 나타내었다. Ahn et al.(2011)은 측백나무 열매의 주요 지방산 성분이 palmitic acid로 나타났으며 주로 포화지방산 만으로 구성되었다고 하여 본 연구와 다소 차이를 보였다.
5. 무기질 분석
노간주나무 열매의 무기질 분석은 Table 5와 같다. 검출된 총 8종의 무기질 함량은 2,301.93 mg/100g이었으며, Ca, K, Mg 순으로 높게 나타났다. Bae et al.(2013)은 메타세콰이어나무 열매에서 주요 무기질 성분이 Ca, K, P으로 나타나 본 연구와 유사함을 보였다. 노간주나무 열매는 인체의 골격을 구성하는 Ca과 글리코겐 및 단백질 합성 및 혈압을 낮추어 뇌졸중 및 심근경색을 예방하는 K을 많이 함유하고 있는 것으로 나타나 기능성식품 소재로서의 활용이 기대된다.
6. 노간주나무 열매의 추출수율 및 항산화 성분 함량
노간주나무 열매의 추출수율과 total flavonoid 및 total polyphenol 함량을 분석한 결과는 Table 6과 같다. 본 실험의 노간주나무 열매 추출수율은 16.6%로 나타났다. 본 연구에 사용된 노간주나무 열매 에탄올 추출물의 total flavonoid 함량은 136.24 mg RE/g, total polyphenol 함량은 84.22 mg TAE/g으로 나타났다. Kim et al.(2014)은 노간주나무 에탄올 추출물의 total flavonoid 함량 및 total polyphenol 함량을 각각 76.4 mg/g, 116.0 mg/g으로 나타내어 본 연구와의 차이를 보였다. 메타세콰이어나무 열매의 경우, total polyphenol 함량은 19.95mg/g로 본 연구와 다소 차이를 나타내었다(Bae et al. 2013).
7. DPPH 및 ABTS+ radical 소거능 측정
항산화 활성을 평가하기 위한 DPPH와 ABTS+ radical 소거능 활성 측정방법은 항산화능을 지닌 페놀성 물질량이 높을수록 소거활성이 증가되며 free radical 물질인 DPPH와 ABTS+의 소거활성과 유의적인 상관관계를 갖는 것으로 알려져 있다(Koleva et al. 2002). 본 연구에 사용된 노간주나무 열매의 DPPH radical 소거능을 측정한 결과는 Table 7과 같다. 노간주나무 열매의 DPPH radical 소거능은 0.125, 0.25, 0.5, 1.0 mg/mL 농도에서 각각 17.37%, 32.94%, 58.13%, 83.32%로 나타났으며, 50%의 radical 소거능을 나타내는 값인 IC50은 0.52 mg/mL로 나타났다. ABTS+ radical 소거능은 0.125, 0.25, 0.5 mg/mL 농도에서 각각 45.82%, 80.55%, 94.77%의 ABTS+ radical 소거능을 나타내었으며, 50%의 radical 소거능을 나타내는 값인 IC50은 0.19 mg/mL로 나타났다(Table 8). Kim et al.(2014)이 보고한 노간주나무 에탄올 추출물의 ABTS+ radical 소거능은 0.5 mg/mL에서 79.3%의 활성을 보여 노간주나무 열매의 ABTS+ radical 소거능이 뛰어남을 확인하였다. 또한 Bae et al.(2013)이 보고한 메타세콰이어나무 열매의 경우, 0.125, 0.25 mg/ mL 농도에서 각각 71.42%, 88.49%의 DPPH radical 소거능을 보여 본 연구와 다소 차이를 보였다.
8. 환원력(Reducing power) 측정
활성산소종 및 유리기에 전자를 공여하는 능력인 환원력을 이용하여 ferric ferricyanide(Fe3+) 화합물에 전자를 공여하여 ferrous(Fe2+)로 전환하는 환원력을 흡광도 값으로 확인하였다(Oyaizu 1986). 본 연구에 사용된 노간주나무 열매의 환원력을 측정한 결과는 Table 9와 같다. 노간주나무 열매의 환원력을 측정한 결과, 0.125, 0.25, 0.5, 1.0 mg/mL 농도에서 각각 0.23, 0.36, 0.55, 0.82의 흡광도를 보여 농도 의존적으로 증가함을 확인하였다. 메타세콰이어 열매 추출물의 경우, 0.125, 0.25, 0.5, 1.0 mg/mL 농도에서 각각 0.29, 0.44, 0.74, 1.40의 흡광도를 본 연구와 유사함을 보였다(Bae et al. 2013). Ahn et al.(2011)은 측백나무 열매의 환원력을 0.01, 0.05, 0.1, 0.5% 농도에서 각각 0.14, 0.43, 0.76, 0.95의 환원력을 보여 본 연구와 다소 차이를 보였다.
9. 노간주나무 열매 에탄올 추출물이 유방암 세포주의 성장에 미치는 영향
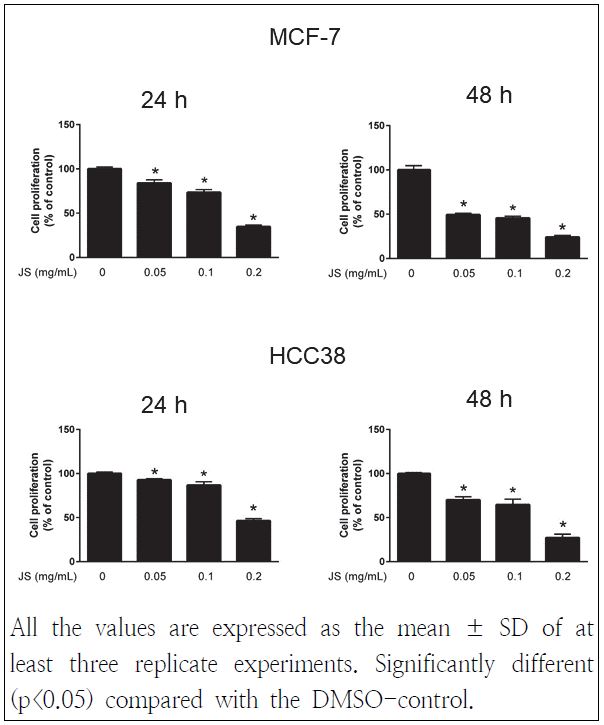
노간주나무 열매 에탄올 추출물이 인체 유방암세포주인 MCF-7과 HCC38 세포주의 성장에 미치는 영향을 조사하기 위하여 노간주나무 열매 에탄올 추출물을 0.05, 0.1, 0.2 mg/mL 농도별로 처리한 후, MTS assay를 통해 확인하였다. Fig. 1에서 나타난 것과 같이 MCF-7 세포주에 노간주나무 열매 에탄올 추출물을 24시간 처리하였을 때 0.05, 0.1, 0.2 mg/mL 농도에서 대조군과 비교해 각각 84.02%, 73.44%, 34.76%로 유의적인 세포 성장억제율을 보였고, 48시간 처리하였을 때 각각 49.48%, 45.63%, 24.01%의 세포 성장률을 보여 유의적인 세포 증식 억제 효과를 나타내었다. HCC38 세포주에 노간주나무 열매 에탄올 추출물을 24시간 처리하였을 때 0.05, 0.1, 0.2 mg/mL mg/mL 농도에서 대조군과 비교해 각각 92.85%, 86.75%, 46.45%로 유의적인 세포 성장억제율을 보였고, 48시간 처리하였을 때 각각 70.03%, 64.73%, 27.23%를 나타내었다. Oh et al.(2011)은 향나무의 활성성분 중 widdrol을 이용하여 인체 폐암 세포주인 A549에 처리한 결과, 세포 성장이 유의적으로 감소함을 확인하였다 본 실험의 결과는 노간주나무 열매 추출물을 이용하여 에스트로겐 수용체를 함유한 MCF-7 세포주와 에스트로겐 수용체를 함유하지 않은 HCC38 세포주 모두에서 성장억제 효과를 보였으며, MCF-7 세포주에 보다 좋은 효과를 나타내었음을 확인하였다.
IV. 요약 및 결론
본 연구는 노간주나무 열매 에탄올 추출물의 영양성분 분석, 항산화력 및 인체 유래 유방암세포주인 MCF-7와 HCC38를 사용하여 세포의 증식 억제 효과에 미치는 영향을 평가하였다. 노간주나무 열매의 일반성분을 분석한 결과 탄수화물 함량이 높게 나타났으며, 총 필수 아미노산 함량은 leucine, lysine, histidin 순으로 높게 검출되었다. 노간주나무 열매의 주된 유기산은 malic acid, citric acid, tartaric acid 순으로 높게 나타났다. 노간주나무 열매에서는 포화지방산 4종(stearic acid. capric acid, heptadecanoic acid, tricosanoic acid)과 단일불포화지방산 2종(cis-11-eicosenoic acid, palmitoleic acid)이 검출되었다. 무기질 함량은 Ca, K, Mg 순으로 높게 나타났다. 총 polyphenol 및 flavonoid 함량은 각각 84.22 mg TAE/g, 136.24 mg RE/g으로 나타났다. 노간주나무 열매의 50% DPPH 와 ABTS+ radical 소거능(IC50)값은 각각 0.52 mg/mL와 0.19 mg/mL 이었다. 유방암세포주에 노간주나무 열매를 0.05, 0.1, 0.2 mg/mL 농도별로 처리한 결과, HCC38 세포주에 비해 MCF-7 세포주에서 세포성장억제 효과가 큰 것으로 나타났다. 이러한 결과를 통하여 노간주나무 열매의 영양성분과 항산화능 및 암세포 성장 억제를 확인하였으며 향후 유용한 기능성식품 소재로서 활용 가능할 것으로 사료된다.
References
-
Adams RP(2000) Systematics of Juniperus section Juniperus based on leaf essential oils and random amplified polymorphic DNAs (RAPDs). Biochem Syst Ecol 28(6), 515-528.
[https://doi.org/10.1016/S0305-1978(99)00089-7]

-
Ahn HY, Heo SJ, Kang MJ, Lee JH, Cha JY, Cho YS(2011) Antioxidative activity and chemical characteristics of leaf and fruit extracts from Thuja orientalis. J Life Sci 21(5), 746-752.
[https://doi.org/10.5352/JLS.2011.21.5.746]

- AOAC(2005) Official methods of analysis. 18th ed. Association of official analytical chemists, Washington, DC, USA
-
Bae YI, Lee JW, Ha TJ, Hwang SH, Shin CS, Jeong CH, Kim IH, Shim KH(2013) Nutrients and antioxidative activities of metasequoia glyptostroboides. J Korean Soc Food Sci Nutr 42(3), 363-368.
[https://doi.org/10.3746/jkfn.2013.42.3.363]

-
Bolois MS(1958) Antioxidant determination by the use of a stable free radical. Nature 181, 1199-1200
[https://doi.org/10.1038/1811199a0]

- Chae SK, Kang GS, Ma SJ, Bang KW, Oh MW, Oh SH(2002) Standard food analysis. Paju: Jigu-Moonwha Sa, pp381-382
- Folin O, Denis W(1912) On phosphotungastic-phosphomolybdic compounds as color regents. J Biol Chem 12(2), 239-249
-
Halliwell B(1996) Commentary oxidative stress, nutrition and health. Experimental strategies for optimization of nutritional antioxidant intake in humans. Free Radic Res 25(1), 57-74.
[https://doi.org/10.3109/10715769609145656]

- Jo JO, Kim SM, Kim KS(1999) Analysis of asarone, coumarin and thujone in medicinal plants used in brewing a Korean traditional folk wine. J Korean Soc Agric Chem Biotechnol 42(3), 210-217
-
Jun H, Lee SY, Kim JH, An BJ, Lee JY(2013) Anti-wrinkling effects of Juniperus rigida Sied. Korean J Microbiol Biotechnol 41(4), 449–455.
[https://doi.org/10.4014/kjmb.1307.07004]

-
Kim HA, Lee JM(2018) Effect of antioxidant activities and apoptosis induction of Salvia plebeia R. Br. in human breast cancer MCF-7 cells. Korean J Community Living Sci 29(2), 197-205.
[https://doi.org/10.7856/kjcls.2018.29.2.197]

-
Kim JH, Lee SY, Park JM, Park JH, Kwon OJ, Lee JY(2014) Antioxidant activity and inhibition activity against α-amylase and α-glucosidase of Juniperus rigida Sieb extracts. Korean J Food Preserv 21(3), 396-403.
[https://doi.org/10.11002/kjfp.2014.21.3.396]

- Kim TW(1996) Woody plant of Korea. Seoul: Kyohak Publishing, p49
-
Koleva II, van Beek TA, Linssen JP, de Groot A, Evstatieva LN(2002) Screening of plant extracts for antioxidant activity: a comparative study on three testing methods. Phytochem Anal 13(1), 8-17.
[https://doi.org/10.1002/pca.611]

-
Lee HJ, Park EM, Lee JJ(2019a) Antioxidant activity and quality characteristics of cookies containing added red Chinese cabbage powder. Korean J Community Living Sci 30(2), 195-210.
[https://doi.org/10.7856/kjcls.2019.30.2.195]

-
Lee JJ, Hwang MS, Lee HJ(2019b) Antioxidant activities and quality characteristics of white dandelion (Taraxacum coreanum) cookies. Korean J Community Living Sci 30(3), 363-376.
[https://doi.org/10.7856/kjcls.2019.30.3.363]

-
Lee SY, Jun HJ, Lee IC, Lee JY(2013) Down-regulation of tyrosinase, MITF, TRP-1, and TRP-2 expressions by Juniperus rigida Sieb. in murine B16F10 melanoma. J Life Sci 23(12), 1445-1453.
[https://doi.org/10.5352/JLS.2013.23.12.1445]

-
Mashima T, Okigawa M, Kawano N(1970) On the bisflavones in the leaves of Juniperus rigida Sieb. et Zucc. Yakugaku Zasshi 90(4), 512-513
[https://doi.org/10.1248/yakushi1947.90.4_512]

- Oh YN, Hong YK, Yun HJ, Lee EW, Lee HT, Cho YH, Park C, Kwon HJ, Kim BW(2011) Widdrol induces apoptosis in human cervical carcinoma HeLa cells. Cancer Prev Res 16(3), 255-262
-
Oyaizu M(1986) Studies on products of browning reaction: antioxidative activity of products of browning reaction. Jpn J Nutr Diet 44(6), 307-315
[https://doi.org/10.5264/eiyogakuzashi.44.307]

-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C(1999) Antioxidant activity applying an improved ABTS radial cation decolorization assay. Free Radic Biol Med 26(9-10), 1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Shin W, Ha J(2003) Analyses of lipid and volatile components in Juniper seed (Juniperus rigida Sieb. et Zucc). J Korean Soc Food Sci Nutr 32(6), 795-800
[https://doi.org/10.3746/jkfn.2003.32.6.795]

-
Wong JY, Chye FY(2009) Antioxidant properties of selected tropical wild edible mushrooms. J Food Compos Anal 22(4), 269-277.
[https://doi.org/10.1016/j.jfca.2008.11.021]

-
Wungaarden DV(1967) Modified rapid preparation of fatty acid esters from lipids for gas chromatographic analysis. Anal Chem 39(7), 848-850.
[https://doi.org/10.1021/ac60251a031]