하고초 주정 추출물이 고지방식이 급여 마우스의 간 지질 대사에 미치는 영향
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The purpose of this study was to investigate the effects of a dietary intake of Prunella vulgaris var. lilacina Nakai ethanol extract (PVE) on lipid metabolism and fibrosis in the liver tissue of diet-induced obese mice. Prunella vulgaris var. lilacina Nakai (PV) is a perennial herbaceous plant belonging to the Labiatae (Lamiaceae) family and is a natural material that has been reported to have antioxidant and anti-cancer effects. C57BL/6J mice were divided into 3 groups and fed a normal diet, a high-fat diet (HFD), or a high fat + 1% PVE (w/w) diet for 12 weeks. In hematoxylin & eosin (H&E) stained liver tissues, the HFD group showed an increase in the number and size of lipid droplets, but these were rarely observed in the PVE fed mice. The hepatic lipotoxicity markers, plasma glutamic oxaloacetic transaminase (GOT), and glutamic pyruvic transaminase (GPT) levels were elevated owing to the high-fat diet intake but plasma GPT levels showed a significant decrease on supplementation with the PVE. Moreover, the PVE improved adiponectin dysregulation, and reduced blood glucose imbalance due to insulin resistance, thereby inhibiting fibrosis of the liver and adipose tissue. The PVE caused an excretion of lipids from the body as feces, thereby lowering the lipid content in the liver tissue and increasing the accumulation of hepatic proteins, thus contributing to improvement in liver health. Our findings highlight the potential of the dietary effects of the PVE in the prevention of hepatic lipotoxicity and fibrosis.
Keywords:
Prunella vulgaris var. lilacina Nakai ethanol extract, high-fat diet, obesity, lipid metabolism, hepatic steatosis, hepatic fibrosisⅠ. 서론
체내 장기 중에서 간은 영양소의 저장, 합성, 대사 및 분비에 중요한 역할을 하는 중심기관이다(Bechmann et al. 2012). 현대인의 간 질환은 서구화된 식문화로 인해 지방간(fatty liver), 간 섬유화(hepatic fibrosis), 간경변증(liver cirrhosis) 등의 형태로 발병 정도가 증가하는 추세이다(Park et al. 2006). 특히 비알코올성 지방간(non-alcoholic fatty liver disease, NAFLD)은 체내 지질 대사 장애로 인해 과다한 지질이 간 조직에 축적되어 발생하는 질병이다(Park & Park 2018). 한 연구에 따르면 한국인의 NAFLD의 유병률은 51.4%로 높은 비중을 나타내었다(Lee et al. 2007). NAFLD는 일반적으로 대사증후군의 합병증이며, 비만, 심혈관계질환 및 인슐린 감수성 손상 등이 동반될 위험이 크다. 또한 NAFLD는 간세포가 손상되는 비알코올성 지방간염(non-alcoholic steatohepatitis, NASH)으로 악화하는데, 이는 간경변증과 간암으로 발전되며 사망의 원인이 된다(Malhotra & Beaton 2015). 그러나 NAFLD와 NASH의 예방 및 치료를 위한 연구에도 불구하고 직접적인 치료제로 밝혀진 것은 미비한 실정이다(Ibrahim et al. 2013). 특히 부작용을 동반하는 합성 약물이 아닌 부작용이 적은 천연물 소재를 이용한 기능성식품 소재의 개발이 필요하다(Bray & Tartaglia 2000).
하고초(Prunella vulgaris var. lilacina Nakai)는 꿀풀과(Labiatae)에 속하는 다년생 초본식물인 꿀풀(labiate)의 지상부 전초를 말린 것이다. 하고초의 주성분으로는 Ursolic acid, Oleanolic acid, Rosmarinic acid 등이 있고(Yang et al. 2016), 특히 Ursolic acid와 Oleanolic acid는 하고초의 지표 성분이다(Kim et al. 2000). 하고초 추출 용매에 따른 항산화 및 항균 활성 연구에서 ‘메탄올>에탄올>물’ 순으로 항산화 및 항균 활성이 증가했으며(Seo et al. 2010), 하고초 추출물에 의한 항산화(Hwang et al. 2013), 항암(Hao et al. 2016; Li et al. 2016), 항 간섬유화(Hu et al. 2016) 등의 효능이 보고되어 있다. 주성분인 Ursolic acid도 항암 및 지방간·간섬유증 개선에 효능이 있는 것으로 보고되었다(Mancha-Ramirez & Slaga 2016; Kwon et al. 2018). 또한 꿀풀과 식물 중 하나인 자소엽은 rosmarinic acid를 주성분으로 하며, 대사증후군 및 비알코올성 지방간 개선에 대한 우수한 효능을 가진다고 보고되어 있다(Choi et al. 2020). 하고초에 의한 항산화 및 항암 관련 연구는 있지만, 하고초 추출물의 체내 지질 대사 및 간 기능 개선 관련 연구는 in vitro 실험에 그친 형태로 심도 있는 추가연구가 필요한 실정이다. 따라서 본 연구의 목적은 고지방식이로 유도된 비만 마우스를 이용해 하고초 주정 추출물의 간조직 내 지질 대사에 미치는 영향을 연구하고자 하였다.
Ⅱ. 연구방법
1. 실험재료
본 연구의 실험 재료는 Pureherb(Yeongcheon, Korea)로부터 국내산 하고초(전초) 건물을 구입하여 사용하였다. 하고초는 70% 에탄올을 사용하여 5시간 동안 초음파 추출하였으며, 추출물은 여과, 농축 후 동결건조하여 –70℃에 보관 후 동물실험에 사용하였다. 하고초의 추출 수율은 24.0%이었다.
2. 실험동물
실험동물은 4주령 C57BL/6J 웅성 마우스를 ㈜중앙실험동물(Seoul, Korea)에서 구입하여 사육실에서 1주일간 chow 식이를 제공하며 적응시켜 실험에 사용하였다. 난괴법(randomized block design)에 따라 3군으로 나누어 12주간 실험을 진행하였으며, 식이 조성 및 군은 Table 1과 같다. 동물 실험실 사육 조건은 항온 22~24℃, 항습 45~55℃, 12시간 간격의 light cycle을 유지하며, 각각의 cage 안에서 사육하였으며, 실험 식이와 식수는 자유롭게 섭취(ad libitum)하도록 하였다. 동물실험은 경북대학교 동물실험윤리위원회의 승인(KNU 2017-0109)을 받아 진행하였다.
3. 해부 및 시료 수집
총 12주 중, 4주마다 12시간 공복 후 마취 없이 꼬리 채혈을 통해 혈당을 측정하였다. 사육 종료 시점에 12시간 공복 시킨 마우스를 isoflurane(5 mg/kg body weight, Baxter, USA) 흡입을 통해 마취하여 개복한 후, 대동맥으로부터 전혈을 채취하여 3,000 rpm에서 15분간 원심분리해 혈장을 수집하였다. 장기와 지방 조직을 적출하여 0.9% 생리식염수에 세척 후 표면의 수분을 제거하고 무게를 측정한 후, 액체질소에 급냉 시켜 분석 전까지 –70℃에 보관하였다.
4. 식이 섭취량, 체중 증가량 및 식이 효율 측정
체중과 식이섭취량은 실험 기간 12주 동안 매주 1회씩 측정하였으며, 식이 효율(food efficiency ratio: FER)은 일일 체중 증가량을 일일 에너지 섭취량으로 나눈 값을 사용하였다.
5. 혈장 지질 농도 분석
혈장 중성지방, 총콜레스테롤, HDL-콜레스테롤 농도 및 glutamic oxaloacetic transaminase(GOT)와 glutamic pyruvic transaminase(GPT) 활성도는 아산제약(Asan Pharm Co., Seoul, Korea)의 효소 kit를 사용하여 측정하였다. 혈장 유리지방산 측정은 효소법을 이용한 발색법 원리를 이용한 유리지방산 측정용 시액(Non-esterified fatty acid, NEFA kit, Wako, Osaka, Japan)을 사용하여 측정하였다. 혈장 apolipoprotein A-1 (Apo A-1) 및 apolipoprotein B(Apo B) 농도는 Apo A-1 및 Apo B 측정용 kit(日東紡績株式會社, Tokyo, Japan)를 사용하여 측정하였다. 혈장 adipokine(leptin and resistin) 및 아디포넥틴의 함량 측정은 Multiplex detection kit(Bio-rad, Hercules, CA, USA) 및 Luminex 200 labmap system(Bio-rad) 및 Mouse adiponectin/Acrp30 (R&DsystemsTM a Bio-techne brand, Minnesota)를 사용하여 측정하였다.
6. 간 조직 및 지방조직의 형태학적 분석
조직의 형태학적 관찰을 위해 간 조직 및 지방 조직의 일부를 일정한 크기로 잘라 10 % formalin 용액(sigma-aldrich, St. Louis, Mo, USA)으로 고정한 후 알코올로 탈수하고 파라핀으로 포매하였다. 포매된 조직을 4 μm의 두께로 잘라 유리 슬라이드에 부착하여 hematoxylin&eosin(H&E) 및 Masson’s trichrome(MT)(sigma-aldrich, St. Louis, Mo, USA)으로 염색하였다. 모든 염색된 샘플은 광학현미경(Zeiss, Oberkochen, Germany)으로 200배율에서 관찰하였다.
7. 간 조직 지질 함량 측정
간 조직 지질은 Folch(1957)의 방법을 따라 추출하였다. 간 조직 0.1 g을 tissue lyzer를 이용해 분쇄한 후 2 mL phosphate buffer(pH 8.0) 용액으로 균질화시킨 후 chloroform:methanol(1:2) 용매로 추출하였다. 추출액을 37℃에서 질소가스로 휘발시켜 isopropanol(sigma-aldrich, St. Louis, Mo, USA)로 희석한 후, 정량을 위해 효소 시액에 유화제로 3 mM cholic acid(sodium salt)와 발색 시 일어나는 탁도(turbidity)를 제거하기 위하여 0.5% Triton X-100(sigma-aldrich, St. Louis, Mo, USA)을 혼합하여, 지질 성분을 추출한 후 혈장 중성지질, 콜레스테롤 및 유리지방산 정량법과 동일하게 정량하였다.
8. 분변 지질 함량 측정
희생 전 12주차의 분변을 72시간 동안 수집하여 건조 시킨 후, 분변의 유리지방산, 콜레스테롤 및 중성지질 함량 측정을 위해 Folch(1957)의 방법을 수정·보완하여 추출하였다. 건조된 분변을 막자사발을 이용해 곱게 갈아 0.5 g을 취한 후 5 ml chloroform:methanol(2:1) 용액을 첨가하여 4℃에서 24시간 동안 추출하였다. 추출액은 원심분리를 통해 상층액을 취한 후 50℃에서 질소가스로 건조 시킨 후 동일 추출 용매 1 mL에 다시 녹였다. 지질 함량 측정을 위해 각각 100 μL를 취하여 다시 질소가스로 건조 시킨 후 5 mL의 ethanol로 용해하여 실험에 사용하였다. 간 조직 지질 정량과 동일한 방법으로 정량하였다.
9. 통계처리
본 실험을 통해 얻어진 결과는 SPSS(Statistical Package for the Social Sciences ver 23.0, SPSS Institute Inc., Chicago, IL, USA)를 이용하여 통계 분석하였다. 모든 결과는 mean ± S.E.(standard error)로 나타내었으며, 실험군 간의 유의성을 검정하기 위하여 분산분석(ANOVA)을 한 후 P<0.05 수준에서 Duncan’s multiple range test에 의해 검정하였다.
Ⅲ. 결과 및 고찰
1. 체중, 식이 섭취량 및 식이효율
정상식이군, 고지방식이군, 고지방식이+하고초 주정 추출물 보충군으로 나누어 12주간 사육 후, 체중 변화, 식이섭취량 및 식이 효율을 관찰한 결과는 Table 2와 같다. 고지방식이를 급여한 HFD군과 PVE군의 최종 체중과 총 체중 증가량은 정상식이를 급여한 ND군에 비해 유의하게 증가하였으나, 고지방식이군과 하고초 주정 추출물 보충군 간의 유의적 차이는 없었다. 식이섭취량은 정상식이군에서 다른 실험군에 비해 유의적으로 높았고, 고지방식이군에서 가장 낮았다. 하고초 주정 추출물 보충군의 식이섭취량은 고지방식이군 보다 높은 경향을 보였지만, 통계적으로 유의미한 차이는 없었다. 식이 효율은 고지방식이군이 정상식이군에 비해 유의적으로 증가하였는데, 이는 고지방식이의 에너지 밀도가 높기 때문으로 사료된다. 한편 하고초 주정 추출물 보충군의 식이 효율은 고지방식이군에 비해 유의적으로 감소하였다. 본 결과에서 하고초 주정 추출물의 식이를 통한 보충은 마우스의 체중 감량에 유의적인 효과는 없었지만, 식이 효율이 감소하는 것으로 나타나 동일한 식이 섭취 시에는 체중이 감소할 것으로 판단된다.
2. 장기 중량 및 부고환 지방세포 크기
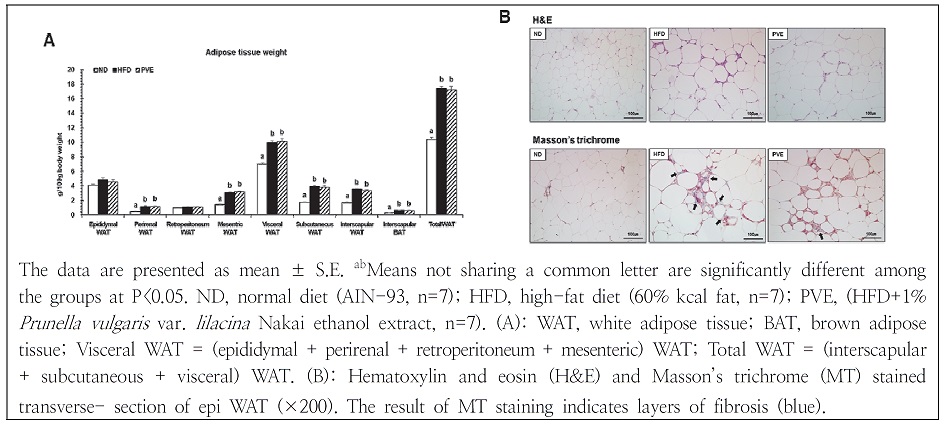
희생 시 적출 한 지방조직의 무게를 측정한 후 체중 100 g 당 조직 무게로 제시하였다(Fig. 1A). 신 주위 백색지방조직, 장간막 백색지방조직, 피하 백색지방조직, 견갑골 백색 및 갈색지방조직의 무게는 정상식이군에 비해 고지방식이군에서 유의적으로 증가하였다. 이는, 고지방식이로 인한 에너지 섭취 비율이 높았기 때문으로 판단되며, 이를 통해 고지방식이에 의한 비만 유도가 잘 이루어진 것을 입증하였다. 하고초 주정 추출물 보충에 의한 지방조직 중량 측정 결과, 고지방식이군과 비교하였을 때 유의적인 차이를 나타나지 않았다.
Effects of PVE intake for 12 weeks on adipose tissue weight, adipocyte size of epididymal WAT in C57BL/6J mice fed a high-fat diet
부고환 백색지방조직의 형태학적 분석 결과는 Fig. 1B에 나타내었다. H&E로 염색한 결과, 고지방식이군의 지방세포 크기가 정상식이군보다 비대해졌으며 하고초 주정 추출물 보충으로 인해 지방세포의 크기가 감소한 것을 관찰하였다. 조직의 MT 염색법은 세포, 섬유질, 세포 외 기질과 체액으로 구성되는 결합조직이 파란색으로 염색되어 표시되며, 이는 섬유화의 지표로 사용된다(Cheung et al. 2010). 하고초 주정 추출물의 보충으로 부고환 지방 조직의 섬유화에 미치는 영향을 알아보기 위해 실시한 MT 염색에서 고지방식이 장기 섭취로 인해 HFD군의 부고환 백색지방조직 섬유화가 상당히 진행되었으나, 하고초 주정 추출물 보충으로 인해 섬유화가 감소한 것을 확인하였다. Park et al.(2005)의 연구에 의하면 항비만 효능을 입증할 수 있는 효과적인 방법은 지방세포 크기를 측정하는 것이라 밝혔다. 따라서 하고초 주정 추출물 보충은 고지방식이 유도 비만에 의한 지방세포 비대 및 섬유화 억제 효과가 있을 것으로 사료된다.
3. 혈장 생화학적 검사
하고초 주정 추출물 보충에 의한 혈장 유리지방산, 중성지질, 콜레스테롤 및 아포지단백질 검사 결과는 Table 3과 같다. 혈장 중성지방의 경우 모든 군 간의 유의미한 차이는 없었다. 고지방식이군의 혈장 총콜레스테롤 수치와 HDL-콜레스테롤, nonHDL-콜레스테롤 농도는 정상식이를 섭취한 군보다 증가하였고, 하고초 주정 추출물 보충군의 경우 고지방식이군과 통계적 유의미한 차이는 나타나지 않았다. 혈장 아포지단백 A-1(Apo A-1)의 경우에 정상식이군과 고지방식이군의 유의미한 차이가 없었으나, 하고초 주정 추출물 보충군에서 유의적으로 높게 나타났다. Apo A-1은 혈장에서 HDL-콜레스테롤의 주요 단백질 성분이며, 혈장 Apo A-1의 농도가 낮은 경우 심혈관 질환의 존재 여부 및 중증도에 관한 예측 인자로 사용된다(Ettinger et al. 1992).

Effects of PVE intake for 12 weeks on plasma lipid and adipokine levels in C57BL/6J mice fed a high-fat diet
지방세포에서 분비되는 아디포카인(adipokines) 및 전 염증성 사이토카인(cytokines)은 산화적스트레스를 유발하고 지질 과산화를 일으키며 간세포 손상, 염증 및 섬유증을 촉진한다(Day & James 1998). 특히 resistin과 아디포넥틴은 지방세포 특이적 아디포카인으로, 혈장 resistin 농도는 비만일 때 증가하고 인슐린 저항성과 높은 상관관계를 나타내며, AMPK의 활성을 증가시켜 간에서의 포도당 생합성을 감소시킨다. 아디포넥틴은 마른 사람보다 비만 및 인슐린 저항성이 있는 사람의 혈장에서 낮은 수치를 나타낸다(Jung & Choi 2014). 본 연구에서 하고초 주정 추출물의 보충으로 인한 혈장 leptin과 resistin 수준은 고지방식이군에 비해 유의적인 차이가 없었지만, 고지방식이 섭취에 의해 감소된 혈장 아디포넥틴의 농도를 유의적으로 증가시켰다. 인슐린 저항성의 지표로 사용되는 leptin:adiponectin ratio (L:A ratio)는 고지방식이군에서 현저하게 증가하였지만, 하고초 주정 추출물 보충으로 인한 유의적인 차이는 없었다. 본 실험 결과를 통해 하고초 주정 추출물은 고지방식이 유도 비만에 의한 혈중 아디포카인 불균형 개선에 일부 관여하는 것으로 사료된다.
4. 간 조직 중량, 혈장 GOT, GPT 및 조직학적 관찰
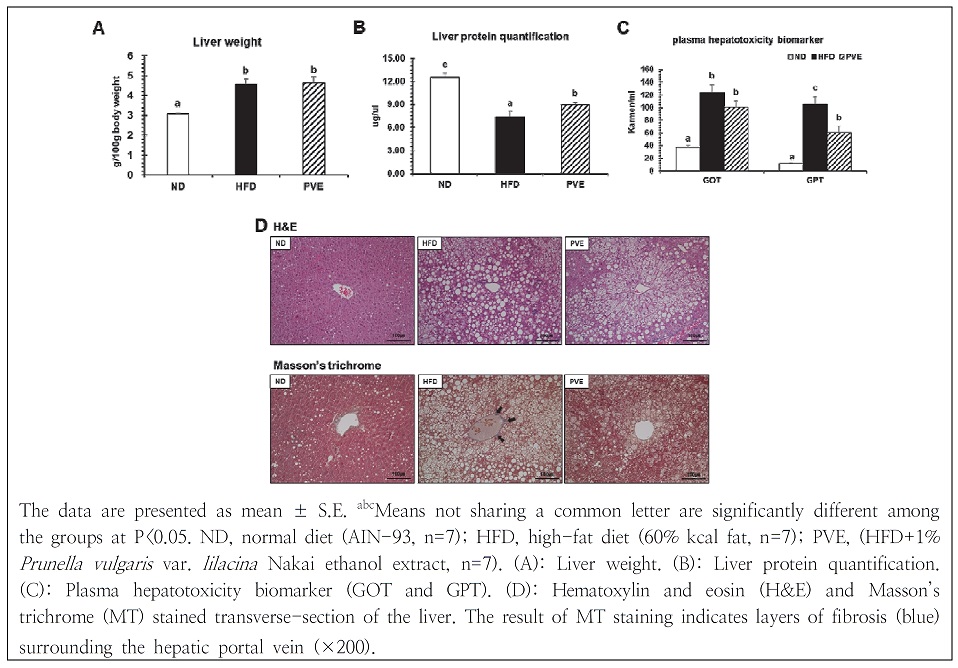
12주간 고지방식이로 비만을 유도한 마우스의 간 조직 중량 변화는 Fig. 2A와 같다. 고지방식이 섭취로 인해 정상식이군보다 간 조직 중량이 유의적으로 증가하였으나, 하고초 주정 추출물 보충군의 간 조직 중량은 고지방식이 섭취군에 비해 감소하지 않았다. 간 조직 내 단백질 량을 측정한 결과, 정상식이군의 간 조직 내 단백질 함량이 가장 많은 것으로 나타났으며, 하고초 주정 추출물 보충군의 단백질 함량이 고지방식이군 보다 유의적으로 높은 것을 관찰하였다(Fig. 2B).
Effects of PVE intake for 12 weeks on liver weight and protein quantification, plasma levels of glutamic oxaloacetic transaminase (GOT) and glutamic pyruvic transaminase (GPT), and morphology in C57BL/6J mice fed a high-fat diet
간 독성 지표인 GOT와 GPT는 간세포에 존재하는 효소로서, 고지방식, 고혈당, 간염 등의 독성으로 인한 간세포의 파괴로 인해 혈장에서 증가하는 것으로 알려져 있다(Reitman & Frankel 1957). 마우스의 간 기능 이상 여부를 확인하기 위하여 측정한 혈장 GOT 및 GPT 농도 측정 결과, GOT 농도는 고지방식이군에서 정상식이군보다 유의적으로 증가하였다. 고지방식이 섭취로 인해 증가한 혈장 GPT 농도는 하고초 주정 추출물 보충으로 인해 현저하게 감소하였다(Fig. 2C). 간 조직의 손상 및 섬유화 정도를 확인하기 위하여 H&E 및 MT 염색을 진행하였다(Fig. 2D). H&E 염색 결과 지방구를 제외한 조직은 붉은색으로, 핵은 보라색으로 염색되었다. 정상식이군은 간문맥을 중심으로 지방구 없이 정상적인 간 조직 형태를 보였으며, 고지방식이군은 간문맥을 중심으로 크고 작은 다실의 지방구가 축적되어 있음을 관찰하였다. 이와 같은 지방구의 축적은 하고초 주정 추출물의 보충으로 현저히 감소하였다. 간 조직의 MT 염색 결과, 고지방식이군의 간문맥의 주변부에 파란색으로 결합조직이 염색된 것을 확인할 수 있었다. 정상식이군과 하고초 주정 추출물 보충군의 간 조직에서는 섬유화된 결합조직이 발견되지 않았다. 따라서 하고초 주정 추출물은 간 조직 중량의 감소에는 효과가 없으나 간 내 지질의 축적을 증가시키는 것이 아닌, 간 내 단백질을 증가시켜 건강한 간 대사에 관여하는 것으로 사료된다.
5. 간 조직 및 분변 지질 함량
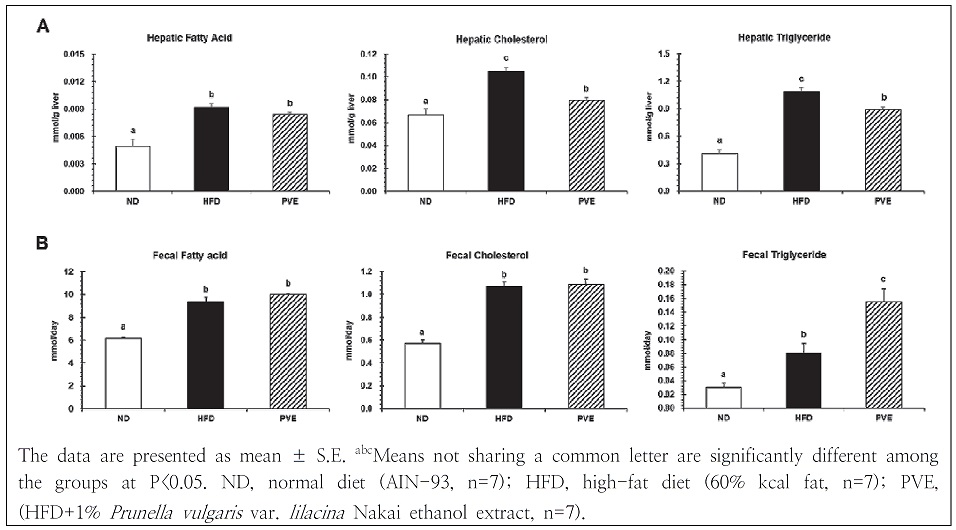
간은 콜레스테롤의 생합성이 일어나는 주된 장기조직으로, 정상적인 대사가 이루어지지 않으면 간에 축적되어 지방간을 일으키는 원인이 된다. 특히 고지방 또는 고콜레스테롤의 섭취는 간 조직의 지질 대사를 무너뜨려 간 조직 내 지질의 침착을 일으켜 간 조직이 비대해지고 간 조직 내 지질 함량을 증가시킨다(Kim et al. 2008). 본 실험에서 간 조직 지질 함량을 측정한 결과는 Fig. 3A와 같다. 간 조직 내 유리지방산, 콜레스테롤 및 중성지방 수준은 고지방식이에 의해 정상식이 섭취군 보다 유의적으로 증가하였고, 하고초 주정 추출물 보충으로 인하여 콜레스테롤 및 중성지방의 수준이 유의적으로 감소하였다. Choi et al.(2020)은 고지방식이와 꿀풀과 식물인 자소엽 주정 추출물을 함께 급여한 마우스의 간 조직 내 지질 함량이 감소하고, 간 조직 지질 합성 관련 유전자의 발현 수준을 감소시켰다고 보고하였다. 이러한 연구 결과와 마찬가지로 꿀풀과 식물인 하고초 주정 추출물의 보충은 간 조직 중 콜레스테롤 및 중성지방의 축적을 효과적으로 감소시킴으로써 지질개선 및 섬유화 억제에 효과가 있는 것으로 사료된다.
Effects of PVE intake for 12 weeks on hepatic and fecal lipid profiles in C57BL/6J mice fed a high-fat diet.
하고초 주정 추출물의 섭취가 분변으로의 지질 배설능에 미치는 영향을 알아보기 위해 분변의 유리지방산, 콜레스테롤 및 중성지방 함량을 측정한 결과는 Fig. 3B와 같다. 분변 중 유리지방산, 콜레스테롤 및 중성지방 배설량은 정상식이군에 비해 고지방식이군에서 유의적으로 높았으며, 분변 중성지방 수준은 고지방식이군에 비해 하고초 주정 추출물 보충군에서 유의적으로 증가하였다. 따라서 본 실험에서 하고초 주정 추출물이 분변으로의 중성지질 배설 증가를 통해 간 조직 내에 지질 함량을 감소시키는 것으로 사료된다.
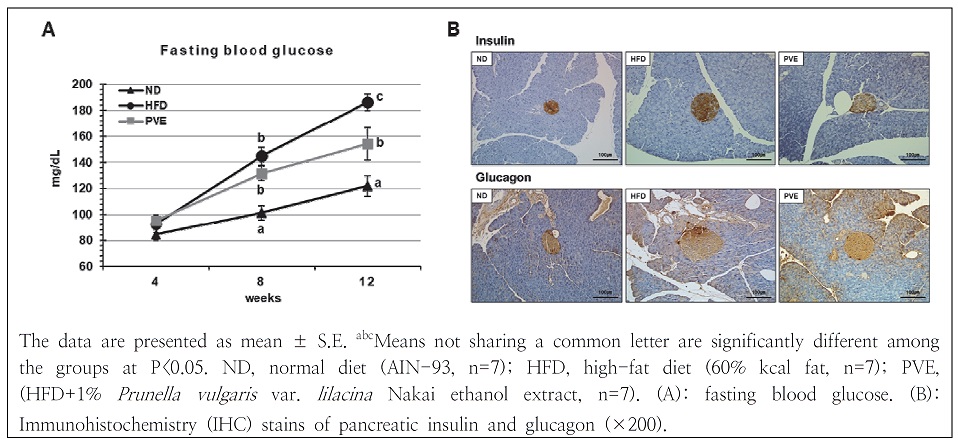
6. 공복 혈당
4주 간격으로 공복 혈당을 측정한 결과를 Fig. 4A와 같다. 정상식이군의 혈당은 정상 범위 내에서 일정 수준으로 유지되는 반면, 고지방식이 섭취로 인한 혈당 상승이 관찰되었다. 고지방식이군의 혈당은 8주차부터 정상식이군에 비해 유의적으로 증가하였고, 12주차에는 하고초 주정 추출물 보충으로 인한 혈당 감소가 관찰되었다. 췌장 조직에서 인슐린과 글루카곤의 발현 정도를 면역 조직 화학적 염색을 통하여 관찰하였다(Fig. 4B). 고지방식이로 인한 췌장섬(pancreatic islet)의 비대는 하고초 주정 추출물 보충으로 인해 감소하였다. 이러한 결과는 하고초 주정 추출물이 혈당 개선에 효과가 있고, 비만에 의해 발병하는 합병증인 제2형 당뇨병의 개선에도 도움이 될 것으로 사료된다.
Ⅳ. 요약 및 결론
현대인의 간 질환은 증가하는 추세이며, 특히 한국인 성인의 50% 이상은 비알코올성 지방간(NAFLD) 발병 위험에 노출되어 있다. 본 연구진은 마우스 동물모델에 고지방식이로 인한 비만 및 지방간을 유도하면서 하고초 주정 추출물을 보충하여 비만 및 지방간 개선 효능을 분석하였다. 고지방식이로 비만을 유도하였을 때, 하고초 주정 추출물 보충에 의한 체중 감소는 나타나지 않았으나 하고초 주정추출물에 의해 식이효율이 감소한 것으로 나타나, 이를 통해 동일한 에너지 급여 시 하고초 주정추출물 보충은 체중감소에 기여할 것으로 판단된다. 또한, 비만 환자에서 감소하는 혈중 아디포넥틴의 수준이 하고초 주정 추출물 보충군에서 증가하였으며, 공복혈당 수준도 유의적으로 감소하였다. 고지방식이 섭취로 증가한 간 조직 중량은 하고초 주정 추출물 보충군에서 유의적인 변화는 없었으나 간 조질 내 지질 함량 감소와 단백질 함량 증가가 관찰되어 하고초 주정 추출물은 지방간 개선에 일부 기여하는 것으로 사료되며, 특히 간 독성 평가 지표인 혈장 GPT 수준도 하고초 주정 추출물 보충군에서 유의적으로 감소하는 것으로 나타났다. 한편 분변 내의 중성지방 배설량은 하고초 주정 추출물의 섭취로 인해 고지방식이군보다 유의적으로 증가하였다. 따라서 하고초 주정 추출물은 체내 지질의 분변으로의 배출을 통해 간 조직 내 지질 축적을 억제하고 단백질의 축적을 증가시켜 지방간을 개선하고 혈당 조절에 도움을 주는 것으로 관찰되어 향후 비만 및 지방간 개선용 기능성 소재로서의 활용이 기대된다.
Acknowledgments
These authors contributed equally to this work.
This study was supported by research fund from Chosun University, 2020.
이 논문은 2020년도 조선대학교 학술연구비의 지원을 받아 연구되었으며 이에 감사드립니다.
References
-
Bechmann LP, Hannivoort RA, Gerken G, Hotamisligil GS, Trauner M, Canbay A(2012) The interaction of hepatic lipid and glucose metabolism in liver diseases. J Hepatology 56(4), 952-964
[https://doi.org/10.1016/j.jhep.2011.08.025]

-
Bray GA, Tartaglia LA(2000) Medicinal strategies in the treatment of obesity. Nature 404(6778), 672-677
[https://doi.org/10.1038/35007544]

-
Cheung JS, Fan SJ, Gao DS, Chow AM, Man K, Wu E X.(2010) Diffusion tensor imaging of liver fibrosis in an experimental model. J Magnetic Resonance Imaging 32(5), 1141-1148
[https://doi.org/10.1002/jmri.22367]

-
Choi JY, Kim JW, Kwon EY(2020) Effects of the Perilla frutescens Britton var. acuta Kudo Ethanol Extract (PFE) on the Improvement of Metabolic Syndrome and Non-Alcoholic Fatty Liver Disease Induced by High-Fat Diet. J Korean Soc Food Sci Nutr 49, 1045-1053
[https://doi.org/10.3746/jkfn.2020.49.10.1045]

-
Day CP, James OF(1998) Steatohepatitis: A tale of two “hits”?. Gastroenterology 114(4), 842-845
[https://doi.org/10.1016/S0016-5085(98)70599-2]

-
Ettinger WH, Miller LA, Smith TK, Parks JS(1992) Effect of interleukin-1 alpha on lipoprotein lipids in cynomolgus monkeys: comparison to tumor necrosis factor. Biochim. Biophys. Acta 1128(2-3), 186-192
[https://doi.org/10.1016/0005-2760(92)90306-G]

-
Folch J, Lees M, Stanley GS(1957) A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem 226(1), 497-509
[https://doi.org/10.1016/S0021-9258(18)64849-5]

-
Hao J, Ding XL, Yang X, Wu XZ(2020) Prunella vulgaris polysaccharide inhibits growth and migration of breast carcinoma-associated fibroblasts by suppressing expression of basic fibroblast growth factor. Chin J Integr Med 26(4), 270-276
[https://doi.org/10.1007/s11655-016-2587-x]

-
Hu YX, Yu CH, Wu F, Yu WY, Zhong YS, Ying HZ, Yu B(2016) Antihepatofibrotic effects of aqueous extract of prunella vulgaris on carbon tetrachloride-induced hepatic fibrosis in rats. Planta medica 82(01/02), 97-105
[https://doi.org/10.1055/s-0035-1558112]

-
Hwang YJ, Lee EJ, Kim HR, Hwang KA(2013) In vitro antioxidant and anticancer effects of solvent fractions from Prunella vulgaris var. lilacina. BMC Complement Altern Med 13(1), 310
[https://doi.org/10.1186/1472-6882-13-310]

-
Ibrahim MA, Kelleni M, Geddawy A(2013) Nonalcoholic fatty liver disease: current and potential therapies. Life sciences 92(2), 114-118
[https://doi.org/10.1016/j.lfs.2012.11.004]

-
Jung UJ, Choi MS(2014) Obesity and its metabolic complications: the role of adipokines and the relationship between obesity, inflammation, insulin resistance, dyslipidemia and nonalcoholic fatty liver disease. Int J Molecular Sci 15(4), 6184-6223
[https://doi.org/10.3390/ijms15046184]

- Kim HJ, Ji YJ, Lee SG, Choi JH, Lee EJ, Jeong HJ, Lee SP, Lee, IS(2008) Effects of defatted soybean grits on lipid metabolism in rats fed with high-fat diet. Korean J Food Sci Technol 40(5), 580-585
- Kim JS, Lee KS, Jang SY, Won DH, Kang SS(2000) Quantitative determination of ursolic acid from Prunellae herba. Korean J Pharmacognosy 31(4), 416-420
-
Kwon EY, Shin SK, Choi MS(2018) Ursolic acid attenuates hepatic steatosis, fibrosis, and insulin resistance by modulating the circadian rhythm pathway in diet-induced obese mice. Nutrients 10(11), 1719
[https://doi.org/10.3390/nu10111719]

-
Lee JY, Kim KM, Lee SG, Yu E, Lim YS, Lee HC, Suh DJ(2007) Prevalence and risk factors of non-alcoholic fatty liver disease in potential living liver donors in Korea: a review of 589 consecutive liver biopsies in a single center. J Hepatol 47(2), 239-244
[https://doi.org/10.1016/j.jhep.2007.02.007]

-
Li C, Huang Q, Xiao J, Fu X, You L, Liu RH(2016) Preparation of Prunella vulgaris polysaccharide-zinc complex and its antiproliferative activity in HepG2 cells. Int J Biol Macromol 91, 671-679
[https://doi.org/10.1016/j.ijbiomac.2016.06.012]

-
Malhotra N, Beaton MD(2015) Management of non-alcoholic fatty liver disease in 2015. World J Hepatology 7(30), 2962
[https://doi.org/10.4254/wjh.v7.i30.2962]

-
Mancha-Ramirez AM, Slaga TJ(2016) Ursolic acid and chronic disease: an overview of UA’s effects on prevention and treatment of obesity and cancer. Anti-inflammatory Nutraceuticals and Chronic Diseases. 75-96
[https://doi.org/10.1007/978-3-319-41334-1_4]

-
Park JW, Park JY(2018) Histologic Risk Factor for Mortality and Development of Severe Liver Disease in Biopsy-proven Non-alcoholic Fatty Liver Disease. Korean J Gastroenterology 71(1), 58-60
[https://doi.org/10.4166/kjg.2018.71.1.58]

-
Park SH, Jeon WK, Kim SH, Kim HJ, Park DI, Cho YK, Sung IK, Sohn CI, Keum DK, Kim BI(2006) Prevalence and risk factors of non-alcoholic fatty liver disease among Korean adults. J Gastroenterology Hepatol 21(1), 138-143
[https://doi.org/10.1111/j.1440-1746.2005.04086.x]

-
Park SH, Ko SK, Chung SH(2005) Euonymus alatus prevents the hyperglycemia and hyperlipidemia induced by high-fat diet in ICR mice. J Ethnopharmacol 102(3), 326-335
[https://doi.org/10.1016/j.jep.2005.06.041]

-
Reitman S, Frankel S(1957) A colorimetric method for the determination of serum glutamic oxalacetic and glutamic pyruvic transaminases. Am J Clin Pathology 28(1), 56-63
[https://doi.org/10.1093/ajcp/28.1.56]

-
Seo JK, Kang MJ, Shin JH, Lee SJ, Jeong HG, Sung NJ, Chung YC(2010) Antibacterial and antioxidant activities of solvent extracts from different parts of Hagocho (Prunella vulgaris). J Korean Soc Food Sci Nutr 39(10), 1425-1432
[https://doi.org/10.3746/jkfn.2010.39.10.1425]

-
Seon GU, Hwang IW, Chung SK(2016) Physicochemical composition of head-type kimchi cabbage leaves. J Korean Soc Food Sci Nutr 45(6), 923-928.
[https://doi.org/10.3746/jkfn.2016.45.6.923]

-
Shin GH, Lee YJ, Kim JH, Kim YH, Kim DB, Lee JS, Lim JH, Lee OH(2014) Antioxidant activities of commonly used Brassica spp. sprout vegetables in Korea. Korea J Food Preserv 21(4), 587-592.
[https://doi.org/10.11002/kjfp.2014.21.4.587]

-
Simic MG(1988) Mechanisms of inhibition of free radical processes in mutagenesis and carcinogenesis. Mutat Res 202(2), 386-399.
[https://doi.org/10.1016/0027-5107(88)90199-6]

-
Wungaarden DV(1967) Modified rapid preparation of fatty acid esters from lipids for gas chromatographic analysis. Anal Chem 39(7), 848-849.
[https://doi.org/10.1021/ac60251a031]

-
Wursch P(1979) Influence of tannin-rich Carob pod fiber on the cholesterol metabolism in the rat. J Nutr 109, 685
[https://doi.org/10.1093/jn/109.4.685]

- Yang J, Hu YJ, Yu BY, Qi J(2016) Integrating qualitative and quantitative characterization of Prunellae Spica by HPLC-QTOF/MS and HPLC-ELSD. Chin J Nat Med 14(5), 391-400