Hispidulin이 유방암 및 유방암 줄기세포에 미치는 영향 연구


This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Although hispidulin (4’, 5, 7-trihydroxy-6-methoxyflavone), a natural flavonoid, is reported to exert anti-tumor activities in various cancers, the molecular mechanism related to breast cancer stem cells (CSCs) remains to be elucidated. CSCs are found in several human cancers, including breast cancer, and possess self-renewal properties that aid cancer recurrence and impart resistance to chemotherapy. The present study investigates whether hispidulin can modulate breast cancer stem cell-like properties. Exposure to hispidulin markedly decreased the size and number of cell spheres in human breast cancer cells (MCF-7 and HCC38). Hispidulin-treated HCC38 cells also showed reduced markers of CSCs, including aldehyde dehydrogenase 1 (ALDH1) activity. Moreover, treatment with hispidulin also downregulated the protein expressions of CSCs markers Nestin and Sox-2. We further observed that breast cancer cell apoptosis was induced subsequent to hispidulin exposure. In conclusion, we believe that hispidulin is a potential natural compound that targets breast cancer cells and breast CSCs.
Keywords:
hispidulin, breast cancer stem cells, self-renewalⅠ. 서론
줄기 세포(stem cell)는 자체 재생 능력과 더 전문화된 성숙한 세포 유형으로 분화할 수 있는 가능성을 가지고 있다(Bonnet & Dick 1997). 암 줄기세포(cancer stem cells, CSCs)는 종양 내 1-2% 정도의 소수 집단으로 줄기세포와 암세포 모두의 특성을 가지고 있다(Bonnet & Dick 1997). 암 줄기세포는 다른 종양 세포 및 정상 줄기세포와 달리 특정 표면 및 세포 내 바이오마커 표현형으로 구별할 수 있으며, 인간 유방 종양의 암 줄기세포 분화 마커로는 CD44, CD24, 알데하이드 탈수소효소 1(ALDH1) 등이 있다(Al-Hajj et al. 2003; Ginestier et al. 2007). 유방암 줄기세포는 유방암의 침습 및 전이에 중요한 역할을 하며, 이들을 둘러싼 미세 환경은 성장 신호 및 증식에 중요한 요소이다(Plaks et al. 2015).
유방암은 전 세계 여성들에게 가장 널리 발생하고 있는 암 유형으로, 유전자 발현 양상에 따라 크게 Luminal A (estrogen receptor (ER)+/progesterone receptor (PR)+/human epidermal growth factor receptor 2 (HER2/neu) (HER2-); Luminal B (ER+/PR+/HER2-/+); HER2-overexpression (ER-/PR-/HER2+), triple negative breast cancers/TNBCs (ER-/PR-/HER2-)로 구성된다(Ferlay et al. 2021). 이중 삼중음성유방암(TNBC)은 전체 유방암의 약 15~20%를 차지하며 다른 유형에 비해 암의 전이 위험이 높은 것으로 알려져 있다(Lehmann et al. 2011). 암 줄기세포는 삼중음성유방암의 종양 형성에 중요한 역할을 한다고 제안 되었으며 유방 조직의 정상 줄기세포에서 유래한다. 연구에 따르면 CD44+/CD24- 및 ALDH1+ 등의 유방암 줄기세포 바이오마커는 삼중음성유방암에서 주로 발현되며 삼중음성유방암의 화학 내성 및 종양 전이에 기여한다고 알려져 있다(Creighton et al. 2010). 따라서 유방암 줄기세포의 생성 억제 또는 제거는 삼중음성유방암을 포함한 유방암의 치료를 위해 새롭고 표적화된 치료 전략이 될 가능성이 높다고 할 수 있다.
Hispidulin은 플라보노이드의 일종으로 항염증, 항진균, 항경련제, 종양 활성 억제 등의 광범위한 생물학적 특징을 가지고 있다(Chao et al. 2015). Hispidulin은 위와 장에서 빠르게 흡수되며 경구 투여 후 생체이용률은 4.02%로 알려져있다(Cong et al. 2016). 특히 hispidulin의 항암 활성에 대한 연구로는 종양의 성장 및 신생혈관 생성 억제, 세포 사멸 유도 등이며 유방암을 포함한 다양한 암 유형에서 효과를 보이는 것으로 나타났다(Han et al. 2018). 암 줄기세포는 종양의 진행, 전이 및 약물 내성의 주요 원인으로 알려져 있기에 이들의 억제는 향후 암의 증식 억제를 위한 접근법 중 하나로 여겨지고 있다. 따라서 본 연구는 인체유방암세포주인 MCF-7과 HCC38를 이용하여 hispidulin의 처리에 의해 유방암 및 유방암 줄기세포에 미치는 영향에 대해 검토하였다.
Ⅱ. 연구방법
1. 실험재료
실험에 사용한 hispidulin은 Sigma-Aldrich(St. Louis, MO, USA)에서 구입하였으며 분석 시까지 -20℃에서 보관하여 사용하였다.
2. 세포배양 조건
인체유방암세포주인 MCF-7과 HCC38은 한국세포주은행(Seoul, Korea)에서 분양받아 사용하였다. 1% penicillin/streptomycin과 10% fetal bovine serum(FBS; Gibco-BRL, Grand Island, NY, USA)가 포함된 RPMI 1640 배지(WelGENE Inc., Seoul, Korea)를 사용하여 37℃, 5% CO2 조건에서 배양하였다.
3. Cell viability assay
세포 생존률을 측정하기 위해 MCF-7과 HCC38 세포주를 각각 24 well plate에 well당1×104의 세포를 분주하였다. 그 후 Hispidulin을 농도별로 48시간 처리한 후 2,000 rpm에서 5분 동안 원심분리기를 이용하여 수확하고 trypan blue dye(Sigma Aldrich, St. Louis, MO, USA)를 이용하여 염색하였으며 hemocytometer로 살아있는 세포의 수를 세어 계산하였다.
4. Mammosphere formation assay
Hispidulin 처리가 유방암 줄기세포 증식에 미치는 영향을 관찰하기 위해 mammosphere formation assay를 수행하였다. Mammosphere 배양을 위해 MEBM 배지(Lonza Group Ltd, Basel, Switzerland)에 antibiotic solution(1%), B27(1:50), insulin(5 μg/mL), hydrocortisone(1 μg/mL), epidermal growth factor(20 ng/mL), basic fibroblast growth factor(20 ng/mL), 2-mercaptoethanol, methylcellulose를 첨가하여 사용하였다. MCF-7과 HCC38 세포주를 ultra-low attachment 6-well plate(Corning, NY, USA)에 5 × 103 cells/well의 농도로 seeding 한 후 7일 동안 mammosphere 형성을 유도하였다. 이후 광학현미경(CKX41, OLIMPUS Co., Tokyo, Japan)을 이용하여 200 배율로 관찰하였다.
5. Flow cytometric analysis of aldehyde dehydrogenase 1(ALDH1) activity
각각의 유방암세포주에서 hispidulin 처리가 ALDH1 activity에 미치는 영향을 관찰하기 위해 ALDEFLUOR assay kit(Stemcell Technologies; Cambridge, MA)를 이용하여 관찰하였다. MCF-7과 HCC38 세포주를 각각 6 well plate에 1 × 105 cells/well의 농도로 배양한 후 hispidulin을 농도별로 처리하였다. 24시간 후에 trypsin-EDTA(WelGENE Inc., Seoul, Korea)를 처리로 세포를 분리한 후 ALDEFLUOR assay buffer와 혼합하였다. 그 후 activated ALDEFLUOR reagent와 diethylaminobenzaldehyde(DEAB) 용액을 혼합하고 37℃에서 45분간 배양하였다. ALDH1 분석은 BD FACSCalibur flow cytometer(BD, Franklin Lakes, NJ, USA)를 이용하여 확인하였다.
6. Western blot assay
각각의 유방암 세포주를 phosphate-buffered saline(PBS)로 세척하고 lysis buffer(150 mM NaCl, 0.1% sodium dodecyl sulfate(SDS), 1% Triton X-100, 50 mM Tris-HCl, pH 8.0)와 protease inhibitor, phosphatase inhibitor(Sigma Aldrich, St. Louis, MO, USA)를 첨가하여 세포를 용해시켰다. 원심분리기를 이용하여 상등액을 취한 후 Bradford reagent(Bio-Rad, Hercules, USA)를 이용하여 단백질을 정량하였다. 동량의 단백질을 8-10% SDS-polyacrylamide gel electrophoresis를 시행하였으며 polyvinylidene fluoride membrane(Immobilon; EMD Millipore, Burlington, MA, USA)으로 옮긴 후, blocking buffer(1×Tris-buffered saline, 0.1% Tween-20, 5% skim milk)에 넣고 상온에서 1시간 반응시킨 후 Nestin, Sox-2, cleaved PARP, Bcl-2, cleaved caspase 9, p53, β-actin(Cell signaling, Danvers, MA, USA)과 2차 항체인 anti-mouse IgG-HRP 및 anti-rabbit IgG-HRP(Santa Cruz Biotechnology, Dallas, Texas, USA)를 반응시켰다. 이후 chemiluminescence reagent(Amersham Biosciences, Buckinghamshire, UK)를 이용하여 현상하였으며 ImageJ 1.41 software(National Institutes of Health, Bethesda, MD, USA)를 이용하여 분석하였다.
7. 통계처리
모든 실험에 있어서 3회씩 독립적 반복을 통해 결과를 얻었으며, GraphPad Prism 6 program(GraphPad Software, Inc., La Jolla, CA, USA)을 이용하여 각 실험군 간의 유의성 검증을 실시하였고 평균(mean)과 표준편차(SD)로 나타내었다. p<0.05 수준에서one-way ANOVA를 실시하여 통계적 유의성을 검증하였다.
Ⅲ. 결과 및 고찰
1. Hispidulin이 유방암세포주의 세포증식에 미치는 영향
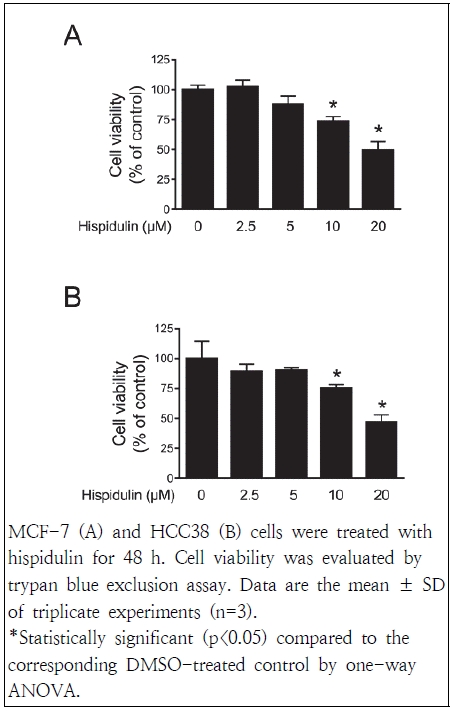
Hispidulin 처리가 유방암세포의 증식에 미치는 영향을 측정하기 위해 trypan blue exclusion assay를 시행하였다. MCF-7과 HCC38 세포주에 hispidulin을 각각 2.5, 5, 10, 20 μM 농도로 48 시간 처리한 결과, 두 세포주 모두에서 대조군과 비교하여 10 μM 농도부터 유의적인 감소를 나타내었다(Fig. 1). Hispidulin 처리에 의해 세포 증식을 억제하는 효과는 피부악성 흑생종, 전립선암, 간암 등의 세포주에서도 확인되었다(Han et al. 2018; Chang et al. 2021; Wang et al. 2021). Kim & Lee(2021)의 연구에서는 MCF-7과 HCC38 세포주를 이용하여 hispidulin의 생존능력을 3-(4,5-Dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium(MTS) assay룰 통하여 확인하였으며 이는 본 실험의 결과 유사함을 확인할 수 있었다. 이상의 결과로부터 hispidulin이 에스트로겐 수용체 양성인 MCF-7과 에스트로겐 수용체 음성인 HCC38 세포주 모두에서 유방암세포의 증식을 억제하는 효과를 보인다는 것을 확인하였다.
2. Hispidulin이 mammosphere formation에 미치는 영향
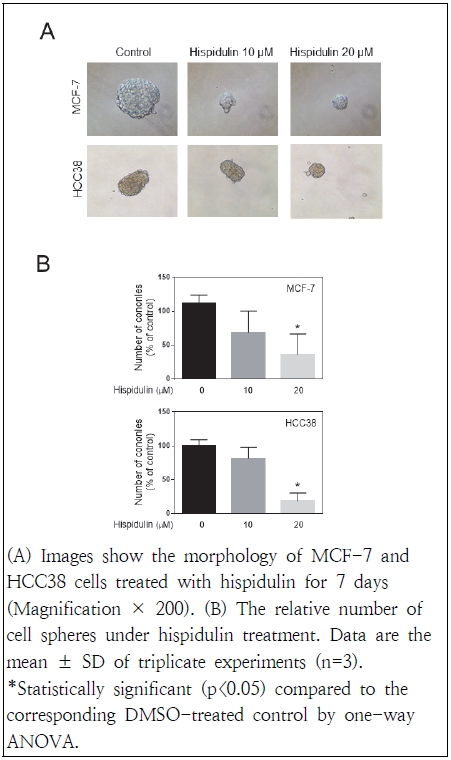
Mammosphere formation 분석은 self-renewal activity를 기반으로 줄기세포를 식별하는 데 널리 사용되는 방법이다(Wang et al. 2014). 이는 배양을 통한 정상 유방줄기세포를 동정하는 방법으로 세포를 배양 시 바닥에 붙지 않고 구 형태로 떠서 자라는 세포들이 있으며, 이들 구형성 세포들만이 암을 개시하고, 암 줄기세포 표지인자를 발현하며, 항암제에 대한 내성을 갖고 있는 세포로서 제시되고 있다(Cao et al. 2018). 본 연구에서는 mammosphere formation을 생성하기 위해 MEBM 배지를 이용하여 초저부착 plate에서 유방암 세포를 배양하였으며 hispidulin 처리가 이들의 형성에 미치는 영향을 관찰하였다. MCF-7 및 HCC38 세포주에 7일 동안 hispidulin(10 및 20 μM)을 처리한 결과, 두 세포주 모두에서 mammosphere의 수와 크기를 유의하게 감소됨을 확인하였다(Fig. 2). 이러한 결과는 hispidulin이 유방암 줄기세포의 유지 및 자가 재생 능력을 억제할 수 있음을 알 수 있었다.
3. Hispidulin이 ALDH1에 미치는 영향
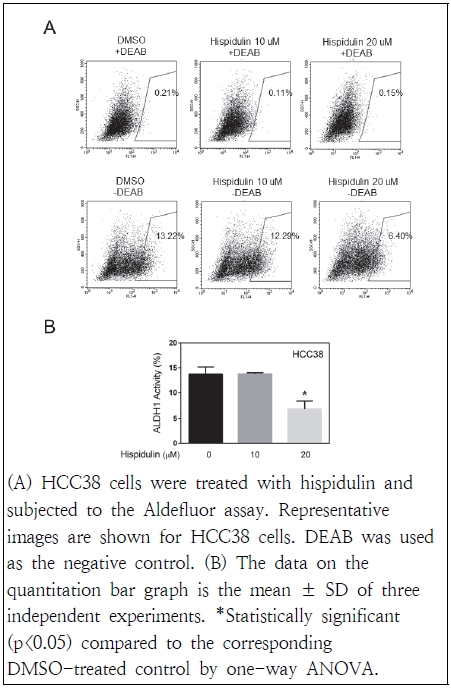
유방암 환자의 암줄기세포는 ALDH isoform의 발현을 기반으로 식별할 수 있으며 이 중 ALDH1은 유방암을 포함한 여러 암 유형의 암줄기세포에서 발현되는 것으로 보고되어 잠재적인 암줄기세포 표지자로 널리 사용된다(Ma & Allan 2011). ALDH1의 활성은 폐, 식도, 위, 난소, 유방암 및 직장암 환자에서 예후가 좋지 않은 임상 결과와 관련이 있다고 알려져 있다(Ginestier et al. 2007). 본 연구는 HCC38 세포주에 hispidulin을 처리한 결과, DEAB가 첨가된 음성 대조군에서는 ALDH1 활성이 없으나, DEAB 무처리한 군에서의 ALDH1 활성은 20 μM 농도의 hispidulin 처리로 인해 대조군보다 유의적으로 억제되었다(Fig. 3). 따라서 향후 ALDH1이 hispidulin 처리에 의한 유방암 치료 및 예방을 위한 치료 표적이 될 수 있을 것으로 사료된다.
4. Hispidulin이 암줄기세포 인자에 미치는 영향
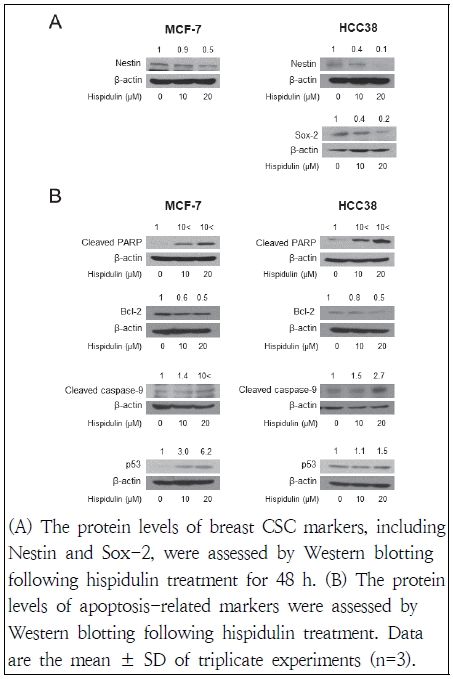
Oct4, Sox-2, Nestin, CD44 등은 암줄기세포의 특성 유지에 중요한 인자로 알려져 있다(Kim & Lee 2021). 따라서 유방암세포주에서 이들의 발현이 hispidulin 처리에 의해 얼마나 변화되었는지 알아보고자 하였다. MCF-7 및 HCC38 세포주에 48시간 동안 hispidulin 처리하였을 경우, Nestin 및 Sox-2의 단백질 발현이 대조군에 비해 감소함을 확인하였다. Nestin의 발현이 높은 경우는 그렇지 않은 경우와 비교하였을 때 종양형성에 깊은 연관성이 있으며(Liu et al. 2012) 유방암 줄기세포에서 Nestin을 knock down 시킨 경우는 cell cycle arrest, apoptosis 유도, 세포 이동 및 epithelail mesenchimal transition(EMT) 억제로 이어진다(Zhao et al. 2014). 또한 유방암 줄기세포에서 중요한 신호전달 경로인 Wnt/β-catenin 활성화를 방해하는 것으로 관찰되었다(Zhao et al. 2014). Sox-2가 과발현되는 경우는 mammosphere formation을 가속화하여 유방암 줄기세포의 자가 재생 및 화학치료의 저항에 영향을 미친다(Mukherjee et al. 2017). 본 연구 결과, hispidulin 처리에 의해 이들 단백질 발현이 감소됨을 확인하였으며 이는 암줄기세포 형성을 억제할 수 있는 것으로 여겨진다.
4. Hispidulin이 apoptosis에 미치는 영향
암줄기세포는 세포 내 생존을 위해 세포 사멸을 억제하는 메커니즘에 의존하며, 이러한 방식은 화학 및 방사선 요법 등을 통해서도 암줄기세포가 생존할 수 있게 한다(Fulda et al. 2010). 대부분의 세포사멸 신호전달 경로는 최종적으로 caspase의 활성화를 초래하며(Boatright & Slvesen 2003), 대표적인 두 가지 신호전달 경로인 외인성과 내인성 경로의 세포 사멸신호전달 체계를 암줄기세포가 우회하거나 회피하는 경로를 선택하는 것으로 알려졌다(Fulda et al. 2010). 본 연구는 유방암세포주에서 hispidulin이 apoptosis에 미치는 영향을 알아보기 위해 western blot을 통한 관련 단백질 발현 양상을 확인하였다. 실험 결과, 두 세포주 모두에서 hispidulin 처리에 의해 Bcl-2의 단백질 발현은 대조군에 비해 감소하였으며 cleaved PARP, cleaved caspase-9의 단백질 발현은 증가함을 관찰하였다. p53의 경우는 HCC38 세포주에 비해 MCF-7 세포주의 단백질 발현의 증가가 뚜렷함을 나타내었다(Fig. 4). 이러한 결과로 hispidulin이 유방암세포주에 apoptosis를 유도함을 확인하였다.
Ⅳ. 요약 및 결론
최근 천연물을 이용한 수많은 연구를 통해 이들의 잠재적인 항암 활성 능력이 검증되고 있다. Hispidulin은 항염증, 항진균, 항경련, 항골다공증 및 항암 활성 등에 효과적인 플라보노이드로 폭넓게 연구되었으나 유방암 줄기세포에 미치는 연구는 아직 미비한 상황이다. 유방암은 현재까지 전 세계 여성들에게 높은 발병률 및 사망률을 보이고 있으며 이를 치료하기 위한 항암요법은 삼중음성유방암의 경우 치료 방법이 제한적이고 기대 효과도 낮은 것으로 알려져 있다. 유방암 줄기세포는 삼중음성유방암의 생성과 깊은 연관이 있어 이를 위한 연구가 더욱 필요한 실정이다. 본 연구롤 통해 유방암세포주인 MCF-7과 HCC38 세포주를 이용하여 hispidulin을 처리 시 유의적으로 암의 증식이 억제되었으며 mammosphere formation 및 유방암 줄기세포 표지자로 알려진 ALDH1의 활성도 억제됨을 관찰하였다, 또한 hispidulin 처리 후 암줄기세포 인자인 Nestin과 Sox-2의 단백질 발현 감소와 함께 apoptosis가 유도됨을 확인하였다. 이러한 결과로 hispidulin이 향후 유방암의 예방 및 치료에 근거한 유용한 물질로 사용될 가능성이 있을 것으로 사료된다.
References
-
Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF(2003) Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci USA 100(7), 3983–3988.
[https://doi.org/10.1073/pnas.0530291100]

-
Boatright KM, Salvesen GS(2003) Mechanisms of caspase activation. Curr Opin Cell Biol 15(6), 725-731.
[https://doi.org/10.1016/j.ceb.2003.10.009]

-
Bonnet D, Dick JE(1997) Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med 3(7), 730-737.
[https://doi.org/10.1038/nm0797-730]

-
Cao L, Yang Y, Ye Z, Lin B, Zeng J, Li C, Liang T, Zhou K, Li J(2018) Quercetin-3-methyl ether suppresses human breast cancer stem cell formation by inhibiting the Notch1 and PI3K/Akt signaling pathways. Int J Mol Med 42(3), 1625-1636.
[https://doi.org/10.3892/ijmm.2018.3741]

-
Chang CJ, Hung YL, Chen TC, Li HJ, Lo YH, Wu NL, Chang DC, Hung CF(2021) Anti-proliferative and anti-migratory activities of hispidulin on human melanoma a2058 cells. Biomolecul 11(7), 1039.
[https://doi.org/10.3390/biom11071039]

-
Chao SW, Su MY, Chiou LC, Chen LC, Chang CI, Huang WJ(2015) Total synthesis of hispidulin and the structural basis for its inhibition of proto-oncogene kinase pim-1. J Nat Prod 78(8), 1969-1976.
[https://doi.org/10.1021/acs.jnatprod.5b00324]

-
Cong Y, Wu S, Han J, Chen J, Liu H, Sun Q, Wu Y, Fang Y(2016) Pharmacokinetics of homoplantaginin in rats following intravenous, peritoneal injection and oral administration. J Pharm Biomed Anal 129, 405-409.
[https://doi.org/10.1016/j.jpba.2016.07.034]

-
Creighton CJ, Chang JC, Rosen JM(2010) Epithelial-mesenchymal transition(EMT) in tumor-initiating cells and its clinical implications in breast cancer. J Mammary Gland Biol Neoplasia 15(2), 253-260.
[https://doi.org/10.1007/s10911-010-9173-1]

-
Ferlay J, Colombet M, Soerjomataram I, Parkin DM, Piñeros M, Znaor A, Bray F(2021) Cancer statistics for the year 2020: an overview. Int J Cancer Apr 5.
[https://doi.org/10.1002/ijc.33588]

-
Fulda S, Pervaiz S(2010) Apoptosis signaling in cancer stem cells. Int J Biochem Cell Biol 42(1), 31-38.
[https://doi.org/10.1016/j.biocel.2009.06.010]

-
Ginestier C, Hur MH, Charafe-Jauffret E, Monville F, Dutcher J, Brown M, Jacquemier J, Viens P, Kleer CG, Liu S, Schott A, Hayes D, Birnbaum D, Wicha MS, Dontu G(2007) ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome. Cell Stem Cell 1(5), 555-567.
[https://doi.org/10.1016/j.stem.2007.08.014]

-
Han M, Gao H, Ju P, Gao MQ, Yuan YP, Chen XH, Liu KL, Han YT, Han ZW(2018) Hispidulin inhibits hepatocellular carcinoma growth and metastasis through AMPK and ERK signaling mediated activation of PPARγ. Biomed Pharmacother 103, 272-283.
[https://doi.org/10.1016/j.biopha.2018.04.014]

-
Kim HA, Lee J(2021) Hispidulin modulates epithelial-mesenchymal transition in breast cancer cells. Oncol Lett 21(2), 155.
[https://doi.org/10.3892/ol.2020.12416]

-
Lehmann BD, Bauer JA, Chen X, Sanders ME, Chakravarthy AB, Shyr Y, Pietenpol JA(2011) Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies. J Clin Invest 121(7), 2750-2767.
[https://doi.org/10.1172/JCI45014]

-
Liu C, Cao X, Zhang Y, Xu H, Zhang R, Wu Y, Lu P, Jin F(2012) Co-expression of Oct-4 and Nestin in human breast cancers. Mol Biol Rep 39(5), 5875-5881.
[https://doi.org/10.1007/s11033-011-1398-6]

-
Ma I, Allan AL(2011) The role of human aldehyde dehydrogenase in normal and cancer stem cells. Stem Cell Rev Re 7(2), 292-306.
[https://doi.org/10.1007/s12015-010-9208-4]

-
Mukherjee P, Gupta A, Chattopadhyay D, Chatterji U(2017) Modulation of SOX2 expression delineates an end-point for paclitaxel-effectiveness in breast cancer stem cells. Sci Rep 23, 7(1), 9170.
[https://doi.org/10.1038/s41598-017-08971-2]

-
Plaks V, Kong N, Werb Z(2015) The cancer stem cell niche: how essential is the niche in regulating stemness of tumor cells? Cell Stem Cell 16(3), 225-238.
[https://doi.org/10.1016/j.stem.2015.02.015]

- Richard LV(2011) Developmental stability of temperament characteristics: a review. Student Psychol J 1, 1-9
-
Rothbart MK(1981) Measurement of temperament in infancy. Child Dev 52, 569-578.
[https://doi.org/10.2307/1129176]

- Rothbart MK, Derryberry D(1981) Development of individual differences in temperament. Advances Develop Psychol 1, 33-86
-
Sanson A, Hemphill SA, Smart D(2004) Connections between temperament and social development: a review. Soc Dev 13, 142-170.
[https://doi.org/10.1046/j.1467-9507.2004.00261.x]

-
Seo MJ, Kong YK(2020) Differences in behavior problems and peer play by profiles of temperament using latent Profile Analysis. Korean Soc Community Living Sci 31(3), 427-442.
[https://doi.org/10.7856/kjcls.2020.31.3.427]

- Thomas A, Chess S(1977) Temperament and development. New York: Brunner/Mazel
-
Wang R, Lv Q, Meng W, Tan Q, Zhang S, Mo X, Yang X(2014) Comparison of mammosphere formation from breast cancer cell lines and primary breast tumors. J Thorac Dis 6(6), 829-837.
[https://doi.org/ 10.3978/j.issn.2072-1439.2014.03.38]

-
Wang Y, Guo S, Jia Y, Yu X, Mou R, Li X(2021) Hispidulin inhibits proliferation, migration, and invasion by promoting autophagy via regulation of PPARγ activation in prostate cancer cells and xenograft models. Biosci Biotechnol Biochem. 85(4), 786-797.
[https://doi.org/10.1093/bbb/zbaa108]

-
Zhao Z, Lu P, Zhang H, Xu H, Gao N, Li M, Liu C(2014) Nestin positively regulates the Wnt/β-catenin pathway and the proliferation, survival and invasiveness of breast cancer stem cells. Breast Cancer Res 16(4), 408.
[https://doi.org/10.1186/s13058-014-0408-8]