
노지 및 인공광 식물공장에서 생산된 삼채 잎의 항산화 및 항염 효과 비교
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study was conducted to evaluate and compare the antioxidant and anti-inflammatory effects of Allium hookeri grown in an outfield and those grown in a plant factory using different lights (FL, fluorescent light; LED-R, red light-emitting diode (LED); LED-B, blue LED; LED-R+B, red+blue LED). The antioxidant effects were determined by measuring the total phenolic content (TPC), DPPH and ABTS radical scavenging activities, and superoxide dismutase (SOD) and catalase (CAT) activities. The anti-inflammatory effects were determined by measuring the inhibition of nitric oxide (NO) production. The results showed that extracts of the leaves of A. hookeri grown in the outfield had the highest TPC value. The A. hookeri leaves grown in the plant factory showed higher antioxidant effects compared to those grown in the outfield as evaluated by the DPPH and ABTS radical scavenging activities and SOD activity. The highest CAT activity was found in the extract of leaves exposed to LED-R+B lights. The viability of RAW264.7 cells cultured with all the extracts of A. hookeri leaves was over 100% compared to that of the media control, and there was no cytotoxicity observed in any of the extracts. The NO production was significantly reduced in all the groups and the inhibitory effects of the A. hookeri leaves were dose-dependent. These results showed that the antioxidant and anti-inflammatory effects of A. hookeri grown in the plant factory using artificial lights are as good as those of the same plants grown in the outfield. Thus, artificial lights may be used to improve the functional characteristics of A. hookeri.
Keywords:
Allium hookeri, artificial light, antioxidant, anti-inflammationⅠ. 서론
삼채(Allium hookeri)는 Alliaceae과에 속하는 다년생 식물로 뿌리 부추로도 불린다. 삼채는 인도, 부탄, 중국 남서부, 미얀마 등 해발 1,400~4,200 m 이상의 초원지대에서 자생하며 현지에서 식용 및 약용으로 뿌리와 잎 모두 사용되고 있는 유용한 채소이다(Kim et al. 2012; Lee et al. 2014; Jung & Ko 2016). 단맛, 쓴맛, 매운맛이 난다고 하여 삼채(三菜)라고 부르기도 하며, 인삼 맛이 난다고 하여 삼채(蔘菜)라고 부르기도 한다(Lee et al. 2014). 삼채는 2010년 국내에 도입되었으며 현재 재배지역이 전국적으로 확대되고 있다(National Institute of Agricultural Sciences 2018). 삼채는 밝은 색의 수염뿌리와 초록색의 굵고 직선형의 잎으로 구분된다(Deka et al. 2022). 삼채는 유황화합물과 단백질, 당, 섬유소, ascorbic acid, phytosterol, total phenol 등이 풍부하며, 항산화, 항염, 항비만, 뼈 형성 등 다양한 생리활성을 지니고 있다(Kim et al. 2012; Kim 2017; Deka et al. 2022).
최근 세계적으로 이상 기후가 잦아지고 있는 상황에서 기후와 상관없이 안정적인 재배가 가능한 식물공장이 떠오르고 있다(Sul et al. 2022). 빛이 부족한 계절에 광합성과 식물성장 저하 등 시설재배의 문제들을 보완하기 위해 인공광원을 사용하여 작물 생산량과 품질을 개선하려는 연구가 활발히 진행되고 있다(Kim et al. 2019). 인공광 식물공장은 외부조건을 차단하고 내부 온도, 광원, 이산화탄소 농도, 배양액 등 작물 재배 환경조건을 최적의 상태로 제어하여 작물을 재배한다(Rural Development Administration 2018). 고압나트륨등(HPS lamp, High-pressure sodium lamp)과 삼파장등(3-Wave lamp), 형광등(fluorescent light), 백열등(incandescent lamp), 메탈할라이드등(metal halide), LED(Light-Emitting Diode) 등이 인공광원으로 이용되고 있다(Kim et al. 2019). 특히, LED는 다른 광원들에 비해 광에 의한 온도증가가 적고, 수명이 길며, 광합성에 유용한 특정 파장대의 빛을 공급할 수 있는 장점이 있다(Kim etl al. 2019). 적색광과 청색광은 광합성에 필요한 PAR(photosynthetically active radiation)의 파장대(400~700 nm)에서 작물의 생육에 가장 큰 영향을 주는 큰 파장이다(Sul et al. 2022). 형광등과 LED 조명을 장착한 식물공장에서 재배한 쌈 배추와 당귀, 방풍나물, 들깨 등 작물의 생육 특성과 기능성분, 기능성에 대한 연구가 보고되었다(Chung et al. 2014; Lee et al. 2016; Kim et al. 2021; Sul et al. 2022). 노지에서 재배된 삼채의 다양한 기능성 평가와 인공광을 이용하여 재배한 다양한 작물의 특성에 대해서 활발히 연구가 진행되고 있으나, 식물공장 시스템에서 재배한 삼채에 대한 기능성 연구는 미흡한 상황이다. 따라서 본 연구에서는 형광등과 LED를 이용하여 재배한 삼채 잎 추출물의 항산화 및 항염 효과를 분석하고 비교하였다.
Ⅱ. 연구방법
1. 시료의 재배 조건 및 생산지
본 연구에서는 국립농업과학원 식물공장에서 수경재배한 삼채 잎을 사용하여 생리활성을 평가하였다. 인공광원으로 형광등(24W, Philips, Hamburg, Germany)과 LED(SungJae Co., Ltd., Sungnam, Korea)를 주광원으로 하였고, 형광등(FL), 적색(LED-R)ㆍ청색(LED-B)ㆍ적색+청색 혼합(혼합비율 1:1, LED-R+B)으로 구성된 4개의 광조사구를 설정하였다. 적색 및 청색 LED 최대 파장은 660 nm, 470 nm이며, 모든 광조사구에서 광강도는 재배 개시 2주부터 150 μmol/m2/s로 조절하였다. 식물공장내 실내 온도와 습도는 22 ± 1℃ 및 50 ± 5%로 제어하였고, 수경 배양액은 엽채류 전용 Yamazaki 배양액을 이용하여 담액식 수경재배하였다. 또한, 대조구로는 전라북도 순창 소재 농장에서 노지 재배한 삼채 잎을 사용하였다.
2. 시료 준비 및 추출물 제조
시료는 60℃ 이하에서 열풍 건조한 후 분쇄하여 50% 주정으로 2회 추출, 감압농축(N-1000, EYELA, Tokyo, Japan) 및 동결건조하여 사용하였다. 시료의 증거 표본은 국립농업과학원 농식품자원부에 보관하였다.
3. 총 페놀 함량 분석
삼채 잎의 추출물 20 μL를 96 well plate에 넣고 증류수 80 μL를 가한 후, 40 μL의 Folin-Ciocalteu’s phenol reagent(Sigma-Aldrich Co., St. Louis, MO, USA)를 첨가하여 3분간 실온에서 반응시켰다. 10% Na2CO3 용액을 60 μL 넣고 실온에서 2시간 반응시킨 후 725 nm에서 흡광도를 측정하였다. 표준물질로는 gallic acid(Sigma-Aldrich Co.)를 사용하여 표준 곡선을 구해 정량하였다(Jung et al. 2022).
4. DPPH 라디칼 소거능 평가
삼채 잎의 추출물 50 μL에 0.2 mM 2,2-diphenyl-1-picryl-hydrazyl(DPPH, Sigma-Aldrich Co.) 용액 200 μL를 넣고 혼합한 뒤 상온에서 30분간 반응시킨 후, 517 nm에서 흡광도를 측정하였다(Jung et al. 2022).
5. ABTS 라디칼 소거능 평가
7.4 mM 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS, Sigma-Aldrich Co.)와 2.6 mM potassium persulfate를 1:1로 혼합하고 24시간 실온 보관하여 라디칼을 형성시킨 다음에, 실험 직전 용액을 760 nm에서 흡광도가 0.70~0.75가 되도록 증류수로 희석한 후 용액을 사용하였다. 희석된 용액 200 μL에 삼채 잎의 추출물 50 μL를 96 well plate에 넣고 암소에서 10분간 반응시켰고, 760 nm에서 흡광도를 측정하였다(Jung et al. 2022).
6. 세포 배양
본 연구에 사용된 RAW264.7 세포는 한국세포주은행(Korean Cell Line Bank, Seoul, Korea)에서 구입하여 사용하였다. RAW264.7 세포는 10% heat inactivated fetal bovine serum(FBS, Gibco, ThermoFisher Scientific, Waltham, MA, USA)과 1% penicillin-streptomycin solution(GenDEPOT, Katy, TX, USA)이 포함된 Dulbecco’s Modified Eagle Medium (DMEM, Gibco) 배지를 사용하여 37℃, 5% CO2 incubator에서 배양하였다. 배양용 플라스크에서 RAW264.7 세포를 배양하고 약 80% 이상 밀집하면 부착된 세포를 떼어낸 후 실험에 사용하였다.
7. Superoxide dismutase 활성도 측정
Superoxide dismutase(SOD) 활성은 SOD colorimetric activity kit(Invitrogen Co., Carlsbad, CA, USA)를 이용하여 측정하였다. 2×105 cells/mL 농도의 RAW264.7 세포를 6 well plate에 분주하고 4시간 배양한 후, 삼채 잎 추출물을 농도별(62.5, 125, 250, 500, 1,000 μg/mL)로 처리하였다. 24시간 배양한 후 상층액을 회수하여 원심분리(3,000 rpm, 20 min, 4℃)하고 SOD 활성 측정에 사용하였다. 추출물 10 μL와 substrate 50 μL, xanthine oxidase 25 μL를 96 well plate에 분주하고 20분간 반응시킨 후, microplate reader(molecular devices, San Jose, CA, USA)를 이용하여 450 nm에서 흡광도를 측정하였다. Superoxide dismutase standard를 사용하여 표준 곡선을 구해 정량하였다.
8. Catalse 활성도 측정
Catalse(CAT) 활성은 CAT colorimetric activity kit(Invitrogen Co.)를 이용하여 측정하였다. 2×105 cells/mL 농도의 RAW264.7 세포를 6 well plate에 분주하고 4시간 배양한 후, 삼채 잎의 추출물을 농도별(62.5, 125, 250, 500, 1,000 μg/mL)로 처리하였다. 24시간 배양한 후 상층액을 회수하여 원심분리(3,000 rpm, 20 min, 4℃)하고 CAT 활성 측정에 사용하였다. 시료 25 μL와 hydrogen peroxide reagent 25 μL를 96 well plate에 넣고 30분 동안 실온에서 반응시켰다. Substrate 25 μL와 HRP solution 25 μL를 분주한 후 15분간 실온에서 반응시키고, 560 nm에서 흡광도를 측정하였으며, catalase standard를 이용하여 표준 곡선을 구해서 정량하였다.
9. 세포에 대한 독성 및 안전성 평가
RAW264.7 세포를 2×105 cells/mL 농도로 96 well plate에 100 μL씩 넣고 37℃, 5% CO2 incubator에서 4시간 배양하였으며, LPS(최종 500 ng/mL)를 50 μL씩 넣고 같은 조건의 incubator에서 2시간 배양하였다. Phosphate buffered saline(PBS)를 이용하여 10 mg/mL 농도로 제조한 시료를 0.2 μm 필터(Syringe filter, PVDF filter media, Whatman, Cytiva, Utah, USA)로 여과시켰다. 추출물의 세포에 대한 독성 및 안전성 평가를 위해 배지를 이용하여 농도별(최종 15.6, 31.3, 62.5, 125, 250, 500 μg/mL)로 희석한 추출물을 세포에 넣고 24시간 동안 배양하였다. RAW264.7 세포 생존율은 Quanti-MaxTM WST-8 cell viability assay kit(BIOMAX, Seoul, Korea)를 이용하여 측정하였는데, Quanti-MaxTM 10 μL를 각 well에 분주하고 1시간 동안 37℃, 5% CO2 incubator에서 배양하였다. Microplate reader(molecular devices)를 이용하여 450 nm에서 흡광도를 측정하고 배지를 처리한 세포군(대조군)과 삼채 잎 추출물 처리군의 비율을 계산하여 시료의 안전성을 평가하였다.
10. Nitric oxide(NO) 생성 평가
RAW264.7 세포에서 생성되는 NO의 함량은 Griess Reagent System(Promega Co., Madison, WI, USA) 방법으로 측정하였다. RAW264.7 세포를 2×105 cells/mL 농도로 96 well plate에 100 μL씩 분주하여 37℃, 5% CO2 incubator에서 4시간 배양하고, LPS(최종 500 ng/mL)를 50 μL씩 분주하여 같은 조건의 incubator에서 2시간 배양하였다. 준비된 plate의 세포에 추출물을 농도별(최종 15.6, 31.3, 62.5, 125, 250, 500 μg/mL)로 50 μL씩 분주하고 37℃, 5% CO2 incubator에서 24시간 배양하였다. 세포배양 상등액 100 μL와 sulfanilamide solution 100 μL를 상온에서 10분간 반응시킨 후, N-1-napthylethylendiamine dihydrochloride(NED) solution 100 μL를 가하고 상온에서 10분 동안 반응시켰다. Microplate reader(molecular devices)를 이용하여 540 nm에서 흡광도를 측정하였고, ntrite standard(Promega Co.)로 표준 곡선을 작성하여 NO 함량을 산출하였다.
11. 통계 분석
모든 데이터는 SPSS 프로그램(Statistical Analysis Program ver. 24, IBM Corp. Armonk, NY, USA)를 사용하여 분산분석(ANOVA)을 실시하였다. 유의적인 차이가 있는 항목에 대하여는 Duncan’s multiple range test로 p<0.05 수준에서 시료 사이의 차이를 표시하였다.
Ⅲ. 결과 및 고찰
1. 총 페놀 함량
본 연구에서 분석한 삼채 잎 추출물의 총 페놀 함량은 Fig. 1과 같다. 노지에서 재배한 삼채 잎은 21.30 μg GAE/g이었고, 인공광 재배 삼채 잎은 FL 17.53 μg GAE/g, LED-R 19.20 μg GAE/g, LED-B 19.65 μg GAE/g, LED-R+B 20.01 μg GAE/g으로 나타났다. 페놀성 화합물은 식물계에 널리 분포되어 있으며, 항산화능, 항암 같은 다양한 생리활성이 우수한 것으로 보고되었다(Hwang et al. 2015). 이전 연구에서 삼채 잎 열수 추출물은 23 mg GAE/g, 80% 에탄올 추출물은 30 mg GAE/g, 60% 메탄올 추출물은 2.77 mg GAE/g, 80% 메탄올 추출물은 2.76 mg GAE/g이었으며, 삼채 뿌리 95% 에탄올 추출물은 24.94 mg GAE/g로 나타났다(Lee et al. 2014; Hwang et al. 2015; Zhng et al. 2015). 노지에서 재배된 삼채 잎의 페놀 함량은 120.98 mg GAE/g이었으며, 시설에서 재배된 삼채 잎의 페놀 함량은 117.08 mg GAE/g이었다(Won et al. 2013). 본 연구에서 인공광 재배된 삼채 잎의 총 페놀 함량은 재배 환경과 추출조건이 달라 이전 보고된 결과보다 낮은 것으로 보이며, 인공광 재배 조건에 따라 총 페놀 함량에서 차이를 나타냈다. 본 연구에서도 이전 결과와 유사하게 노지에서 재배한 삼채 잎에서 인공광으로 재배한 삼채 잎보다 높은 페놀 함량이 관찰되었다. 이전 연구에 의하면 단일 광원을 사용하는 것보다 다른 파장의 광원을 함께 사용하면 페놀화합물과 총 플라보이드, 카로티노이드 등 기능성분이 증가하고, 동일한 광질을 처리하여도 작물에 따라 기능성분이 다르게 반응한다고 보고되었다(Kim et al. 2019). 식물공장에서 재배된 방풍나물의 총 페놀 함량은 청+백색 LED, 청+적+백색 LED, 청+적색 LED+FL, 백색 LED+FL 혼합 광원에 따라 차이가 있었다(Kim et al. 2021). 본 연구에서 이전 보고와 유사하게 단일 광원만 사용한 경우보다 적색과 청색 혼합광원을 사용한 삼채 잎에서 높은 페놀 함량이 확인되었다.
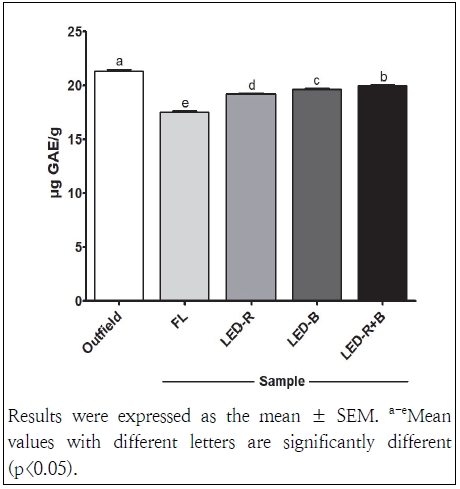
Total phenolic contents of the extracts of A. hookeri leaves grown in an outfield and a plant factory using different artificial lights. Outfield, A. hookeri leaves grown in an outfield with soil; FL, A. hookeri leaves grown in a plant factory with FL; LED-R, A. hookeri leaves grown in a plant factory with LED-R; LED-B, A. hookeri leaves grown in a plant factory with LED-B; LED-R+B, A. hookeri leaves grown in a plant factory with LED-R+B.
2. 라디칼 소거 활성
DPPH에 의한 전자공여능은 수소나 전자를 받아 환원될 때 보라색이 탈색되는 원리를 이용하며 비교적 짧은 시간 내에 항산화능을 측정할 수 있어 널리 사용되고 있는 방법이다. ABTS 라디칼 소거능 평가는 ABTS+이 시료 내의 항산화 물질에 의해 제거되어 탈색되는 원리를 이용한 항산화 측정 방법이다(Yu et al. 2021). 그러나, DPPH는 음이온 라디칼을, ABTS는 양이온 라디칼을 생성하며 기질과 반응물질의 결합 정도가 서로 달라 측정 결과가 상이할 수 있다(Kwak & Choi 2015).
DPPH 및 ABTS 라디칼 소거능을 측정한 결과는 Table 1에 나타내었다. DPPH 라디칼 소거능은 농도에 따라 다소 차이가 있지만 LED-R>FL>LED-R+B>LED-B>노지 순으로 높게 나타났으며, 삼채 잎 추출물의 농도가 증가함에 따라 유의적으로 DPPH 라디칼 소거능이 증가하였다. 삼채 잎 추출물의 IC50 값은 노지 3,298 μg/mL, FL 1,165 μg/mL, LED-R 773.2 μg/mL, LED-B 1,200 μg/mL, LED-R+B 1,146 μg/mL이었다. Lee et al.(2014) 연구에 의하면 노지 재배 삼채 잎 주정 추출물의 DPPH 라디칼 소거능은 IC50 633 μg/mL이었다. 노지와 하우스 재배 삼채 잎의 DPPH 소거 활성을 측정한 이전 연구에서 하우스 재배 삼채 잎 추출물의 IC50은 2.74 mg/mL이었지만, 노지 재배 삼채 잎은 5.63 mg/mL로 하우스 재배 삼채 잎의 라디칼 소거능이 높은 것으로 나타났다(Won et al. 2013). 인공광을 이용하여 재배한 방풍나물은 노지에서 재배한 방풍나물에 비해 낮은 DPPH 라디칼 소거능을 보였다(Kim et al. 2021). 그러나 본 연구에서는 인공광을 이용하여 재배한 삼채 잎에서 노지보다 우수한 DPPH 라디칼 소거능을 보였고, 이전에 보고된 하우스에서 재배한 삼채 잎 추출물의 IC50결과 보다 낮은 값을 보였다. 형광등보다 적색 LED 광원을 이용하여 재배한 삼채 잎에서 뛰어난 항산화 효과가 나타났다.

Radical scavenging activities of A. hookeri leaves grown in an outfield and the plant factory using different artificial lights
ABTS 라디칼 소거능은 LED-R>LED-B>FL>LED-R+B>노지 순으로 높게 나타났으며, 농도 의존적으로 ABTS 라디칼 소거 활성이 증가하였다. 삼채 잎 추출물의 IC50은 노지 534 μg/mL, FL 280.2 μg/mL, LED-R 236.4 μg/mL, LED-B 259.9 μg/mL, LED-R+B 290.9 μg/mL이었다. 이전의 연구에서 노지 재배한 삼채 잎 10 mg/mL 농도에서 60.89% ABTS 라디칼 소거 활성이 보고되었으나(Lee et al. 2014), 본 연구에서 모든 인공광 재배한 삼채 잎의 ABTS 라디칼 소거 활성은 2 mg/mL 농도에서 100% 이상으로 나타났다. 노지와 인공광 재배 방풍나물의 ABTS 라디칼 소거능을 비교한 연구에 의하면, 인공광을 이용하여 재배했을 때보다 노지에서 재배한 방풍나물의 항산화 효과가 높은 것으로 나타났다(Kim et al. 2021). 그러나 본 연구에서 노지보다 인공광에서 재배한 삼채 잎의 항산화 효과가 더 우수한 것으로 나타나, 인공광으로 재배시 작물의 라디칼 소거능이 향상되는 것을 확인할 수 있었다.
3. 항산화 효소 활성
SOD는 세포 독성을 완화하는 역할을 하고, 생체 내 활성산소종에 대한 방어 기작을 가지는 대표적인 항산화 효소이며, CAT는 독성물질인 H2O2나 ROS의 분해 작용에 관여하는 대표적인 항산화 효소이다(Jeong et al. 2021).
SOD와 CAT 활성을 측정한 결과는 Table 2에 나타내었다. 삼채 잎의 SOD 활성을 측정한 결과, 노지 10.47~11.62 U/mL, FL 10.93~11.84 U/mL, LED-R 11.14~11.74 U/mL, LED-B 10.90~11.26 U/mL, LED-R+B 11.52~12.27 U/mL이었다. 인공광원의 종류에 의해 유의적으로 차이가 있었고 노지에서 재배된 삼채 잎의 SOD 활성과 유사하거나 다소 높은 경향을 보였다. 그러나 이전의 연구에서 노지와 청+백색 혼합 LED 이용 식물공장에서 재배한 방풍나물의 SOD 활성은 250 μg/mL 농도에서 6.16 U/mL와 2.00 U/mL로, 식물공장보다 노지에서 재배한 방풍나물의 SOD 활성이 더 높게 관찰되었다(Kim et al. 2021).

Enzymatic activities of A. hookeri leaves grown in outfield and the plant factory using different artificial lights
삼채 잎의 CAT 활성을 측정한 결과, 500 μg/mL 이하의 농도에서 LED-R+B의 CAT 활성이 가장 높았고(16.29 U/mL), 1,000 μg/mL 농도에서 LED-R의 활성이 가장 높게 나타났다(17.41 U/mL). 이전의 연구에서 노지 재배된 방풍나물(250 μg/mL)의 CAT 활성은 6.05 U/mL이었고, 청+백색 혼합 LED를 이용하여 재배한 방풍나물의 활성은 5.99 U/mL(Kim et al. 2021)로, 인공광보다 노지에서 재배시 항산화 효소 활성이 높았다. 그러나 본 연구에서는 인공광으로 재배한 삼채 잎에서 노지보다 우수한 항산화 효소 활성이 관찰되었고, SOD 활성은 혼합 광원으로 재배시 삼채 잎의 항산화 효소 활성이 다른 광원에 비해 높게 나타났다. CAT 활성은 500 μg/mL 농도에서는 혼합광원, 1,000 μg/mL 농도에서는 적색 LED 광원으로 재배시 항산화 효소 활성이 다른 광원에 비해 우수했다. 따라서 항산화 활성은 작물에 따라 광원에 의한 차이를 보일 수 있고, 특히 인공광에서 재배된 삼채 잎은 노지에서 재배된 것보다 항산화 효과가 우수하여 이를 이용한 제품 개발이 기대된다.
4. 세포 안전성 및 NO 생성 억제 활성
RAW264.7 세포의 안전성에 미치는 영향을 알아보기 위하여 cell viability assay를 수행하였다. 그 결과, 모든 시료가 대조군인 배지보다 세포 생존율이 증가하여 100% 이상으로 나타났으나, 노지 재배 삼채 잎 추출물 500 μg/mL 처리군에서는 대조군보다 감소하는 경향을 보였다(91.8%). 그리고 15.6과 500 μg/mL 농도에서만 광원 사이에 유의적인 세포 생존율의 차이를 보였다(Fig. 2). 이를 통해 모든 삼채 잎의 추출물은 세포에 독성 및 안전성에 영향을 미치지 않은 것으로 확인되었고, 같은 농도의 시료로 NO 생성 억제 활성을 측정하였다.
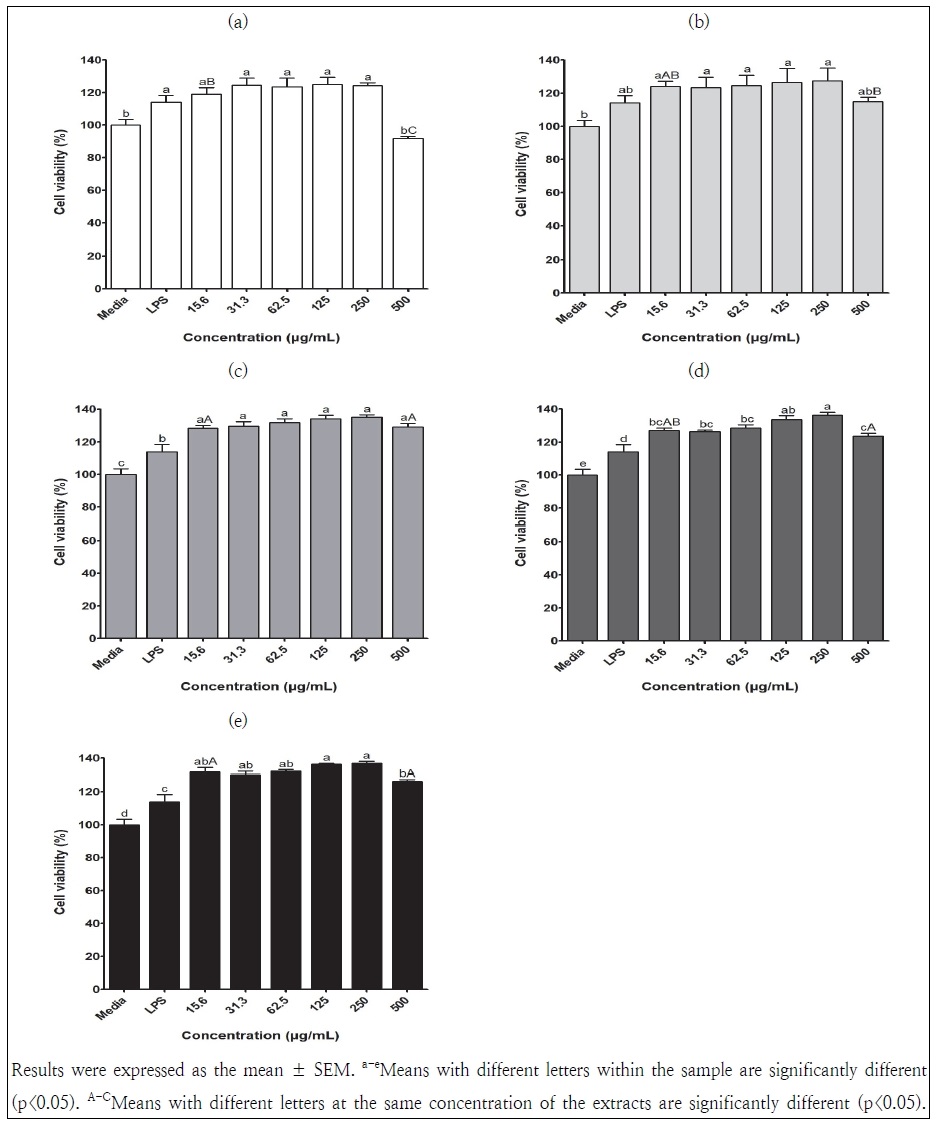
Effects of the extracts of A. hookeri leaves grown in an outfield and the plant factory using different artificial lights on the viability of LPS-stimulated RAW264.7 cells. (a) A. hookeri leaves grown in an outfield with soil; (b) A. hookeri leaves grown in a plant factory with FL; (c) A. hookeri leaves grown in a plant factory with LED-R; (d) A. hookeri leaves grown in a plant factory with LED-B; (e) A. hookeri leaves grown in a plant factory with LED-R+B.
고농도의 NO 생성은 peroxynitrite, nitrogen dioxide와 같은 유해 물질을 생성하여 암의 형성에 관여하고, 세포내 유해한 산화물질의 축적, DNA 손상, 세포 자연사 등을 발생시킨다(Kim et al. 2012). LPS 처리한 RAW264.7 세포에서 노지 및 인공광 재배 삼채 잎 추출물의 NO 생성 억제 효과를 측정한 결과는 Fig. 3과 같다. 노지 및 인공광 재배 삼채 잎 추출물의 농도가 증가함에 따라 RAW264.7 세포에서 NO 생성량이 유의적으로 감소하였다. NO 억제능은 농도에 따라 노지에서 재배한 삼채 잎 추출물 13.5~61.3%, FL에서 재배한 삼채 잎 추출물 3.5~57.2%, LED-R에서 재배된 삼채 잎의 추출물 7~54.1%이었으며, LED-B에서 재배된 삼채 잎 추출물 13.4~61.6% 그리고 LED-R+B의 복합 광원으로 처리된 삼채 잎의 추출물 9.3~58.6%이었다. 삼채 잎 추출물은 31.3 μg/mL 농도에서부터 NO 생성량을 억제하는 효과가 있었다. 전체적으로 노지 재배 삼채 잎 추출물(62.5~250 μg/mL)에서 NO 생성 억제능이 높았지만, 500 μg/mL 농도에서는 LED-B 삼채 잎 추출물에서 NO 억제 효과가 가장 높게 나타났다. 인공광 조건으로 재배한 삼채 잎의 추출물에서는 비슷한 NO 생성 억제 효과를 보였고, 광원 사이에는 유의적인 차이를 보이지 않았다(p>0.05). 이전 보고된 연구에 따르면 삼채 잎의 열수 추출물은 200 μg/mL의 농도에서 약 50%의 NO 생성 억제능을 보였고, 삼채 뿌리 주정 추출물의 NO 생성 IC50 value는 29.13 μg/mL이었다(Lee et al. 2014; Zhang et al. 2015). 본 연구에서 삼채 잎 주정 추출물의 IC50은 노지 231 μg/mL, FL 334.6 μg/mL, LED-R 363.2 μg/mL, LED-B 300.2 μg/mL, LED-R+B 333.3 μg/mL으로 유사하거나 다소 낮은 NO 생성 억제 활성을 보였다. 노지 및 시설에서 재배된 삼채 잎은 농도 의존적으로 NO 생성을 억제하였으며, 노지보다 하우스에서 재배된 삼채 잎에서 강하게 NO 생성을 저해하였다(Won et al. 2013). 그러나 노지와 청+백색 혼합 LED 재배 방풍나물의 NO 생성 억제능은 250 μg/mL 농도에서 10.1%와 5.6%로 노지 재배 작물에서 더 높게 나타났다(Kim et al. 2021). 따라서 작물의 종류에 따라 광원별 NO 생성 억제능이 다를 수 있고, 이로 인한 항염증 관련 효과도 다른 결과가 나올 수 있을 것으로 보인다.
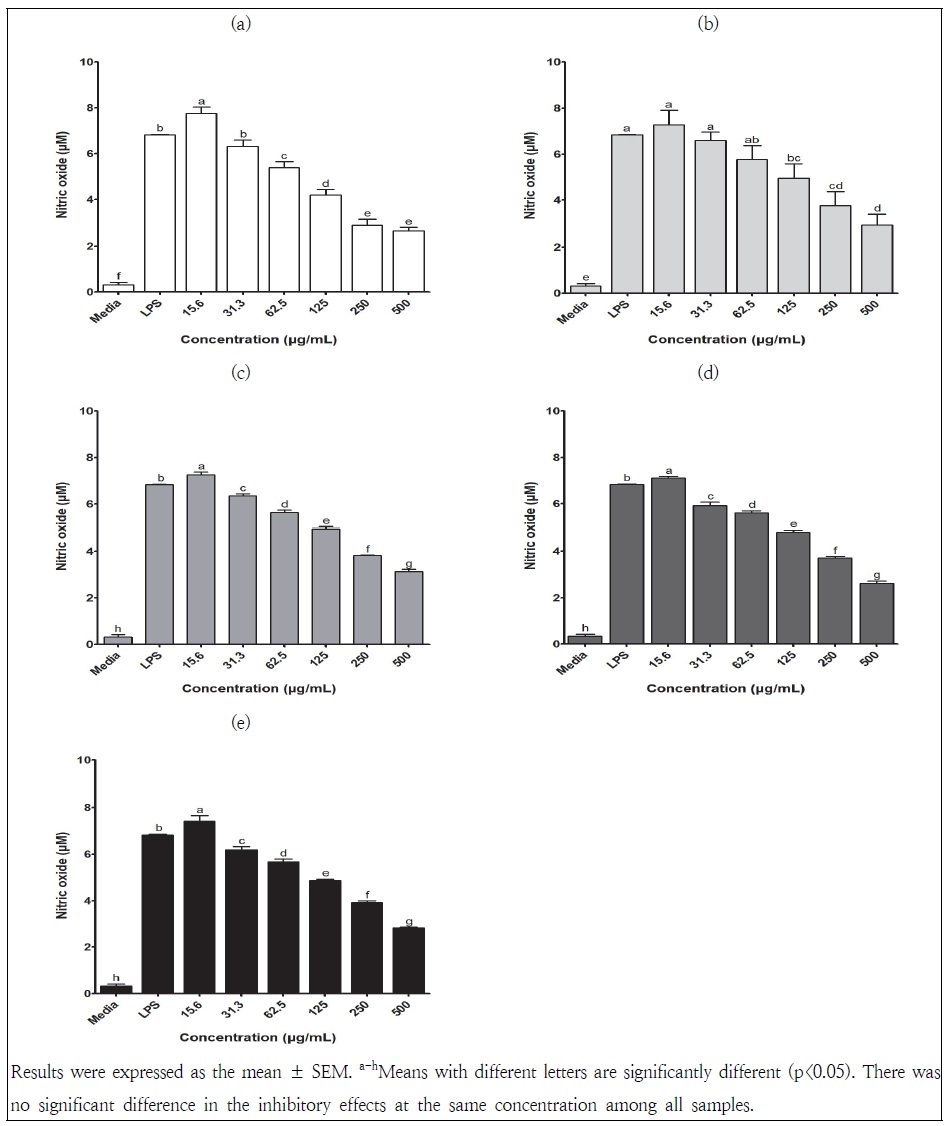
Inhibitory effects of the extracts of A. hookeri leaves grown in an outfield and the plant factory using different artificial lights on the nitric oxide (NO) production from LPS-stimulated RAW264.7 cells. (a) A. hookeri leaves grown in an outfield with soil; (b) A. hookeri leaves grown in a plant factory with FL; (c) A. hookeri leaves grown in a plant factory with LED-R; (d) A. hookeri leaves grown in a plant factory with LED-B; (e) A. hookeri leaves grown in a plant factory with LED-R+B.
Ⅳ. 요약 및 결론
본 연구에서는 노지와 인공광을 이용한 식물공장에서 재배한 삼채 잎 주정 추출물의 항산화 및 항염 효과를 비교 평가하였다. 인공광원으로 형광등과 적색 LED, 청색 LED, 적+청색 혼합 LED를 이용하여 삼채를 재배하였다. 항산화 효과는 삼채 잎 추출물의 총 페놀 함량과 DPPH, ABTS 라디칼 소거능과 SOD, CAT 효소 활성을 통해 평가하였다. 또한, 세포 독성과 LPS 처리한 RAW 264.7 세포에서의 NO 생성량을 통해 항염증 가능성을 비교하였다. 연구 결과, 총 페놀 함량은 노지에서 재배한 삼채 잎에서 가장 높게 나타났지만, 라디칼 소거능을 비롯한 항산화 효소 활성은 인공광을 이용하여 재배한 삼채 잎에서 높거나 노지와 유사한 수준을 보였다. 본 실험에 사용된 모든 삼채 잎의 추출물은 RAW264.7 세포에 대해 독성을 나타내지 않았고, 우수한 NO 생성 억제 효과를 보였다. 따라서 식물공장에서 인공광원으로 재배한 삼채 잎은 노지와 유사하거나 우수한 기능성을 갖고 있고, 앞으로 이들 작물을 이용하여 다양한 기능성 소재 개발이 기대된다.
Acknowledgments
This research was supported by the R&D grant (PJ01580203) from the Rural Development Administration, Republic of Korea.
References
-
Chung SO, Kim YM, Ryu DG, Kim SJ, Park JT(2014) Variation of functional compounds in leafy Chinese cabbage grown under different light conditions in a plant factory. Korean J Food Sci Technol 46(4), 526-529.
[https://doi.org/10.9721/KJFST.2014.46.4.526]

-
Deka B, Manna P, Borah JC, Talukdar NC(2022) A review on phytochemical, pharmacological attributes and therapeutic uses of Allium hookeri. Phytomedicine Plus 2, 100262.
[https://doi.org/10.1016/j.phyplu.2022.100262]

-
Hwang JS, Lee BH, An X, Jeong HR, Kim YE, Lee I, LLee H, Kim DO(2015) Total phenolics, total flavonoids, and antioxidant capacity in the leaves, bulbs, and roots of Allium hookeri. Korean J Food Sci Technol 47(2), 261-266.
[https://doi.org/10.9721/KJFST.2015.47.2.261]

-
Jeong WY, Kim AN, Choi Y, Kim N, Jeong MS, Kim C(2021) Physicochemical chracteristics and antioxidative activities of Tenebrio molitor larvae hydrolysates with different extraction methods. Korean J Community Living Sci 32(4), 599-610.
[https://doi.org/10.7856/kjcls.2021.32.4.599]

-
Jung J, Lee EB, Kim SH, Choi JH, Kim JS, Kim JH, Jeong UY, Choi H, Lee YS, Lee SH(2022) Antioxidant and immune-enhancing effects of Curcuma longa extracts. J East Asian Soc Diet Life 32(3), 137-148.
[https://doi.org/10.17495/easdl.2022.6.32.3.137]

- Jung JY, Ko KS(2016) A study on the potential of functional cosmetic material according to the biological activity and cytoxicity of Allium hookeri leaf extract. J Korean Soc Cosm 22(6), 1386-1393. uci:G704-001852.2016.22.6.016
-
Kim CH, Lee MA, Kim TW, Jang JY, Kim HJ(2012) Anti-inflammatory effect of Allium hookeri root methanol extract in LPS-induced RAW264.7 cells. J Korean Soc Food Sci Nutr 41(11), 1645-1648.
[https://doi.org/10.3746/jkfn.2012.41.11.1645]

-
Kim MW(2017) Effects of dietary supplementation with Allium hookeri root on hepatic enzyme contents in streptozotocin-induced diabetic rats. J East Asian Soc Diet Life 27(4), 399-407.
[https://doi.org/10.17495/easdl.2017.8.27.4.399]

-
Kim SH, Lee EB, Kim JS, Choi JH, Jeong UY, Heo JW, Shi CK, Lee SH(2021) Antioxidant and anti-inflammatory effects of Peucedanum japonicum grown in the plant factory with artificial lights. Food Eng Prog 25(4), 391-400.
[https://doi.org/10.13050/foodengprog.2021.25.4.391]

-
Kim YM, Sung JK, Lee YJ, Lee DB, Yoo CH, Lee SB(2019) Varying effects of artificial light on plant functional metabolites. Korean J Environ Agric 38(1), 61-67.
[https://doi.org/10.5338/KJEA.2019.38.1.7]

-
Kwak CS, Choi HI(2015) In vitro antioxidant and anti-inflammatory activities of ethanol extract and sequential fractions of flowers of Prunus persica in LPS-stimulated RAW264.7 macrophages. J Korean Soc Food Sci Nutr 44(10), 1439-1449.
[https://doi.org/10.3746/jkfn.2015.44.10.1439]

-
Lee GI, Kim HJ, Kim SJ, Lee JW, Park JS(2016) Increased growth by LED and accumulation of functional materials by florescence lamps in a hydroponics culture system for Angelica gigas. Prot Hortic Plant Fac 25(1), 42-48.
[https://doi.org/10.12791/KSBEC.2016.25.1.42]

-
Lee KW, Kim YS, Park PJ, Jeong JH(2014) Comparison of effect of water and ethanolic extract from roots and leaves of Allium hookeri. J Korean Soc Food Sci Nutr 43(12), 1808-1816.
[https://doi.org/10.3746/jkfn.2014.43.12.1808]

- National Institute of Agricultural Sciences(2018) The rediscovery of Allium hookeri. Wanju-gun: National Institute of Agricultural Sciences, pp2-4
- Rural Development Administration(2018) Plant factory. Jeonju-si: Rural Development Administration, pp10-20
-
Sul S, Baek Y, Cho YY(2022) Effects of light intensity, light quality and photoperiod for growth of perilla in a closed-type plant factory system. J Bio-Environ Control 31(3), 180-187.
[https://doi.org/10.12791/KSBEC.2022.31.3.180]

-
Won JY, Yoo YC, Kang EJ, Yang H, Kim GH, Seong BJ, Kim SI, Han SH, Lee SS, Lee KS(2013) Chemical components, DPPH radical scavenging activity and inhibitory effects on nitric oxide production in Allium hookeri cultivated under open field and greenhouse conditions. J Korean Soc Food Sci Nutr 42(9), 1351-1356.
[https://doi.org/10.3746/jkfn.2013.42.9.1351]

-
Yu SY, Lee YJ, Song HS, Hong HD, Lim JH, Choi HS, Lee BY, Kang SN, Lee OH(2012) Antioxidant effects and nitrite scavenging ability of extract from Acanthopanax cortex shoot. Korean J Food Nutr 25(4), 793-799.
[https://doi.org/10.9799/ksfan.2012.25.4.793]

-
Zhang C, Tong T, Kim CK, Liu Y, Seo HJ, Kim BS, Kang SG(2015) Antioxidant and anti-inflammatory properties of extracts from Allium hookeri root. Korean J Food Preserv 22(6), 867-877.
[https://doi.org/10.11002/kjfp.2015.22.6.867]
