
비파 부위별 에탄올 추출물의 항산화 활성 및 암세포 증식 억제효과
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0), which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The current study was carried out to determine the effects of the seed, flesh (seedless fruit), and leaf of loquat (Eriobotrya japonica Lindle.) on antioxidative activity and anti-proliferation in human cancer cells. Total polyphenol contents of loquat seed, flesh, and leaf ethanol extracts were found to be 17.77, 32.32, and 28.08 mg/g, respectively. Also, total flavonoid contents of loquat seed, flesh, and leaf ethanol extracts were found to be 18.77, 28.73, and 21.35 mg/g, respectively. The IC50 values of DPPH hydroxyl scavenging of loquat seed, flesh, and leaf ethanol extracts were 0.049, 0.063, and 0.042 mg/mL, respectively. Antioxidative indexes of loquat leaf and seed ethanol extracts was highly and it was similar to the BHA and BHT. The antioxidative activities in loquat seed and leaf ethanol extracts were higher in loquat flesh. The antiproliferation effect of loquat seed and leaf ethanol extracts on liver cancer cell line (H460), stomach cancer cell line (AGS) and lung cancer cell line (A549) showed higher values compared with the flesh ethanol extracts. These results indicate that loquat ethanol extracts may play a positive role in antioxidative properties and cancer prevention.
Keywords:
loquat, total polyphenol, antioxidative effect, human cancer cell linesI. 서론
산업화로 인해 증가되는 각종 환경오염 물질, 흡연, 알코올, 방사선 등은 반응성이 높은 활성산소종(Reactive Oxygen Species, ROS)을 생성시키는 원인이 된다. 이러한 활성산소종은 인체 내에 존재하는 superoxide dismutase, catalase, peroxidase, glutathione reductase 등과 같은 항산화계의 역할만으로는 방어체계가 초과되어 산화적 스트레스(oxidative stress)를 발생시켜 세포막과 단백질 분해, DNA 합성 억제 등의 손상이 유발된다고 알려져 있다(Frei 1994; Sözmen et al. 1994). 과도한 산화적 스트레스 상태가 지속될 경우 심혈관질환, 당뇨, 암, 신경질환과 같은 만성퇴행성질환 및 노화를 촉진한다(Sohal et al. 1990).
2014년 통계에 의하면 우리나라의 사망률 중 가장 높게 나타난 것은 악성 신생물(암)로 65세 이상 성인의 암 종류별 사망률이 인구 10만명 당 폐암이 181.9명으로 가장 높았고, 간암(90.1명), 대장암(86.5명), 위암(83.2명), 췌장암(56.3명) 순으로 나타났다(2014, National Statistical Office Republic of Korea). 암 치료법으로는 암세포 사멸을 위하여 암환자에게 투여된 약물요법으로 항암화학요법이 있다(Miyata et al. 2012). 식물로부터 유래한 대표적인 항암물질은 taxol, vinblastine 등이 이용되고 있으며 이러한 식물로부터 획득한 항암제가 합성 항암제보다 치료에 효과적이다(Shen et al. 1986). 이는 합성 화학제품들이 임상결과 암세포의 작용보다 정상세포나 조직에 더 크게 작용하여 골수세포, 임파세포 파괴에 의한 저항력 약화 등의 2차 감염을 유발한다고 보고되었다(Yang et al. 2001). 따라서 효과적인 항암제는 정상세포에 대한 독성을 보이지 않고 타깃하는 암세포에 대한 선택적 공격이 중요하다.
비파나무는 비파속(Eriobotrya japonica Lindle.)의 장미과(Resaceae)에 속하며, 상록 소교목으로 잎 표면에는 털이 없으며 광택이 나고 타원상의 긴 난형으로 우리나라는 제주도를 비롯한 전남 및 경남지방 등의 기후 조건에서 주로 자생하고 있다. 비파나무의 잎은 비파옆(枇杷葉)이라 불리며, 예로부터 부종, 진해, 거담, 건위, 청폐, 이뇨, 기관지염, 구역질, 딸꾹질, 폐열해소 등에 효능이 있다고 알려져 민간요법으로 사용되어 왔다(Yook 1989). 비파는 항암제로도 오래전부터 사용되어 왔으며, 비파 잎, 씨(종자), 줄기 및 과육 추출물이 암세포 및 복수암 유발 마우스의 항암효과에 관한 연구도 수행되었다(Whang et al. 1996). 비파 잎에는 다양한 terpenoid (Nazato et al. 1984)와 플라보노이드(Jung et al. 1999) 등의 유용한 화합물을 다량 함유하고 있으며, 항당뇨, 항암활성, 항산화, 항염증, 항돌연변이 등이 보고(Lee et al. 2004)되었다. 비파 씨는 폴리페놀 화합물군과 독성이 있는 것으로 알려져 있지만 한편으로는 항암효과도 있는 것(Moertel et al. 1982)으로 알려진 amygdalin도 함유하고 있어 산화적 스트레스를 감소시키는 항산화효과가 있다고 보고되었다(Nazato et al. 1994; Jung et al. 1994; Taniguchi et al. 2002). 이 밖에도 비파 잎, 씨 또는 과육에 다량 함유되어 있는 유용한 화합물들의 항산화효과(Jung et al. 1994; Koba et al. 2007; Lee et al. 2009), 항당뇨효과(Chen et al. 2008), 항염증 및 항암효과(Ito et al. 2002; Banno et al. 2005; Huang et al. 2007), 항바이러스효과(De Tommasi et al. 1992)에 대한 연구도 보고되었다. 최근 들어 우리나라 남해안 지역이 비파 재배에 적합한 기후 조건으로 판단되어 비파를 지역 특화작목으로 육성하고 있어 재배 면적이 점차 증가하는 추세로 제품화에 응용할 수 있는 다양한 기초 연구 자료가 필요한 실정이다. 따라서 비파 부위별 생리활성 평가는 각종 건강식품 및 의약품 개발의 기초자료로서 활용가치가 클 것으로 기대된다.
이에 본 연구에서는 각종 약리효과와 생리활성 물질을 함유하고 있는 비파의 씨, 과육 및 잎을 가지고 생리활성 효능 검증의 일환으로 in vitro 에서 항산화 효능 및 인체유래 3종의 암세포(간암, 위암 및 폐암) 증식 억제효과에 미치는 효과를 살펴보고자 실시하였다.
Ⅱ. 연구방법
1. 실험재료
비파 열매와 잎은 전남 완도에서 재배한 것을 구입하였으며, 비파 열매는 과육과 씨(종자)로 분리하였다. 비파 씨, 과육 및 잎은 수세, 정선 및 탈수과정을 거친 다음 -70℃ 동결건조기(MDF-U52V, Sanyo, Osaka, Japan)에 건조하여 분쇄기로 분쇄하여 -70℃에서 냉동보관하면서 시험 시료로 사용하였다. 각 시험 항목에 대한 분석은 3회 반복 실시하였으며, 본 시험에 사용한 시약은 특급으로 구입하여 사용하였다.
2. 비파 씨, 과육 및 잎의 에탄올 추출
동결 건조된 비파 씨, 과육 및 잎은 각각 100 g당 80% ethanol 1500 mL을 첨가하여 환류냉각관을 부착한 65℃의 Heating mantle(Mtops ms-265, Seoul, Korea)에서 3시간씩 3회 추출하였다. 추출액은 Whatman filter paper(No.2, GE Heathcare, Buckinghamshire, UK)로 여과하였으며, 여액은 40℃ 수욕 상에서 감압농축기(EYELA VACUUM NVC-1100, Tokyo, Japan)를 이용하여 용매를 제거하고, 비파 과육, 씨 및 잎의 추출 수율을 구하였다(Table 1). 각 부위별 비파 에탄올 추출물은 산화 방지를 휘하여 -70℃에 냉동 보관하면서 실험을 수행하였다.
3. 총 폴리페놀 함량 측정
비파 각 부위별 에탄올 추출물의 총 폴리페놀 함량은 Folin & Denis(1912) 방법에 의거하여 측정하였다. 시험관에 비파 씨, 과육 및 잎 에탄올 추출물 각각 1 mL(0.5 mg/mL)와 Folin reagent 2 mL을 넣어 섞어 실온에서 3분간 둔 다음 10% Na2CO3 2 mL을 첨가하였다. 이를 잘 혼합한 후 30℃에서 40분간 정치한 다음 분광광도계(Shimadzu UV-1601PC, Kyoto, Japan)를 이용하여 760 nm에서 흡광도를 측정하였다. 표준곡선은 tannic acid(0.0, 0.2, 0.4, 0.6, 0.8, 1.0 mg/mL)를 사용하여 작성하였으며, 검량곡선을 이용하여 각 시료의 총 폴리페놀 함량을 산출하였다.
4. 총 플라보노이드 함량 측정
총 플라보노이드 함량은 Davis방법을 일부 변형시킨 Chae et al.(2002)의 방법에 따라 측정하였다. 시험관에 비파 씨, 과육 및 잎 에탄올 추출물 각각 1 mL(0.5 mg/mL)와 diethylene glycol 2 mL을 첨가하여 잘 섞은 후 1N NaOH 20 μL을 넣었다. 그 후 37℃ 항온수조에서 1시간 동안 반응시킨 후 분광광도계(Shimadzu UV-1601PC, Kyoto, Japan)를 사용하여 420 nm에서 흡광도를 측정하였다. 표준곡선은 rutin(0, 0.2, 0.4, 0.6, 0.8, 1.0 mg/mL)을 이용하여 작성하였으며, 이 검량곡선으로부터 각 시료의 총 플라보노이드 함량을 구했다.
5. 2,2-diphenyl–1-picryl hydrazyl(DPPH) radical 소거능 측정
각 부위별 비파 에탄올 추출물의 DPPH radical 소거능은 Blois(1958)의 방법으로 측정하였다. 비파 씨, 과육 및 잎 에탄올 추출물 각각 1 mL와 0.2 mM DPPH(Sigma-Aldrich Co, Louis, MO, USA) 1 mL을 시험관에 넣은 후 잘 혼합하여 37℃에서 30분간 반응시킨다. 그 후 분광광도계(Shimadzu UV-1601PC, Kyoto, Japan)를 사용하여 517 nm에서 흡광도를 측정하였다. DPPH radical 소거능 활성 비교를 위하여 양성대조군으로 합성항산화제인 butylated hydroxyanisole (BHA)와 butylated hydroxytoluene (BHT)를 이용하여 시료와 동량의 농도를 첨가하여 측정하였다. 비파의 각 부위별 추출물의 DPPH radical 소거능은 (1-시료첨가구의 흡광도/무첨가구의 흡광도)×100에 의하여 계산하였다..
6. 항산화지수 측정
항산화지수(antioxidant index, AI)는 Joo & Kim (2002) 방법으로 Rancimat(Metrohm Model 679, Herisan, Switzerland)을 가지고 측정하였다. 비파 각 부위별 추출물에 함유된 용매는 Speed vaccum dryer(Eyela FDU-2100, Tokyo Rikakikai Co., Tokyo, Japan)로 제거하였다. 농도가 500 ppm이 되도록 분석 시료 추출물과 soybean oil(Sigma-Aldrich Co., St. Louis, MO, USA)을 첨가하여 초음파(SONICS®, UCX-750, CT, USA)를 이용하여 시료와 유지가 잘 섞이도록 하였다. 이들 용액은 각각 3.0 g씩 반응 용기에 넣고 증류수 70 mL을 가한 후 110℃에서 air flow rate 20 L/h로 하여 산화 안정성을 비교하였다. 양성대조군은 기존의 상업용 합성항산화제인 BHT를 사용하였으며 시료와 같은 방법으로 유지에 첨가하여 관찰하였다.
7. 세포배양
인체유래 암세포주는 간암세포 H460, 위암세포 AGS 및 폐암세포 A549로 한국세포주은행(KCLB, Seoul, Korea)으로부터 분양받아 사용하였다. H460, AGS 및 A549세포는 10% fetal bovine serum, 100 units/mL penicillin, 10 μg/mL streptomycin이 함유된 DMEM 배지로 37℃, 5% CO2 incubator(Model 311, Forma, Waltham, MA, USA)에서 배양하였다. 배양된 각 세포는 한 주에 2~3회 배지를 갈아주면서 6~7일 간격으로 phosphate buffered saline로 세척하였다. 0.05% trypsin-0.02% EDTA로 부착된 세포를 분리하여 원심분리한 후 상등액을 제거한 다음 세포에 배지를 넣고 피펫으로 세포가 골고루 분산되도록 잘 혼합하였다. 세포는 6~7일마다 계대배양하면서 실험에 사용하였다.
8. 암세포 증식 억제율
암세포 성장 억제효과는 Ishiyama et al.(1996) 방법에 따라 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) assay하였다. 1×105 cell/well 농도로 96 well plate에 100 μL씩 분주하여 37℃, 5% CO2 incubator(Model 311, Forma, Waltham, MA, USA)에서 24시간 배양하였다. 그 후 전 배양에 사용된 배지는 제거하고 일정 농도로 희석된 추출물 100 μL를 배지에 처리하여 24시간 배양하였다. 그 후 MTT 시약(2 mg/mL)을 well 당 10 μL씩 넣은 다음 5% CO2 incubator에서 4시간 더 배양하였다. 배양이 끝난 후 MTT 시약이 포함된 배지를 제거하고 dimethyl sulfoxide(DMSO) 100 μL를 가하여 상온에서 발색시킨다. ELISA Microplate reader(ELx808, Bio Tek Inc., Winooski, VT, USA)를 이용, 540 nm에서 흡광도를 측정하였다.
| (1) |
9. 통계분석
실험은 3회 반복 수행하였으며, 본 실험에서 얻어진 통계분석 결과는 SPSS(Statistical Package for Social Science)를 이용해서 실시하였다. 실험군당 평균 ± 표준오차로 표시하였으며 그룹 간 평균 차에 의한 통계적 유의성을 검정하기 위해 일원배치 분산분석(one-way analysis of variance)을 실시 한 후 p<0.05 수준에서 Tukey’s test를 이용하여 사후 검정(Post-Hoc test)을 실시하였다.
Ⅲ. 결과 및 고찰
1. 추출 수율
비파 부위별 항산화효과를 검토하기 위하여 씨, 과육 및 잎을 냉동 건조하여 마쇄한 분말 시료를 80% 에탄올로 추출한 후 추출 수율을 구하였는데, 추출 수율은 Table 1과 같다. 비파의 씨, 과육 및 잎의 에탄올 추출 수율은 각각 13.40, 17.10, 14.10%로 나왔으며, 과육부에서 추출 수율이 좀 더 높게 나타났다. 식물 추출물이 생리활성이 우수하여도 그 추출 수율이 낮을 경우에는 경제성이 없기 때문에 실질적으로 이용하기 어려운 부분이 있어 추출 수율은 기능성 식물 추출물의 제형화 및 산업화에 고려되어야 할 중요한 요인으로 작용한다. 추출 수율이 10% 이상이면 경제성이 있는 것으로 알려져 있는데(Park et al. 2003), 본 연구 결과 비파의 과육, 씨, 잎의 추출 수율이 모두 10% 이상이 나와 경제적으로 활용 가능성이 있는 식물 소재라 여겨진다.
2. 총 폴리페놀과 총 플라보노이드 함량
비파 씨, 과육 및 잎 에탄올 추출물의 총 폴리페놀과 총 플라보노이드 함량을 분석하였는데 그 결과는 Table 1과 같다. 비파 씨 에탄올 추출물의 총 폴리페놀 함량은 28.06 ± 0.88 mg/g, 과육 추출물은 17.77 ± 1.05 mg/g, 잎 추출물은 32.32 ± 1.41 mg/g를 함유하고 있는 것으로 나타나 잎에서 유의적으로 높게 나타났으며, 씨, 과육 순으로 나타났다. Park et al.(2008)이 보고한 비파 각 부위별 에탄올 추출물의 총 폴리페놀 함량을 조사한 결과도 잎, 씨, 과육 순으로 나타나 본 연구와 비슷한 경향을 보였다. 페놀성 화합물이 다량 함유된 대표적인 식물인 녹차와 보이차 추출물의 총 폴리페놀 함량을 분석한 결과는 각각 10.15 mg/g와 6.00 mg/g로 보고(Son et al. 2005)되어, 본 연구의 비파 잎의 총 폴리페놀의 함량이 녹차와 보이차에 비하여 더 높은 것으로 나타났다. 비파의 부위별 총 플라보노이드 함량은 씨 21.35 ± 1.01 mg/g, 과육 18.77 ± 1.03 mg/g, 잎 28.73 ± 0.92 mg/g이었다. 이러한 수치는 총 플라보노이드가 페놀성 화합물의 일종이므로 총 폴리페놀 함량과 비슷한 경향을 보인 것으로 보인다. 페놀성 물질 함량이 높을수록 기능성 물질로 유용하게 활용할 수 있다는 점에서 비파 부위별 에탄올 추출물에 함유되어 있는 총 폴리페놀과 플라보노이드는 항산화 활성을 증가시켜 항산화계에 영향을 미칠 것으로 사료된다.
항산화효과와 같은 생리활성을 나타낼 수 있는 성분으로는 항산화 비타민 및 플라보노이드를 비롯한 폴리페놀류를 들 수 있는데, 페놀성 화합물은 여러 식용 및 약용식물류에 널리 분포되어 있다. 페놀성 화합물은 수용성으로 플라보노이드류가 대부분이며, 그 외 단순한 phenol류, phenolic acid류, phenyl propanoid류, phenol성 quinone류 등이 있다(Huang et al. 1992). 페놀성 화합물은 식물의 대표적 2차 대사산물로 hydroxyl기를 가지는 방향족 화합물이여서 다양한 생리활성에 기여한다. 페놀성 화합물의 종류나 함량에 따라서 항산화 활성에 미치는 영향은 다른 것으로 알려져 있다(Manach et al. 2005; Ryu et al. 2006). Dural & Shetty(2001)와 Park(2005)도 페놀성 화합물은 종류와 분자량이 다르며, 특히 phenolic hydroxyl이 단백질처럼 거대 분자와 결합하여 항산화, 항균, 항암 등의 생리활성 기능을 나타내는 것으로 보고하였다.
3. DPPH radical 소거능
DPPH는 식물 추출물의 항산화 활성을 간단히 측정할 수 있는 물질로, 비교적 안정한 free radical로 비타민 C, 비타민 E, 방향족 아민류, polyhydroxy 방향족 화합물 등에 의해 환원되어 짙은 자색으로 변하는 원리를 이용하여 측정하는 것이다(Yoo et al. 2004). Table 2에서와 같이 비파 부위별 에탄올 추출물의 DPPH radical 소거능은 비파 씨, 과육 및 잎 추출물 모두 농도에 비례하여 증가하였으며, 50% radical 소거능 농도인 IC50값은 구한 결과는 비파 씨 추출물은 0.049 mg/mL, 비파 과육 추출물은 0.063 mg/mL, 비파 잎 추출물은 0.042 mg/mL로 비파 씨와 잎이 과육에 비하여 항산화 활성이 좋은 것으로 나타났다. Park et al.(2008)도 비파 부위별 에탄올 추출물의 DPPH radical 소거능을 측정한 결과, 비파 씨와 과육에 비하여 잎이 가장 높았다고 보고하여 본 연구결과와 유사한 경향이었다. 그러나 비파 부위별 추출물의 DPPH radical 소거능은 양성대조군으로 사용한 합성항산화제인 BHA 및 BHT에 비하여 낮은 것으로 나타났다. 장미과에 속하는 살구 씨 추출물의 IC50 48.3 μg/mL, 살구 과육 추출물은 43.9 μg/mL 수준의 유리 라디칼 소거능이 나타났으며(Yoo et al. 2007), 두 종류의 자두 과육 추출물의 IC50는 33.4-34.3 μg/mL 범위로 나타났다고 보고(Jung et al. 2005)하여 비파 과육 추출물과 비슷한 항산화 활성이 나타났다.
4. 항산화지수
항산화지수는 공기에 의한 지질산패도를 측정하는 것으로 Rancimat을 사용하여 측정하는데, 유지의 산화과정 중 유도기간 마지막에 저분자 휘발성 카보닐산이 유리되는 양을 측정하는 원리를 이용하여 항산화능을 측정한다(Cha & Choi 1990). 비파 각 부위별 에탄올 추출물의 유지 산화 억제효과는 Table 3과 같다. 양성대조군인 BHT와 BHA는 유지 산화 유도기간이 11.09 ± 0.07 및 11.21 ± 0.06 시간으로 가장 길게 나타났으며, 비파 씨 추출물이 10.04 ± 0.05 시간, 비파 과육 추출물이 7.58 ± 0.03 시간, 비파 잎 추출물이 10.99 ± 0.04 시간으로 비파 씨와 잎 에탄올 추출물의 결과는 양성대조군과 유의차가 없이 높은 항산화능을 보였다. 또한 과육 추출물도 시료를 미첨가한 음성대조군보다 유지 산화 유도기간 길게 나타나 비파의 모든 부위별 에탄올 추출물이 유지 산화 억제효과가 있는 것으로 확인되었다.
5. 간암세포 증식 억제효과
비파 부위별(씨, 과육, 잎) 에탄올 추출물의 간암세포 성장 억제효과를 측정하기 위해 간암세포(H460)주를 대상으로 MTT assay를 이용한 세포생존율을 측정하였다. 씨, 과육 및 잎 추출물 25, 50, 100, 200, 400, 800 μg/mL을 농도별로 처치하여 측정한 결과는 Fig. 1과 같다. 비파 부위별로 살펴보면, 비파 씨 에탄올 추출물의 경우 농도가 증가할수록 간암세포의 생존율이 농도 의존적으로 저하되었으며, 400 μg/mL부터 유의하게 저하되기 시작하여 800 μg/mL의 농도일 때 대조군에 비하여 38.55%로 저하된 것으로 나타났다. 비파 잎 에탄올 추출물의 경우 간암세포의 생존율에 크게 영향을 미치지 않았으나 고농도로 처리하였을 경우 다소 낮아지는 경향을 보였다. 비파 과육 에탄올 추출물의 경우에는 400 μg/mL부터 간암세포 증식 억제효과가 나타났으나, 비파 씨 에탄올 추출물에 비해서 효과가 덜 나타나는 경향을 보였다. 같은 농도에서 살펴보았을 경우, 비파 부위별 추출물 중 비파 씨 에탄올 추출물이 비파 잎과 비파 과육 추출물에 비하여 간암세포 증식 억제효과가 더 큰 것으로 확인되었다. 같은 장미과에 속하는 살구 과육 에탄올 추출물의 경우는 3 mg/mL부터 간암세포 증식 억제효과가 뚜렷하게 나타났는데(Yoo et al. 2007) 이는 처리 농도가 본 연구에서 실시한 농도보다 훨씬 높았기 때문이다. Rho & Oh(2002)는 오미자 추출물의 간암세포(SNU-398) 생존율이 48시간 처치 시 100, 200, 400, 800, 1,600 μg/mL의 농도에서 농도 의존적으로 저하되었고, 800 μg/mL 농도에서 암세포 생존률이 38.1%로 나타나, 본 연구의 비파 씨 에탄올 추출물 800 μg/mL 농도와 비슷한 간암세포 생존율을 나타내었다.
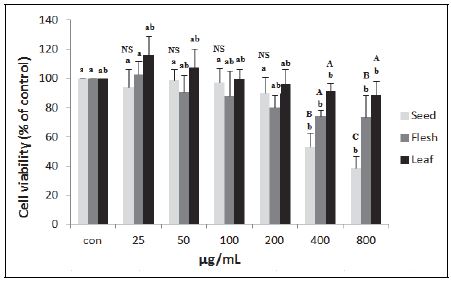
H460 cell viabilities of loquat seed, flesh, and leaf ethanol extractsValues are the mean ± SE (n=3). a,bValues with different superscript letters in the same part are significantly different(p<0.05) based on Tukey’s test. A,BValues with different superscript letters in the same concentration are significantly different(p<0.05) based on Tukey’s test.NS: No significances among groups in the same concentration.
6. 위암세포 증식 억제효과
비파 부위별(씨, 과육, 잎) 추출물의 위암세포 성장 억제효과를 알아보기 위하여 위암세포주(AGS)를 대상으로 MTT assay를 이용한 세포생존율을 측정하였다. 씨, 과육 및 잎 추출물 25, 50, 100, 200, 400, 800 μg/mL을 농도별로 처치하여 측정한 결과는 Fig. 2와 같다. 비파 부위별로 살펴보면, 비파 씨 에탄올 추출물로 처리하였을 경우 25 μg/mL부터 농도가 증가할수록 유의하게 위암세포의 생존율이 저하되었으며, 400 μg/mL에서 대조군에 비하여 84.16% 증식 억제효과가 나타났다. 비파 과육 에탄올 추출물은 위암세포의 생존율이 대조군과 비교하였을 때 유의적인 차이가 없었다. 비파 잎 에탄올 추출물은 400 μg/mL부터 유의하게 영향을 미쳐 고농도로 처리 했을 경우에만 위암세포 증식 억제효과가 있는 것으로 나타났다. 같은 농도에서 위암세포 성장 억제효과를 살펴본 결과는 비파 씨 에탄올 추출물이 가장 우수하였으며, 다음으로 비파 잎 추출물, 비파 과육 추출물 순으로 나타났다. 같은 장미과에 속하는 자두의 경우도 위암세포 증식 억제효과가 나타났으며(Kim et al. 2013), 살구 씨와 살구 과육 에탄올 추출물의 경우는 모두 위암세포 증식 억제효과가 본 연구보다 뚜렷하게 나타났는데 이는 본 연구보다도 고농도(4 mg/mL)로 처치한 결과로 보여진다(Yoo et al., 2007). Whang et al.(1996)의 비파 추출물의 항암성 검증 연구에서도 간암세포주(HepG2)와 위암세포주(KATOIII)에 비파 분획물들이 특이적으로 강하게 항암반응을 보였고, 다른 정상세포들에는 별다른 영향을 주지 않았다는 연구도 있었다.
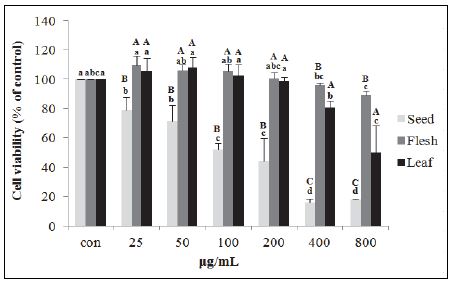
AGS cell viabilities of loquat seed, flesh and leaf ethanol extractsValues are the means ± SE (n=3). a,bValues with different superscript letters in the same part are significantly different(p<0.05) based on Tukey’s test. A,BValues with different superscript letters in the same concentration are significantly different(p<0.05) based on Tukey’s test.
7. 폐암세포 증식 억제효과
비파 부위별(씨, 과육, 잎) 추출물의 폐암세포 성장 억제효과를 측정하기 위해 폐암세포주(A549)를 대상으로 MTT assay를 이용한 세포 생존율을 측정하였다. 씨, 과육 및 잎 추출물 25, 50, 100, 200, 400, 800 μg/mL을 농도별로 처치하여 측정한 결과는 Fig. 3과 같다. 비파 부위별로 살펴보면, 폐암세포의 경우 비파 씨 에탄올 추출물로 처리하였을 경우 25 μg/mL부터 추출물의 농도가 증가됨에 따라 유의하게 생존율이 저하되었다. 800 μg/mL 농도에서는 대조군에 비하여 17.71%로 폐암세포 증식 억제활성이 높은 것으로 나타났다. 비파 과육 에탄올 추출물의 경우는 800 μg/mL의 고농도로 처리하였을 경우에만 세포 생존율에 영향을 미치는 것으로 나타났다. 그러나 Kim et al.(2013)의 연구에서 자두 추출물의 경우 250 μg/mL 농도부터 폐암세포 증식 억제효과가 있는 것으로 나타나 비파 과육에 비하여 자두가 폐암세포 증식 억제효과가 큰 것으로 보인다. 비파 잎 에탄올 추출물의 경우도 800 μg/mL에서 폐암세포 생존율이 유의적으로 낮아지므로, 고농도에서만 효과가 있는 것으로 나타났다. 같은 농도에서 폐암세포 성장 억제효과를 살펴 본 결과, 비파 씨 에탄올 추출물이 암세포 성장 억제효과가 가장 우수하였으며, 다음으로 비파 잎 추출물, 비파 과육 추출물 순으로 나타났다.
이상의 결과 비파 씨 추출물이 간암, 위암 및 폐암세포의 암세포 증식 억제효과가 가장 우수한 것으로 확인되었다. 비파 씨 에탄올 추출물의 암세포 증식 억제효과는 항암활성을 나타내는 생리활성 물질이 관여하는 것으로 보여지며, 추후 암세포 증식 억제효과가 있는 생리활성 물질들에 관한 연구가 필요하며, 암 예방식품으로의 활용 가능성이 있을 것으로 기대된다.
IV. 요약
본 연구는 비파 씨, 과육 및 잎의 부위별 에탄올 추출물이 항산화효과 및 암세포 증식 억제효과를 알아보고자 실시하였다. 총 폴리페놀과 총 플라보노이드 함량은 비파 잎 에탄올 추출물에서 가장 높게 나타났으며, 다음으로는 비파 씨, 과육 추출물 순으로 나타났다. 비파 씨, 과육 및 잎 추출물의 DPPH radical 소거능의 IC50값은 0.049, 0.063, 0.042 mg/mL로 비파 씨와 잎이 과육에 비하여 항산화 활성이 좋은 것으로 나타났다. Rancimat에 의한 항산화능 측정 결과도 비파 씨와 잎 추출물이 높게 나타났다. 비파 부위별 추출물의 암세포 성장억제 효과를 측정한 결과, 비파 씨 에탄올 추출물은 위암과 폐암세포는 농도 의존적으로 저하시켰으나, 간암세포의 경우는 400 μg/mL부터 유의하게 저하시켰다. 비파 잎과 과육 에탄올 추출물은 고농도에서 암세포 증식 억제효과가 나타났다. 이상의 결과 비파 부위별 에탄올 추출물의 항산화 및 암세포 증식 억제효과는 모든 부위에서 나타났으며, 특히 비파 씨 추출물이 가장 좋은 결과를 보였다.
References
-
Banno, N., Akihisa, T., Tokuda, H., Yasukawa, K., Taguchi, Y., Akazawa, H., Ukiya, M., Kimura, Y., Suzuki, T., Nishino, H., (2005), Anti-inflammatory and antitumor promoting effect of the triterpene acid from the leaves of Eriobotrya japonica, Biol Pharm Bull, 28(10), p1995-1999.
[https://doi.org/10.1248/bpb.28.1995]

-
Blois, MS., (1958), Antioxidant determinations by the use of a stable free radical, Nature, 181(9), p1199-1200.
[https://doi.org/10.1038/1811199a0]

- Cha, GS., Choi, CU., (1990), Determination of oxidation stability of perilla oil by the Rancimat method, Korean J Food Sci Technol, 22(1), p61-65.
- Chae, SK., Kang, GS., Ma, SJ., Bang, KW., Oh, MW., Oh, SH., (2002), Standard food analysis, Paju, Jigu-Moonwhasa, p381-382.
-
Chen, J., Li, WL., Wu, JL., Ren, BR., Zhang, HQ., (2008), Hypoglycemic effects of a sesquiterpene glycoside isolated from leaves of loquat(Eriobotrya japonica Thunb. Lindl.), Phytomedicine, 15(1-2), p98-102.
[https://doi.org/10.1016/j.phymed.2006.12.014]

-
De Tommasi, N., De Simone, F., Pizza, C., Mahmood, N., Moore, PS., Conti, C., Orsi, N., Stein, ML., (1992), Constituents of Eriobotrya japonica. A study of their antiviral properties, J Nat Prod, 55(8), p1067-1073.
[https://doi.org/10.1021/np50086a006]

- Dural, B., Shetty, K., (2001), The stimulation of phenolics and antioxidant activity in pea elicited by genetically transformed anise root extract, J Food Biochem, 25(5), p361-377.
- Folin, O., Denis, W., (1912), On phosphotungastic phosphomolybdic compounds as color regents, J Biol Chem, 12(2), p239-243.
- Frei, B., (1994), Natural antioxidants in human health and disease, New York, Academic Press, p25-55.
- Huang, MT., Ho, CT., Lee, CY., (1992), Phenolic compounds in food. In phenolic compounds in food and their effects on health Ⅱ, New York, Maple Press, p2-7.
-
Huang, Y., Li, J., Wang, R., Wu, Q., Li, YH., Yu, SC., Cheng, WM., Wang, YY., (2007), Effect of triterpene acids of Eriobotrya japonica(Thunb. Lindl.) leaf on inflammatory cytokine and mediator induction from alveolar macrophages of chronic bronchitic rats, Inflamm Res, 56(2), p76-82.
[https://doi.org/10.1007/s00011-006-5185-0]

-
Ishiyama, M., Tominaga, H., Shiga, M., Sasamoto, K., Ohkura, Y., Ueno, K., (1996), A combined assay of cell viability and in vitro cytotoxicity with a highly water-soluble tetrazolium salt, neutral red and crystal violet, Biol Pharm Bull, 19(11), p1518-1520.
[https://doi.org/10.1248/bpb.19.1518]

- Ito, H., Kobayashi, E., Li, SH., Hatano, T., Sugita, D., Kubo, N., Shimura, S., Itoh, Y., Tokuda, H., Nishino, H., Yoshida, T., (2002), Antitumor activity of compounds isolated from leaves of Eriobotrya japonica, J Agric Food Chem, 50(8), p2400-2403.
- Joo, KJ., Kim, JJ., (2002), Oxidative stability and flavor compounds of sesame oils blended with wegetable oils, Korean J Food Sci Technol, 34, p499-502.
- Jung, HA., Park, JC., Chung, HY., Kim, J., Choi, JS., (1994), Antioxidant flavonoids and chlorogenic acid from the leaves of Eriobotrya japonica, Arch Pharm Res, 22(2), p213-218.
- Jung, GT., Ju, IO., Choi, DG., Jeong, JS., Ryu, J., Ko, BR., Choi, JS., Choi, YG., (2005), Chemical characteristics and physiological activities of Plum(Oishiwase and Formosa), Korean J Food Sci Technol, 37(5), p816-821.
- Jung, HA., Park, JC., Chung, HY., Kim, J., Choi, JS., (1999), Antioxidant flavonoids and chlorogenic acid from the leaves of Eriobotrya japonica, Arch Pharm Res, 22(2), p213-218.
- Kim, SN., Kim, SY., Kim, JB., Park, HJ., Cho, YS., (2013), Effect of extracts from oriental plum(Formosa, Oishiwase, Soldam) on LPS-stimulated raw 264.7 cells, J East Asian Soc Dietary Life, 23(2), p197-202.
-
Koba, K., Matsuoka, A., Osada, K., Huang, YS., (2007), Effect of loquat (Eriobotrya japonica) extracts on LDL oxidation, Food Chem, 104(1), p308-316.
[https://doi.org/10.1016/j.foodchem.2006.11.043]

-
Lee, KI., Kim, SM., (2009), Antioxidative and antimicrobial activities of Eriobotrya japonica Lindl. leaf extracts, J Korean Soc Food Sci Nutr, 38(3), p267-273.
[https://doi.org/10.3746/jkfn.2009.38.3.267]

- Lee, MH., Son, YK., Han, YN., (2004), Tissue factor inhibitory sesquiterpene glycoside from Eriobotry japonica, Arch Pharm Res, 27(6), p619-623.
- Manach, C., Williamson, G., Morand, C., Scalbert, A., Remesy, C., (2005), Bioavailability and bioefficacy of polyphenols in humans, Am J Clin Nutr, 81(1), p230S-242S.
-
Miyata, H., Yano, M., Yasuda, T., Hamano, R., Yamasaki, M., Hou, E., Motoori, M., Shiraishi, O., Tanaka, K., Mori, M., Doki, Y., (2012), Randomized study of clinical effect of enteral nutrition support during neoadjuvant chemotherapy on chemotherapy-related toxicity in patients with esophageal cancer, Clin Nutr, 31(3), p330-336.
[https://doi.org/10.1016/j.clnu.2011.11.002]

-
Moertel, CG., Fleming, TR., Rubin, J., Kvols, LK., Sarna, G., Koch, R., Currie, VE., Young, CW., Jones, SE., Davignon, JP., (1982), A clinical trial of amygdalin (Laetrile) in the treatment of human cancer, N Engl J Med, 306(4), p201-206.
[https://doi.org/10.1056/NEJM198201283060403]

- Nazato, N., Matsumoto, K., Uemitsu, N., (1994), Triterpenes from leaves of Eriobotrya japonica, Nat Med, 48(2), p336-339.
- Park, CS., (2005), Component and quality characteristics of powdered green tea cultivated in Hwagae area, Korean J Food Preserv, 12(1), p36-42.
- Park, SH., Lim, HY., Han, JH., (2003), A study of medicinal herbs for functional food application -(Ⅰ) Nutritional composition and scolpectin analysis of Artemisia capilaries-, J East Asian Soc Dietary Life, 13(6), p552-560.
- Park, YS., Park, YJ., Kim, HJ., Im, MH., Lee, MK., Kim, YM., Cho, JY., Heo, BG., (2008), Physiological activity of ethanol extract from the different plant parts of loquat(Eriobotrya japonica Lindl.), Korean J Hort Sci Technol, 26(1), p75-80.
- Rho, SN., Oh, HS., (2002), Effect of omija (Schizandra chinensis Baillon.) extracts on the growth of liver cancer cell line SNU-398, Korean J Nutr, 35(2), p201-206.
- Ryu, SW., Jin, CW., Lee, HS., Lee, JY., Sapkota, K., Lee, BG., Yu, CY., Lee, MK., Kim, MJ., Cho, DH., (2006), Changes in total polyphenol, total flavonoid contents and antioxidant activities of Hibiscus cannabinus L, Korean J Medicinal Crop Sci, 14(5), p307-310.
- Shen, DW., Dardarelli, C., Hwang, J., Cornwell, M., Richert, N., Ishii, S., Pastan, I., Gottesman, MM., (1986), Multiple drug-resistant human KB carcinoma cells independently selected for high-level resistance to colchicine, adriamycin, or vinblastine show changes in expression of specific proteins, J Bio Chem, 261(17), p7762-7770.
-
Sohal, RS., Sohal, BH., Brunk, UT., (1990), Relationship between antioxidant defenses and longevity in different mammalian species, Mech Aging Dev, 53(3), p217-227.
[https://doi.org/10.1016/0047-6374(90)90040-M]

- Son, GM., Bae, SM., Chung, JY., Shin, DJ., Sung, TS., (2005), Antioxidative effect on the green tea and puer tea extracts, Korean J Food & Nutr, 18(3), p219-224.
- Sözmen, EY., Tanyakin, T., Onat, T., Kufay, F., Erlacin, S., (1994), Ethanol induced oxidative stress and membrane injury in rat erythrocytes, Eur J Clin Chem Clin Biochem, 32(10), p741-744.
- National Statistical Office Republic of Korea, (2014), Annual report on the cause of death statistics, Seoul, Statistics Korea.
-
Taniguchi, S., Imayoshi, Y., Kobayashi, E., Takamatsu, Y., Ito, H., Hatano, T., Sakagami, H., Tokuda, H., Nishino, H., Sugita, D., Shimura, S., Yoshida, T., (2002), Production of bioactive triterpenes by Eriobotrya japonica calli, Phytochem, 59(3), p315-23.
[https://doi.org/10.1016/S0031-9422(01)00455-1]

- Whang, TE., Lim, HO., Lee, JW., (1996), Anticancer effect of Eriobotrya japonica Lindl by specificity test with several cancer cell line, Korean J Medicinal Crop Sci, 4(4), p314-320.
- Yang, YH., Kwon, SJ., Kim, CI., (2001), The nutritional status of the patients with cancer during the chemotherapies, J Korean Acad Nurs, 31(6), p978-987.
- Yoo, JH., Cha, JY., Jeong, YK., Chung, KT., Cho, YS., (2004), Antioxidative effect of pine (Pinus densiflora) needle extracts, J Life Sci, 14(5), p863-867.
- Yoo, SJ., Kim, SH., Jun, MS., Oh, HT., Choi, HJ., Ham, SS., (2007), Antioxidative, antimutagenic and cytotoxic effects of Prunus armenciaca extracts, Korean J Food Preserv, 14(2), p220-225.
- Yook, CS., (1989), Coloured medicinal plants of Korea, Seoul, Academic Publishing Co, p261.

