
비파 부위별 추출물이 3T3-L1 세포와 돼지 지방전구세포의 분화에 미치는 효과
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License ( http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The current study was undertaken to determine the effects of the ethanol extracts of loquat( Eriobotrya japonica Lindl.) seeds, flesh or leaves on the differentiation of 3T3-L1 cells and male pig preadipocytes. The cell number was measured with the MTT assay after trypsin digestion. The cell differentiation was determined by measuring the glycerol-3-phosphate dehydrogenase(GPDH) activity and triglyceride(TG) content. No cytotoxicity was observed from the loquat flesh and leaf ethanol extracts at concentrations of 5, 10, 25, 50, 100 or 200 μg/mL in 3T3-L1 cells and pig preadipocytes. However, the cell viability of neither cell line were affected by up 50 μg/mL of loquat seed ethanol extract. Treatment with the loquat seed and leaf ethanol extracts significantly suppressed the terminal differentiation of both cell lines in a dose-dependent manner, as confirmed by the decrease in the glycerol-3-phosphate dehydrogenase(GPDH) activity and TG content. Treatment with the loquat seed and leaf ethanol extracts inhibited the GPDH activity and reduced the TG content of both cell types more effectively than that with the loquat flesh ethanol extract. The most potent anti-adipogenic effect was obtained in the case of the ethanol extract of loquat seeds.
Keywords:
loquat, 3T3-L1 cells, pig preadipocytes, GPDH activity, triglyceride contentI. 서론
비만은 에너지의 계속된 과잉 공급으로 일어나는 현상으로 과잉의 에너지는 지방산을 거쳐 중성지방 형태로 지방세포에 축적되어, 지방세포의 숫자나 크기가 증가하면서 과도한 지방축적이 일어난다(Chen & Farese 2005). 즉 비만은 지방전구세포(preadipocytes)로부터 증식과정을 거쳐서 분화를 통해 지방세포(adipocytes)가 과잉 생성되고, 이들 지방세포에 중성지방이 축적되는 일련의 adipogenesis 과정을 거치면서 유발된다(Roncari et al. 1981; Gesta et al., 2007). 지방세포는 배양 중에 다양한 생리활성물질을 함유하고 있는 천연물로 처리하게 되면 증식과 분화에 영향을 미치는 것으로 나타났다(Choi et al. 2010; Song et al. 2013: Jeong et al. 2015). 항비만 기능성 소재개발 연구는 대부분 지방세포의 분화과정을 억제하거나 지방분해를 촉진하는 소재를 탐색하는 방향으로 진행되고 있다( Kwon 2016; Song & Choi 2016). 최근에는 천연물에 함유된 phytochemical, 색소, 효소, 식이섬유소 등이 체지방 축적을 억제하거나, 분해를 증가시켜 항비만 효과가 있다는 연구(Choi et al. 2010; Song et al. 2013: Jeong et al. 2015)와 더불어 이들을 이용한 건강기능성식품 개발이 다양하게 이루어지고 있다.
비파나무(Eriobotrya japonica Lindl.)는 장미과(Resaceae)에 속하는 상록교목으로 비파 씨, 열매 및 잎은 식용 및 한약재로 예로부터 사용되었다. 비파나무 잎은 비파엽이라고 불리며, 냄새가 거의 없고 약간 쓴맛이 나는 것이 특징으로 말려서 차나 약으로 사용하였으며, 폐의 열과 기침을 멈추고 가래를 없애주는 작용과 위의 열을 내려주고 구토, 딸국질, 입마름에 효능이 있다고 알려져 있다(Roh et al. 2013). 비파 잎의 주요 성분은 sesquiterpene 배당체로 ferulic acid, nerolidol 등을 함유하고 있으며(Lee et al. 2004), triterpene 계열의 화합물로는 ursolic acid, oleanolic acid, maslinic acid, tormentic acid, hyptadienic acid 등을 함유하고 있는 것으로 보고(Shimizu et al. 1996; Taniguchi et al. 2002)되었다. 이와 같이 다양한 생리활성 성분으로 인해 비파 잎은 항당뇨( Shimizu et al. 1986; Chen et al. 2008), 항산화(Jung et al. 1999), 항염증(Huang et al. 2007; Matalka et al. 2007), 항돌연변이 및 항암활성(Ito et al. 2002) 효능이 있는 것으로 보고되었다. 비파 씨는 열매 속에 둥근 형태로 갈색을 띄고 있으며( Yook 1986; Cho et al. 1991), polyphenol 화합물 군을 함유하고 있어 산화적 스트레스를 감소시키는 항산화효과(Kim et al. 2006)와 tyrosinase 저해 활성효과가 있는 것으로 보고(Kim et al. 2009)되었다. 비파는 황금색을 띄고 있으며 숙성과일은 당분이 많고 유기산이 적게 함유하고 있어 다른 과실류에 비하여 당산비가 비교적 높고 단맛이 강한 것이 특징이다. 비파열매는 다양한 종류의 carotenoid 색소(De Faria et al. 2009), polyphenol, flavonoid 및 비타민 C도 함유하고 있어 항산화효과(Ercisli et al. 2002)가 있는 것으로 보고되었다. 이와 같이 비파는 부위별로 각각 생리활성 성분이 다량 함유되어 있어서 새로운 기능성 소재로의 개발 잠재성이 높으나 비파 부위에 따른 항비만효능에 대한 연구는 아직 미흡한 실정이다.
비파가 지방세포의 분화에 미치는 효과를 알아보기 위하여 두 종류의 지방전구세포를 시용하였다. 3T3-L1 세포는 마우스 섬유아세포(fibroblast)인 3T3 세포에서 유래된 세포주로서, 생물학적 특성과 적절한 배양 조건으로 지방세포로 분화하는 특징을 갖고 있어 지방세포의 대사과정은 물론 지방축적과 지방세포의 분화과정을 연구하는 모델로 많이 사용되고 있다(Rosen & MacDougald 2006). 돼지는 유전적(Lunney 2007), 해부학적( Pracy et al. 1998) 및 생리학적(Mei & Xu 2003) 특징이 사람과 비슷하기 때문에 사람을 대처 할 실험동물로 많이 연구되고 있다. 최근 돼지를 이용한 대사증후군, 암, 퇴행성질환 등 다양한 연구들이 수행되고 있다(Litten-Brown et al. 2010). 갓 태어난 돼지로부터 분리한 지방전구세포인 primary cell은 3T3-L1 세포와 다르게 그 결과를 사람에게 바로 적용할 가능성이 많기 때문에 사용하였다.
이에 본 연구는 약리효과와 생리활성 물질을 다량으로 함유하고 있는 것으로 알려진 비파 씨, 과육 및 잎 에탄올 추출물이 3T3-L1 세포와 돼지 지방전구세포의 분화에 미치는 영향을 알아보고자 실시하였다.
II. 연구방법
1. 실험재료
본 실험에 사용된 비파(Eriobotrya japonica Lindl.)의 열매와 잎은 전라남도 목포시 전복마을(Natural food-http://www.0808.or.kr)에서 구입하여 열매는 과육과 씨로 분리하여 사용하였다. 비파 씨, 과육 및 잎은 수세, 정선 및 탈수과정을 거쳐 -70℃ deep freezer(MDF-U52V, Sanyo, Osaka, Japan)에서 냉동시킨 후 -70℃ 동결건조기(ED 8512, Ilshin, Yangju, Korea)에 건조하여 분쇄기로 마쇄 후 -70℃에서 냉동보관하면서 시료로 사용하였다.
2. 비파 씨, 과육 및 잎의 에탄올 추출
동결건조 시킨 비파 씨, 과육 및 잎은 각각 100 g당 80% ethanol 1500 mL을 첨가하여 환류냉각관이 부착된 65℃ Heating mantle(Mtops ms-265, Seoul, Korea)에서 3시간 씩 3회에 걸쳐 추출하였다. 추출물은 Whatman filter paper(No.2, GE Healthcare, Buckinghamshire, UK)로 여과한 후 여액은 40℃ 수욕 상에서 rotary vacuum evaporator(EYELA VACUUM NVC-1100, Tokyo, Japan)를 이용하여 용매를 제거한 다음 감압•농축하여 비파 씨, 과육 및 잎의 추출 수율을 구했다. 그 후 시료의 산화를 방지하기 위해 -70℃에 냉동 보관하였다. 각 시험 항목에 대한 시료의 분석은 3회 반복 실시하였다.
3. 3T3-L1 세포배양 및 분화유도
3T3-L1 지방전구세포의 배양은 Chen et al.(1997)의 방법을 약간 변형하여 실시하였다. 10% FBS가 함유된 DMEM 배지를 이용하여 37℃의 5% CO2 incubator(MAC-18AIC, SANYO Electric Co., Ltd, Sakata, Japan)에서 배양하였다. 3T3-L1 전 지방세포는 2일마다 신선한 배지로 교환해 주었으며, 세포 밀도가 70~80%에 이르면 0.5% 10 × trypsin-EDTA를 처리하여 계대 배양하였다. 지방세포로 분화를 유도하기 위해 3T3-L1 세포를 12-well cell culture plate에 1 × 105 cells/well 농도로 분주하고, 세포가 confluence 상태가 되면 배양액을 분화 유도배지인 10% FBS, 1% P/S, 1 µM dexamethasone(DEXA, Sigma-Aldrich, USA), 0.5 nmol/mL 3-isobutyl-1-methylxanthin(IBMX, Sigma-Aldrich, MO, USA) 및 10 μg/mL insulin이 함유된 DMEM 배지로 교환하여 2일간 분화를 유도하였다. 그 후 2일마다 10% FBS-DMEM 배지로 교체하였다. 대조군은 dimethyl sulfoxide(DMSO)를 처리하였으며, 시료의 처리는 분화유도 배지 첨가 시점부터 같이 처리하였다. 분화유도 후 2~4일차에 배지를 시료 추출물, 10% FBS, 1% P/S, 10 μg/mL insulin을 포함한 DMEM으로 교환하였다. 분화유도 6일차부터는 2일에 한 번씩 10% FBS, 1% P/S를 포함한 DMEM으로 교환하며 분화시켰다. 세포의 분화 정도에 따라 모든 실험은 분화 시작 후 8~10일 사이에 실시하였다.
4. 돼지 지방전구세포 분리, 세포배양 및 분화유도
돼지 지방전구세포(preadipocytes)는 신생 자돈의 등지방 조직에서 분리해서 배양을 하였다. 생후 1~2일령 된 신생 자돈(체중 1.6~1.7 kg)을 CO2 gas를 이용하여 질식사 시킨 후 30% 요오드로 세척한 다음 70% 알코올로 세척하여 등 쪽 첫 번째 갈비부근에서 등지방 조직을 8~10 g 정도 떼어냈다. 조직을 잘게 세절한 후에 collagenase와 함께 shaking water bath에서 40분 동안 배양한 후 250 μL nylon screen으로 여과하였다. 여과 후 1,500 ×g로 10분 동안 원심분리해서 지방전구세포가 들어있는 침전물을 Kreb’s ringer bicarbonate(KRB) buffer에 녹여 다시 1,796 × g로 10분간 원심분리 후 75 μL nylon screen으로 여과하여 지방전구세포를 수집하였다. 돼지 지방전구세포의 배양은 Suryawan et al.(1997)의 방법을 변형하여 Moon & Chung(2004)의 방법으로 실시하였다. 수집한 지방전구세포 수를 hematocytometer를 이용하여 조사한 후, 10% FBS를 함유한 DMEM/F-12 배지를 이용하여 6-well 배양접시에 1.0 × 106 cell/well을 접종하고 37℃의 5% CO2 incubator에서 배양하였다. 접종한 다음날 적혈구와 같은 이물질 등을 제거하기 위해 FBS를 함유하지 않은 DMEM/F-12배지로 2회 세척하였다(0일). 세척한 날로부터 분화 측정 일(6일)까지 10% FBS와 insulin(600 μg/mL), transferrin(1 μg/mL) 및 hydrocortisone(500 μg/mL)을 함유한 DMEM/F-12를 사용하여 배양하였고, 배지는 2일마다 교체하였다.
5. 지방전구세포 독성 측정
비파 부위별 에탄올 추출물이 독성을 나타내는지를 측정하기 위하여 3-(4,5-dimethyl thiazol-2-yl)-2,5-diphenyl tetrazoliumbromide(MTT) 분석을 통해 측정하였다(Ishiyanma et al. 1996). 3T3-L1 지방전구세포는 1 × 104 cells/well의 농도로 96 well plate에 100 μg 씩 분주한 후 37℃, 5% CO2 incubator에서 24시간 배양하여 일정 농도(0, 5, 10, 25, 50, 100, 200 μg/mL)로 희석된 추출물을 첨가한 후 다시 24시간 배양하였다. 배양 완료 후 5 μg/mL 농도의 MTT 시약을 100 μg씩 분주한 다음 37℃, 5% CO2 incubator에서 4시간 배양하였다. 배지를 제거하고 DMSO 100 μg를 가하여 생성된 formazan을 녹인 후 ELISA microplate reader(Model 680, Biorad Laboratories Inc., Hercules, CA, USA)를 이용하여 540 ㎚에서 흡광도를 측정하였다.
6. 지방세포의 GPDH 활성 측정
지방전구세포의 성숙세포로의 분화는 glycerol-3-phosphate dehydrogenase(GPDH)의 활성도를 측정함으로써 규명하였는데 Wise & Green(1979)의 방법을 변형하여 사용하였다. 세포배양이 끝난 후 6배양액을 완전히 제거하고 phosphate buffer saline(PBS)로 남아있는 배양액을 씻어낸 다음 homogenizing buffer(pH 7.4; 0.25 M sucrose, 5 mM Tris base, 1 mM EDTA, 1 mM dithiothreitol) 260 μL를 이용하여 세포를 scrapping하여 1.5 mL eppendorf tube에 수집해 가루 얼음 위에 꽂아두었다. 세포는 sonication시킨 후, 2,580 ×g로 4℃에서 10분 동안 원심분리시켰다. 상층액 200 μL를 취해서 새로운 eppendorf tube에 옮긴 후 assay buffer(100 mM triethanolamine, 2.5 mM EDTA, 0.1 mM β-mercaptoethanol, 0.176 NADH) 800 μL와 기질 0.16 μM dihydroxyacetone phosphate lithium solution 100 μL, 상층액 150 μL를 cuvette에 넣어 잘 혼합한 후 spectrophotometer(Shimadzu UV-Visible Spectrophotometer, UV-1601, Tokyo, Japan)를 이용하여 340 nm에서 흡광도를 측정하여 GPDH 활성을 측정하였다.
7. 지방세포의 중성지방 함량 측정
지방전구세포의 분화 유도 중에 생성된 중성지방 함량은 효소적인 방법으로 측정하였다. 세포는 PBS를 이용하여 3회 수세한 후, M-PER mammalian cell extraction solution(Pierce, IL, USA) 200 μL를 넣어 삼투압 파쇄방법으로 분쇄하였다. 분쇄한 세포 용액은 microtube에 옮긴 후, 얼음에서 방치하여 세포가 완전하게 용해되도록 하였다. 그 후, 4℃에서 1,792 ×g로 원심 분리하여 상층액을 사용하였다. Glycerol standard(Sigma-Aldrich Co., St. Louis, MO, USA)을 이용하여 농도별로 희석하여 대조군으로 사용하였다. 96 well ELISA plate에 free glycerol reagent 160 μL를 넣고 증류수(blank) 5 μL, 글리세롤 표준 물질, 시료를 각각의 well에 넣었다. 각 well의 용액이 섞이도록 한 후, 37℃에서 5분간 배양하였다. 540 ㎚에서 initial absorbance(IA)를 측정하였다. 각 well에 40 μL의 triglyceride reagent를 넣고 tapping하여 섞어준 후, 37℃에서 5분간 추가적으로 반응시킨 후 540 ㎚에서 final absorbance(FA)를 측정한다. IA와 FA를 이용하여 시료내의 중성지방의 농도를 산출하였다.
8. 통계분석
본 실험에서 얻어진 결과는 SPSS(Statistical Package for Social Science)를 이용하여 통계 분석하였다. 실험군당 평균 ± 표준오차로 표시하였고, 세 집단 이상의 세집단 이상의 유의적 차이 여부는 일원배치 분산분석(one-way analysis of variance)을 한 후 통계적 유의성 검정은 p<0.05 수준에서 Tukey’s test를 이용하여 상호 검정(Post-Hoc test)하였으며, 두 농도 간 통계적 유의성 검정은 Student's t-test를 실시하여 유의성을 검정하였다.
III. 결과 및 고찰
1. 3T3-L1 지방전구세포의 독성에 미치는 효과
비파 씨, 과육 및 잎의 에탄올 추출물이 3T3-L1 지방전구세포의 독성에 미치는 효과를 알아보기 위하여 5, 10, 25, 50, 100, 200 μg/mL 농도로 24시간 전 처치하여 세포 생존률을 측정하였는데 그 결과는 Fig. 1과 같다. 추출물을 처리하지 않은 대조군의 세포 생존율을 100%로 하였을 때, 비파 과육과 잎 추출물은 200 μg/mL의 가장 높은 농도에서 각각 100.3 ± 1.2, 94.6 ± 1.5%의 세포 생존율을 나타나 독성이 나타내지 않았다. 그러나 비파 씨 에탄올 추출물은 100, 200 μg/mL 농도로 처리하였을 경우 대조군에 비하여 각각 84.9 ± 1.4, 76.3 ± 1.2%로 유의하게 세포 생존율이 저하되어 독성을 나타내었다. 비타민 나뭇잎 에탄올 추출물(Jeong et al. 2015), 두메 부추 추출물(Choi & Kim 2014)의 경우도 고농도(100 μg/mL)로 처치하였을 경우 독성을 나타내지 않았다고 보고하였는데, 본 연구에서는 더 높은 농도에서도 독성이 나타나지 않았다. 따라서 비파 과육과 잎 에탄올 추출물은 200 μg/mL의 농도에서도 독성이 나타나지 않아 세포증식에 크게 영향을 미치지 않는 200 μg/mL 이하의 농도인 50, 100, 200 μg/mL로, 비파 씨 추출물은 독성이 나타나지 않은 12.5, 25, 50 μg/mL로 3T3-L1 세포에 처리하여 지방세포 분화에 미치는 영향을 확인하였다.
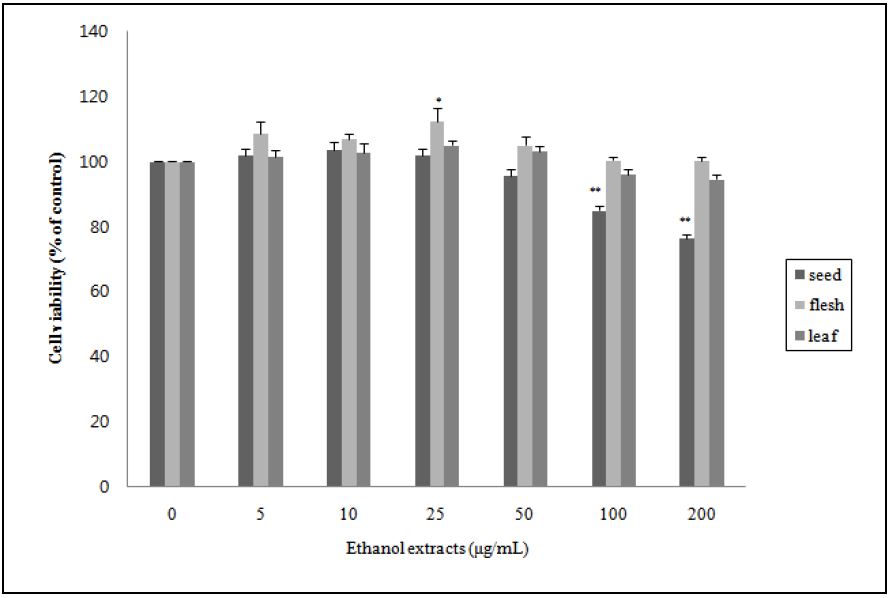
Cytotoxic effects of loquat(Eriobotrya japonica Lindl.) seed, flesh or leaf ethanol extracts in 3T3-L1 preadipocytes. 3T3-L1 pre-adipocytes were treated with various concentrations(5-200 μg/mL) of loquat( Eriobotrya japonica (Thunb.) Lindl.) seed, flesh or leaf ethanol extracts for 24 hours. Then, the cell viability was evaluated by the MTT assay. DMSO was used as a control. Flesh: seedless fruit. Values are mean ± SE(n=3). Significantly different compared to control as determined by Student t-test (*p<0.05, **p<0.01).
2. 3T3-L1 세포의 GPDH 활성에 미치는 효과
Adipogenesis는 지방전구세포가 지방세포로의 분화과정으로 세포의 형태, 여러 종류의 효소의 유전자 발현, 호르몬, 민감성 등 일련의 변화를 동반하게 된다(Zimmermann et al. 2004). Adipogenesis 과정에 관여하는 효소에는 GPDH, acetyl-CoA carboxylase, pyruvate carbxylase 등으로 지방전구세포가 지방세포로 분화될 때 이 효소들의 활성이 증가 또는 감소한다(Jones et al. 1997). 그 중에서도 GPDH는 dehydroxyaceton phosphate를 glycerol-3-phosphate로 전환시키는 효소로, glycerol-3-phosphate는 중성지방 합성에 필요한 물질이기에 지방전구세포가 성숙한 지방세포로 분화됐는지를 구명할 수 있는 효소로 이용되고 있다( Wise & Green 1979). 비파 씨 에탄올 추출물은 12.5, 25, 50 μg/mL 농도로, 비파 과육과 잎 에탄올 추출물은 각각 50, 100, 200 μg/mL 농도로 전처리하여 3T3-L1 지방세포의 GPDH 활성을 측정한 결과는 Fig. 2와 같다. 비파 씨 에탄올 추출물은 대조군에 비하여 3T3-L1 지방세포의 GPDH 활성을 유의하게 농도 의존적으로 저하시켰다(Fig. 2A). 비파 과육 에탄올 추출물은 GPDH 활성에 영향을 미치지 못하였으나(Fig. 2B), 농도가 증가할수록 감소하는 경향이었다. 비파잎 에탄올 추출물의 경우는 50 μg/mL에서 dptjsms eowhrnsrhk 는 대조군과 유의적 차이를 보이지 않았으나 100 μg/mL 및 200 μg/mL에서는 대조군보다 유의적으로 활성이 저하되었다(Fig. 2C). 결과에서 보듯이 비파 씨와 잎 부위는 정도의 차이가 있지만 3T3-L1 지방세포의 GPDH 활성을 저하시켜 지방세포의 분화를 억제시키는 것으로 보여진다. 이러한 결과는 녹차와 녹차씨 압착박 추출물을 3T3-L1 지방세포에 처리하였을 경우 녹차와 녹차씨 압착물 모두 지방세포의 분화를 억제하였으며, 녹차에 비하여 녹차씨 압착물이 지방세포의 분화를 더 많이 억제하였다는 Wee et al.(2015)의 연구 결과와 유사한 경향이었다. Oh et al.(2011)에 의하면 80% 메탄올, 50% 에탄올, 물 등의 용매로 추출한 비파 잎 추출물은 3T3-L1 지방세포의 지방 분화에 관여하는 전사인자인 peroxisome proliferator-activated receptorγ와 CCAAT/enhancer-binding proteinα의 발현과 지방축적을 효과적으로 저해함으로써 지방세포의 분화를 억제하였다고 보고하였다. 본 연구 결과 확인된 비파 부위별 GPDH 활성 억제 효과가 어떤 transcription factor에 영향을 주는지는 추후 연구에서 밝혀야 할 사항이다.
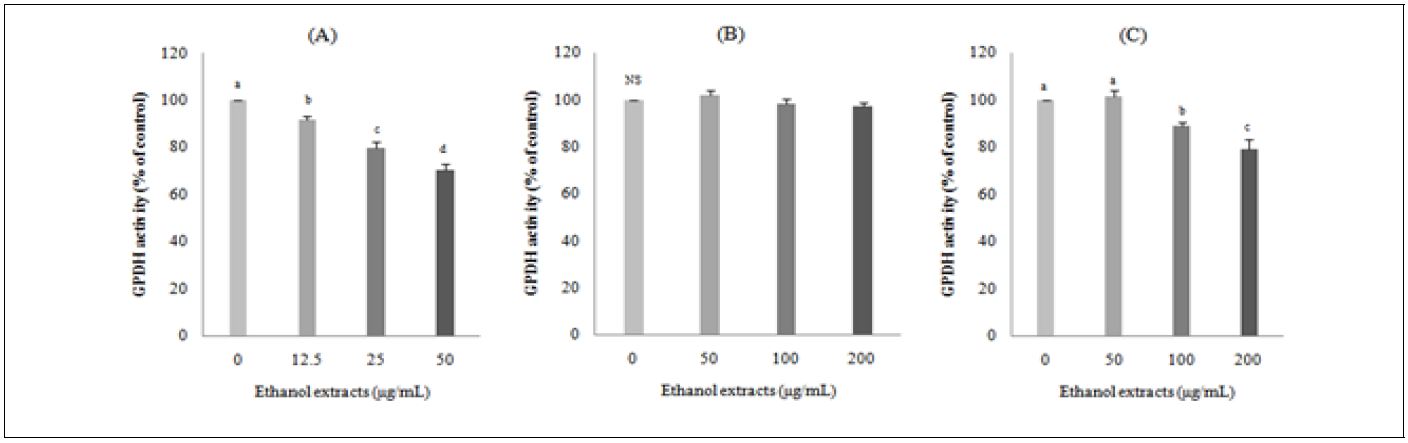
Effects of loquat (Eriobotrya japonica Lindl.) seed (A), flesh (B) or leaf (C) ethanol extracts on GPDH activity of 3T3-L1 cells. DMSO was used as a control. Flesh: seedless fruit. Values are mean ± SE(n=3). a-cValues with different superscript letters are significantly different(p<0.05) according to Tukey’s test. NS: No significant differences among groups.
3. 3T3-L1 세포의 중성지방 함량에 미치는 효과
비파 씨, 과육 및 잎 에탄올 추출물이 중성지방 함량에 미치는 결과는 Fig. 3과 같다. 비파 씨와 잎 에탄올 추출물로 처리하였을 경우 3T3-L1 세포의 중성지방 함량도 대조군에 비하여 농도 의존적으로 유의하게 저하되었다. 비파 과육 에탄올 추출물의 경우도 저농도에서는 중성지방 함량에 영향을 미치지 않았으나, 고동도인 100 μg/mL 농도부터 대조군에 비하여 3T3-L1 세포의 중성지방 함량을 유의하게 저하시켰다 지방전구세포가 지방세포로 분화할 때 세포 내 지방구가 침착하게 되는데, 중성지방 함량이 적다는 것은 분화가 덜 되었다는 것을 의미한다. 본 연구의 결과와 마찬가지로 녹차와 녹차씨 압착박 추출물이 3T3-L1 지방세포의 중성지방 함량에 미치는 영향을 살펴본 결과 녹차씨 압착박 추출물이 녹차 추출물에 비하여 중성지방 함량이 더 낮았다고 보고하였다(Wee et al. 2015). 백두구 과실 추출물의 경우는 저농도에서는 3T3-L1 지방세포의 중성지방 함량에는 영향을 미치지 않았으나, 고농도(200 μg/mL) 처리 시에는 유의하게 저하되었다고 하였다(Park et al. 2014).
이상의 결과로 미루어 비파 부위별 에탄올 추출물은 3T3-L1 세포의 GPDH의 활성을 저하시킴으로써 중성지방 축적 및 지방전구세포의 분화를 억제할 것으로 보여 비만 예방효과가 있을 것으로 보여진다. 비파 부위별 에탄올 추출물 중 비파 씨 에탄올 추출물이 3T3-L1 세포의 GPDH 활성과 중성지방 함량을 가장 많이 억제하였으며, 천연물질로써 비교적 낮은 농도(12.5 μg/mL)에서도 효과가 나타나는 것으로 보아 항비만 소재로의 개발 가능성이 있을 것으로 사료된다.
Triglyceride contents in 3T3-L1 mature dells treated with loquat (Eriobotrya japonica Lindl.) seed(A), flesh(B) or leaf(C) ethanol extracts. DMSO was used as a control. Flesh: seedless fruit. Reported values are means ± SE(n=3). a-dValues with different superscript letters are significantly different (p<0.05) according to Tukey’s test.
4. 돼지 지방전구세포의 독성에 미치는 효과
비파 부위별 에탄올 추출물이 돼지 지방전구세포의 독성에 미치는 효과를 알아보기 위해 5, 10, 25, 50, 100, 200 μg/mL 농도로 24시간 전 처치하여 세포 생존률을 측정하였으며 그 결과는 Fig. 4와 같다. 높은 농도인 100 μg/mL부터 비파 씨 에탄올 추출물만 세포 생존률이 대조군에 비하여 유의하게 저하시켰다. 이러한 결과로 볼 때 비파 과육과 잎 에탄올 추출물은 돼지 지방전구세포의 독성효과는 3T3-L1 세포와 비슷한 경향으로 200 μg/mL의 농도에서 독성을 나타나지 않았다. 따라서 비파 과육과 잎 에탄올 추출물의 경우는 세포 생존율에 영향을 미치지 않는 200 μg/mL 이하의 농도인 50, 100, 200 μg/mL에서, 비파 씨 에탄올 추출물은 12.5, 25, 50 μg/mL 농도로 돼지 지방전구세포에 처리하여 지방세포 분화효과를 확인하였다.
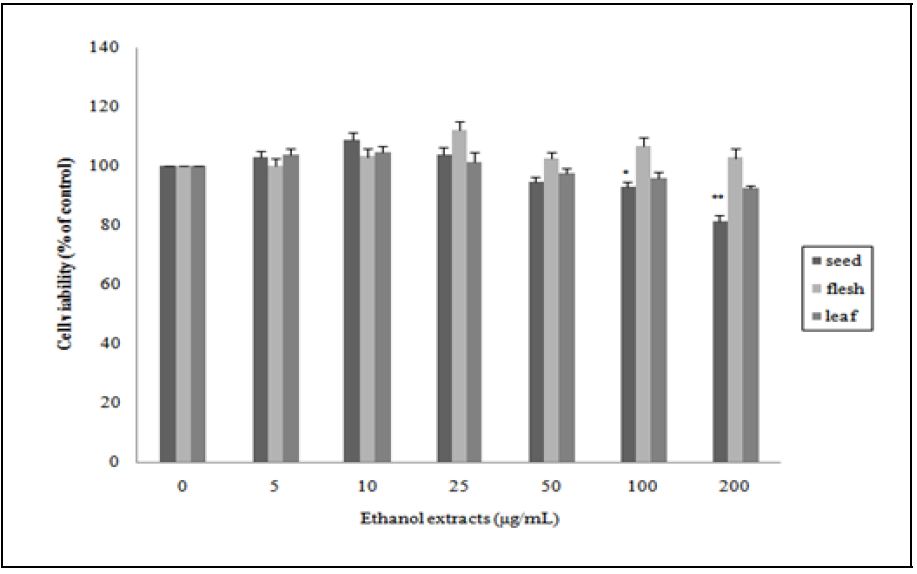
Cytotoxic effects of loquat (Eriobotrya japonica Lindl.) seed, flesh or leaf ethanol extracts on pig preadipocytes. Pig pre-adipocytes were treated with various concentrations (5-200 μg/mL) of loquat ( Eriobotrya japonica (Thunb.) Lindl.) seed, flesh or leaf ethanol extracts for 24 hours. Then, the cell viability was evaluated by the MTT assay. DMSO was used as a control. Flesh: Seedless fruit. Reported values are means ± SE(n=3). Significantly different compared to control as determined by the Student t-test (*p<0.05, **p<0.01).
5. 돼지 지방전구세포의 GPDH 활성에 미치는 효과
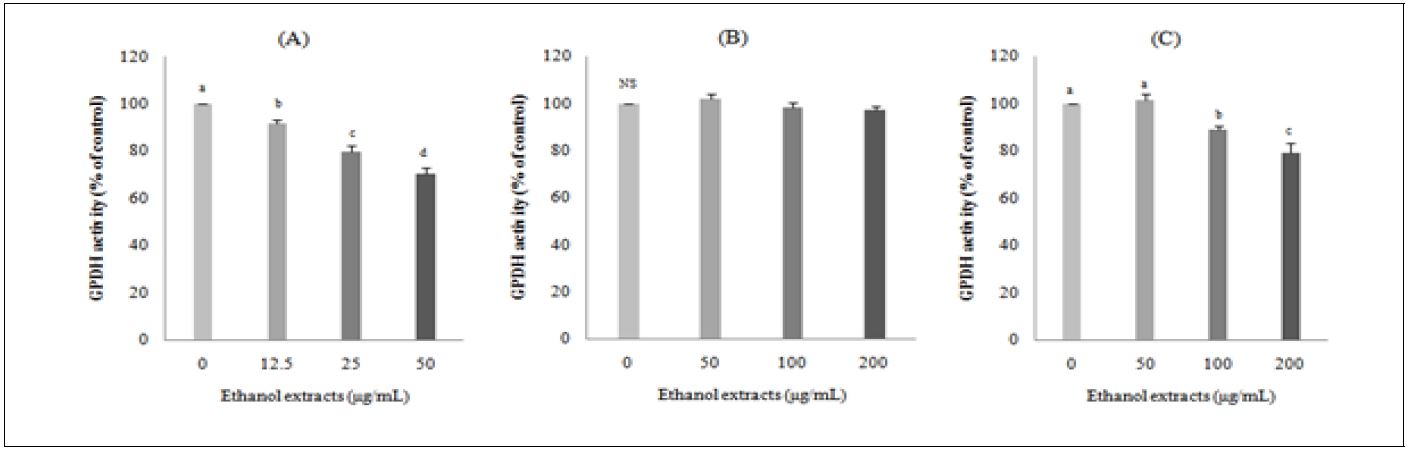
지방세포의 분화에 미치는 영향을 보는 연구들은 주로 쥐나 세포주(cell line)를 이용한 연구가 많으나( Dieudonne et al. 2002), 돼지 지방전구세포를 이용한 연구들은 적은 편이다. 돼지 지방전구세포의 분화에 미치는 영향을 보고한 연구로는 183종의 약용 및 식용식물(Choi et al. 2010), 콜라비와 산사(Song et al. 2013), retinoic acid(Kim & Chung 2008; Song et al. 2011), 모시잎(Lee et al. 2016) 등으로 극히 일부분만 수행되었다. 비파 씨, 과육 및 잎 에탄올 추출물이 돼지 지방전구세포의 분화에 미치는 영향을 알아보기 위해 농도별로 처리하여 지방세포의 GPDH 활성을 측정한 결과는 Fig. 5와 같다. 비파 씨 에탄올 추출물은 지방세포의 GPDH 활성을 농도 의존적으로 저하시켰다. 비파 과육과 잎 에탄올 추출물도 100 μg/mL부터 유의하게 지방세포의 GPDH 활성을 저하시켰다. 비파 씨 에탄올 추출물이 비파 다른 부위에 비하여 12.5 μg/mL의 낮은 농도부터 돼지 지방세포의 GPDH 활성을 저하시킴으로서 지방세포의 분화를 가장 많이 억제시켰다. 모시잎 에탄올 추출물의 돼지 지방세포의 분화에 관한 연구에서도 100 μg/mL 농도부터 GPDH 활성을 유의하게 저하(Lee et al. 2016)시켜 본 연구의 비파 잎 추출물과 유사한 경향을 보였다. 또한 Choi et al.(2010)은 총 183종의 약용식물의 GPDH 활성 측정을 통한 돼지 지방전구세포의 분화에 미치는 연구 결과, 총 28종의 약용식물이 돼지 지방전구세포의 GPDH 활성에 영향을 미치는 것으로 나타났는데, 이중 16종의 약용식물은 증가시켰고, 12종은 억제시켰으며, 감초, 형개 및 구월나무(에탄올 추출), 그리고 비름, 천문동, 백출, 유자나무, 향부자, 구엽초 및 목단피(물추출)는 지방세포의 분화를 35% 이상 억제시켰다고 보고하였다. 이상의 결과 비파 모든 부위의 에탄올 추출물은 지방세포의 GPDH 활성을 저하시켜 분화를 억제시킴으로써 비만 예방효과를 가져오는 것으로 사료되고, 비파 씨 에탄올 추출물이 돼지 지방세포의 GPDH 활성을 가장 많이 저하시키는 것으로 나타났다.
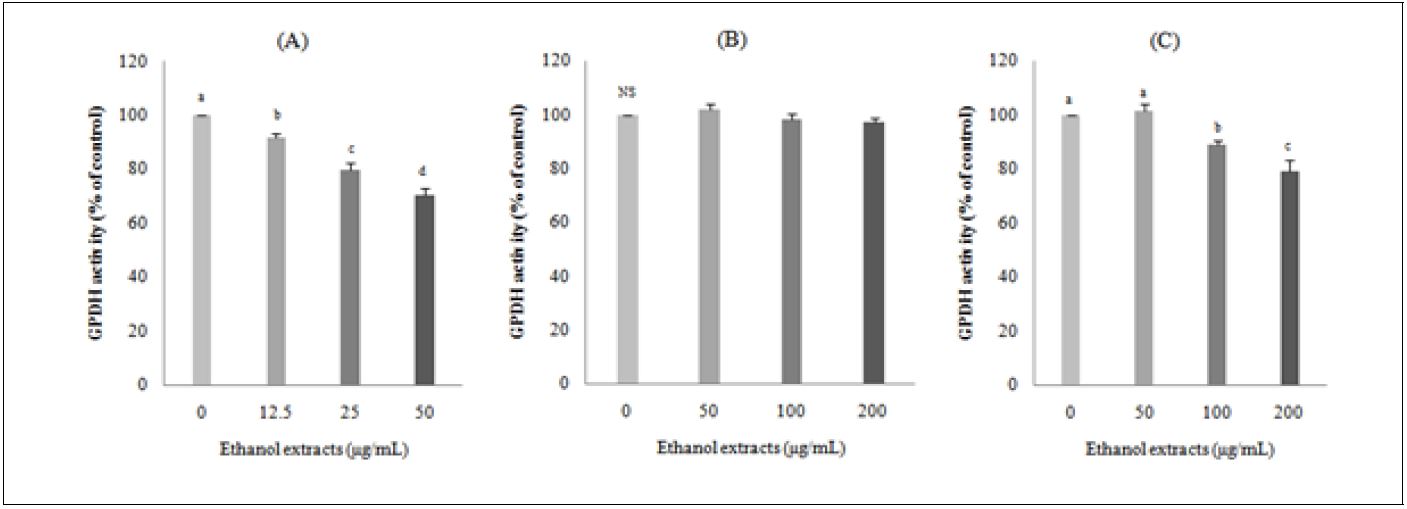
Effects of loquat (Eriobotrya japonica Lindl.) seed (A), flesh (B) or leaf (C) ethanol extracts on GPDH activity of pig preadipocytes. DMSO was used as a control. Flesh: seedless fruit. Reported values are means ± SE(n=3). a-dValues with different superscript letters are significantly different (p<0.05) according to Tukey’s test.
6. 돼지 지방전구세포의 중성지방 함량에 미치는 효과
비파 씨, 과육 및 잎의 에탄올 추출물이 돼지 지방전구세포 중성지방 함량에 미치는 영향을 살펴보았다. Fig. 6에서 보듯이 12.5, 25, 50 μg/mL 농도에서 돼지 지방세포의 GPDH 활성을 가장 많이 저하시킨 비파 씨 에탄올 추출물이 중성지방 함량도 농도 의존적으로 비파의 다른 부위 추출물에 비해서 유의하게 저하되었다. 비파 과육과 잎 에탄올 추출물도 대조군에 비하여 돼지 지방세포의 중성지방 함량이 유의하게 저하되었으나, 비파 씨 추출물의 농도보다는 높은 농도인 50 μg/mL에서부터 중성지방 함량을 저하시켰다. 비파 잎 추출물은 모시잎 추출물의 경우( Lee et al. 2016)와 유사하게 돼지 지방전구세포의 중성지방 함량을 저하시키는 경향을 보였다.
이상의 결과 비파 씨 에탄올 추출물이 돼지 지방전구세포에서 중성지방 함량이 가장 많이 저하되었고 비교적 낮은 농도에서도 우수한 지방 분화 억제 활성을 나타내어 효과적인 항비만 기능성식품으로서의 활용가치가 기대된다. 그러나 추후 계속적인 연구를 통하여 비파 씨, 과육 및 잎 추출물이 지방전구세포로부터 지방세포로 분화되는 adipogenesis의 과정에 관여하는 중요한 분화 조절인자들에 관한 연구와 더불어 비파 씨, 과육 및 잎에 함유된 항비만 활성 물질의 규명이 필요할 것으로 판단되어 진다.
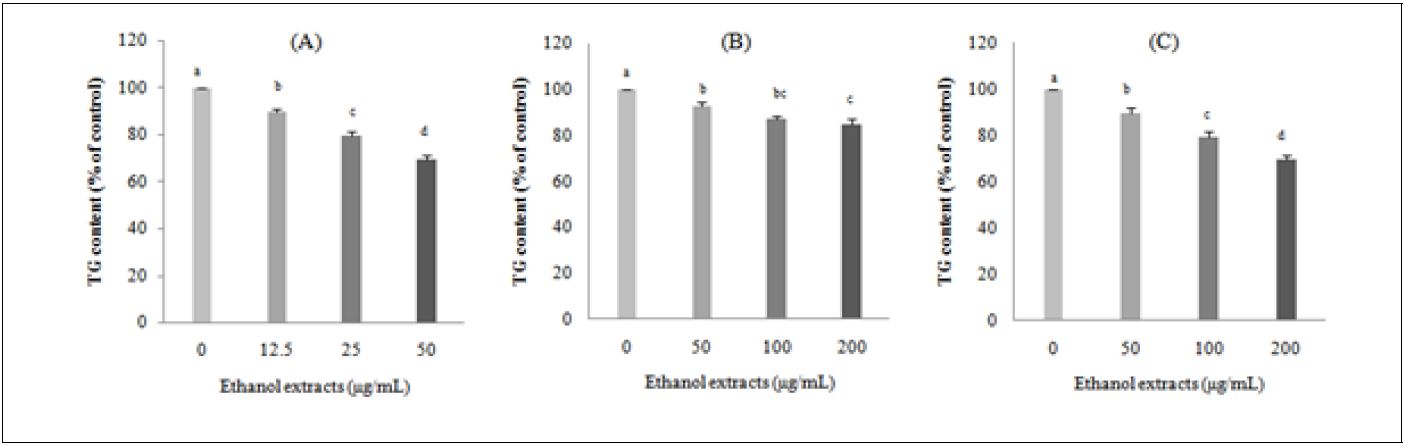
Triglyceride contents in pig preadipocytes treated with loquat (Eriobotrya japonica Lindl.) seed (A), flesh (B) or leaf (C) ethanol extracts. DMSO was used as a control. Flesh: seedless fruit. Reported values are means ± SE(n=3). a-dValues with different superscript letters are significantly different (p<0.05) according to Tukey’s test.
IV. 요약 및 결론
본 연구는 비파 씨, 과육 및 잎 에탄올 추출물을 가지고 3T3-L1 세포와 돼지 지방전구세포의 세포독성 및 지방세포 분화에 미치는 영향을 농도별로 알아보고자 실시하였다. 비파 씨, 과육 및 잎 에탄올 추출물을 5, 10, 25, 50, 100, 200 μg/mL 농도로 3T3-L1 세포와 돼지 지방전구세포에 24시간 전 처치하여 MTT assay로 분석하였는데, 두 세포 모두 비파 과육과 잎 에탄올 추출물은 독성이 나타나지 않았으나, 비파 씨 추출물의 경우 고농도인 100 μg/mL 농도부터 세포 생존율이 유의하게 저하되어 독성을 나타냈다. 따라서 비파 과육과 잎 에탄올 추출물은 세포 독성이 나타나지 않은 50, 100, 200 μg/mL 농도로, 비파 씨 에탄올 추출물은 12.5, 25, 50 μg/mL 농도로 각각 전처지하였을 경우 세포의 분화 억제효과를 살펴 본 결과, 3T3-L1 세포의 GPDH 활성은 비파 씨 에탄올 추출물은 저농도(12.5 μg/mL)에서도 활성이 유의하게 저하되었으며, 비파 잎 에탄올 추출물은 고농도(100 g/mL)로 처리하였을 경우 효과가 나타났으나, 비파 과육 추출물은 영향을 미치지 않았다. 3T3-L1 세포의 중성지방 함량은 비파 씨, 과육 및 잎 에탄올 추출물 모두 대조군에 비하여 저하되었으며, 비파 씨 에탄올 추출물이 가장 낮은 농도에서 저하효과가 나타났다. 돼지 지방전구세포의 경우도 비파 씨, 과육 및 잎 에탄올 추출물 모두 GPDH 활성과 중성지방 함량이 대조군에 비하여 저하되었으며, 비파 씨 에탄올 추출물이 가장 많이 저하시키는 것으로 나타났다. 이상의 결과 비파 각 부위별 에탄올 추출물은 3T3-L1 세포와 돼지 지방전구세포의 GPDH 활성 억제와 중성지방 축적을 억제하여 지방세포의 분화를 억제하는 것으로 나타났으며, 그 중 비파 씨 에탄올 추출물이 지방세포의 분화를 가장 많이 억제하였다.
References
-
Chen, C, Brodie, AE, Hu, CY, (1997), CCAAT/enhancer-binding protein β cannot overcome TCDD inhibition of 3T3-L1
preadipocyte differentiation
, Obes Res, 5(2), p146-152.
[https://doi.org/10.1002/j.1550-8528.1997.tb00655.x]

-
Chen, HC, and Farese, RV, (2005), Inhibition of triglyceride synthesis as a treatment strategy for obesity: lessons
from DGAT1-deficient mice
, Arterioscler Thromb Vasc Biol, 25(3), p482-486.
[https://doi.org/10.1161/01.ATV.0000151874.81059.ad]

-
Chen, J, Li, WL, Wu, JL, Ren, BR, Zhang, HQ, (2008), Hypoglycemic effects of a sesquiterpene glycoside isolated from leaves of loquat(
Eriobotrya japonica
(Thunb.) Lindl.)
, Phytomedicine, 15(1-2), p98-102.
[https://doi.org/10.1016/j.phymed.2006.12.014]

- Cho, YS, Park, SK, Lee, HY, (1991), Composition of free sugars, organic acids and free amino acids in loquat flesh , J Korean Soc Food Nutr, 20(1), p89-93.
-
Choi, HY, Kim, GH, (2014), Inhibitory effects of Allium senescens L. methanol extracts on
reactive oxygen species production and lipid accumulation during differentiation in 3T3-L1 cells
, Korean J Food Sci Technol, 46(4), p498-504.
[https://doi.org/10.9721/KJFST.2014.46.4.498]

-
Choi, YS, Choi, KD, Kim, SD, Phillip, O, Chung, CS, (2010), Extracts of Korean medicinal plant extracts alter lipogenesis of pig adipose tissue
and differentiation of pig preadipocyte
in vitro, J Anim Sci Technol, 52(5), p383-388.
[https://doi.org/10.5187/JAST.2010.52.5.383]

-
De Faria, FA, Hasegawa, PN, Chagas, EA, Pio, R, Purgatto, E, Mercadante, AZ, (2009), Cultivar influence on carotenoid composition of loquat form Brazil, J Food Comp Anal, 22(3), p196-203.
[https://doi.org/10.1016/j.jfca.2008.10.014]

- Dieudonne, MN, Pecquery, R, Leneveu, MC, Giudiecelli, Y, (2000), Opposite effects of androgens and estrogens on adipogenesis in rat preadipocytes: Evidence for sex and site-related specificities and possible involvement of insulin like growth factor 1 receptor and peroxisomes proliferator-activated receptor γ2 , Endocrinol, 141(2), p649-656.
-
Ercisli, S, Gozlekci, S, Sengul, M, Hegedus, A, Tepe, S, (2012), Some physciochemical characteristics, bioactive contents and antioxidant capacity
loquat(Eriobotrya japonica (Thunb.) Lindl.) fruits from Turkey
, Sci Horticult, 148(4), p185-189.
[https://doi.org/10.1016/j.scienta.2012.10.001]

-
Gesta, S, Tseng, YH, Kahn, CR, (2007), Developmental origin of fat: tracking obesity to its source, Cell, 131(2), p242-256.
[https://doi.org/10.1016/j.cell.2007.10.004]

-
Huang, Y, Li, J, Wang, R, Wu, Q, Li, YH, Yu, SC, Cheng, WM, Wang, YY, (2007), Effect of triterpene acids of Eriobotrya japonica(Thunb.) Lindl.
leaf on inflammatory cytokine and mediator induction from alveolar macrophages of chronic
bronchitic rats
, Inflamm Res, 56(2), p76-82.
[https://doi.org/10.1007/s00011-006-5185-0]

-
Ito, H, Kobayashi, E, Li, SH, Hatano, T, Sugita, D, Kubo, N, Shimura, S, Itoh, Y, Tokuda, H, Nishino, H, Yoshida, T, (2002), Antitumor activity of compounds isolated from leaves of
Eriobotrya japonica, J Agric Food Chem, 50(8), p2400-2403.
[https://doi.org/10.1021/jf011083l]

-
Jeong, HJ, Park, JH, Kim, MJ, (2015), Ethanol extract of Hippophae rhamnoides L. leaves inhibits
adipogenesis through AMP-activated protein kinase(AMPK) activation in 3T3-L1 preadipocytes
, Korean J Plant Res, 28(5), p582-590.
[https://doi.org/10.7732/kjpr.2015.28.5.582]

-
Jones, BH, Standridge, MK, Moustaid, N, (1997), Angiotensin Ⅱ increase lipogenesis in 3T3-L1 and human adipose cells
, Endocrinol, 138(4), p1512-1519.
[https://doi.org/10.1210/en.138.4.1512]

-
Jung, HA, Park, JC, Chung, HY, Kim, J, Choi, JS, (1999), Antioxidant flavonoids and chlorogenic acid from the leaves of
Eriobotrya japonica, Arch Pharm Res, 22(2), p213-218.
[https://doi.org/10.1007/BF02976549]

- Kim, HJ, Jo, C, Kim, TH, Kim, DS, Park, MY, Byun, MW, (2006), Biological evaluation of the methanolic extract of Eriobotrya japonica and its irradiation effect , Korean J Food Sci Technol, 38(5), p684-690.
-
Kim, HR, Chung, CS, (2008), Effects of retinoic acid on differentiation of pig preadipocytes, J Anim Sci Technol, 50(3), p315-320.
[https://doi.org/10.5187/JAST.2008.50.3.315]

- Kim, TH, Shin, SR, Kim, TW, Lee, IC, Park, MY, Jo, C, (2009), A Tyrosinase inhibitor isolated from the seeds of Eriobotrya japonica, Korean J Food Preserv, 16(3), p435-441.
-
Kwon, OJ, (2016), Anti-adipogenic effect of Mori follium extract in 3T3-L1 cells
, Korean J Herbol, 31(5), p47-53.
[https://doi.org/10.6116/kjh.2016.31.5.47.]

-
Lee, MH, Son, YK, Han, YN, (2004), Tissue factor inhibitory sesquiterpene glycoside from
Erriobotra japonica, Arch Pharm Res, 27(6), p619-623.
[https://doi.org/10.1007/BF02980160]

-
Lee, JM, Kim, AR, Lee, JJ, (2016), Ramie leaf extracts suppresses adipogenic differentiation in 3T3-L1 cells and pig
preadipocytes
, Asian Australas J Anim Sci, 29(9), p1338-1344.
[https://doi.org/10.5713/ajas.15.0384]

-
Litten-Brown, JC, Corson, AM, Clarke, L, (2010), Porcine models for the metabolic syndrome, digestive and bone disorders: a general
overview
, Animal, 4(6), p899-920.
[https://doi.org/10.1017/S1751731110000200]

-
Lunney, JK, (2007), Advances in swine biomedical model genomics, Int J Biol Sci, 3(3), p179-184.
[https://doi.org/10.7150/ijbs.3.179]

-
Matalka, KZ, Ali, D, Khawad, AE, Qa’dan, F, (2007), The differential effect of Eriobotrya japonica hydrophilic leaf
extract on cytokines production and modulation
, Cytokine, 40(3), p235-240.
[https://doi.org/10.1016/j.cyto.2007.10.003]

- Mei, J, Xu, R, (2003), The piglet as a model for studying parenteral nutrition. In the neonatal pig: gastrointestinal physiology and nutrition, R Xu, and P Cranwell Ed., Nottingham, Nottingham University, p309-335.
-
Moon, HS, Chung, CS, (2004), Effect of isomers of conjugated linoleic acid on porcine preadipocyte differentiation
, J Anim Sci Technol, 46(6), p967-974.
[https://doi.org/10.5187/JAST.2004.46.6.967]

-
Oh, J, Min, OJ, Kim, HA, Kim, YJ, Bak, HY, Rhyu, DY, (2011), Effect of Eriobotrya japonica on adipogenesis and body weight
, J Korean Soc Appl Bio Chem, 54(3), p382-387.
[https://doi.org/10.3839/jksabc.2011.060]

-
Park, JA, Jin, KS, Lee, JY, Kwon, HJ, Kim, BW, (2014), Anti-oxidative and anti-obesity effects of Amomum Cardamomum L.
extract
, Korean J Microbiol Biotechnol, 42(3), p249-257.
[https://doi.org/10.4014/kjmb.1403.03001]

-
Pracy, JP, White, A, Mustafa, Y, Smith, D, Perry, ME, (1998), The comparative anatomy of the pig middle ear cavity: a model for middle ear
inflammation in the human
, J Anat, 192(3), p359-368.
[https://doi.org/10.1046/j.1469-7580.1998.19230359.x]

-
Roncari, DA, Lau, DC, Kindler, S, (1981), Exaggerated replication in culture of adipocyte precursors from massively obese
persons
, Metab, 30(5), p425-427.
[https://doi.org/10.1016/0026-0495(81)90174-8]

-
Roh, SS, Kim, JS, Yim, SC, (2013), The efficacy of Eriobotryae Folium pharmacopuncture on local fat of
high fat diet induced obesity mice
, Acupunct, 30(3), p15-25.
[https://doi.org/10.13045/acupunct.2013002]

-
Rosen, ED, MacDougald, OA, (2006), Adipocyte differentiation from the inside out, Nat Rev Mol Cell Biol, 7(12), p885-896.
[https://doi.org/10.1038/nrm2066]

-
Shimizu, M, Uemitsu, N, Shirota, M, Matsumato, K, Tezuka, Y, (1996), A new triterpene ester from
Eriobotrya japonica, Chem Pharm Bull, 44(11), p2191-2182.
[https://doi.org/10.1248/cpb.44.2181]

-
Shimizu, M, Fukumura, H, Tsuji, H, Tanaami, S, Hayashi, T, Morita, N, (1986), Anti-inflammatory constituents and anti-inflammatory effect of Eriobotrya
japonica
Lindl
, Chem Pharm Bull, 34(6), p2614-2617.
[https://doi.org/10.1248/cpb.34.2614]

-
Song, MY, Dang, CG, Chung, CS, (2011), Effect of retinoic acid on proliferation and differentiation of preadipocytes from
male and female pigs
, J Anim Sci Technol, 53(3), p223-226.
[https://doi.org/10.5187/JAST.2011.53.3.223]

-
Song, MY, Lee, JJ, Cha, SS, Chung, CS, (2013), Effects of Kohlrabi(Brassica oleracea var. Gongylodes) on
proliferation and differentiation of pig preadipocytes and 3T3-L1 cells
, J Anim Sci Tech, 55(1), p19-23.
[https://doi.org/10.5187/JAST.2013.55.1.19]

-
Song, WY, Choi, JH, (2016), Korean Curcuma longa L. induces lipolysis and regulates leptin in
adipocyte cells and rats
, Nutr Res Pract, 10(5), p487-493.
[https://doi.org/10.4162/nrp.2016.10.5.487]

-
Suryawan, A, Swanson, LV, Hu, CY, (1997), Insulin and hydrocortisone, but not triiodothyronine, are required for the
differentiation of pig preadipocytes in primary culture
, J Anim Sci, 75(1), p105-111.
[https://doi.org/10.2527/1997.751105x]

-
Taniguchi, S, Imayoshi, Y, Kobayashi, E, Takamatsu, Y, Ito, H, Hatano, T, Sakagami, H, Tokuda, H, Nishino, H, Sugita, D, Shimura, S, Yoshida, T, (2002), Production of bioactive triterpenes by Eriobotrya japonica calli
, Phytochem, 59(3), p315-323.
[https://doi.org/10.1016/S0031-9422(01)00455-1]

-
Wee, JH, Sung, HS, Jung, KO, Kim, SJ, Shin, YR, Park, JH, Kim, JD, (2015), Anti-adipogenic effects of the water extracts of defatted green tea seed cake
, Korean J Food Sci Technol, 47(4), p525-533.
[https://doi.org/10.9721/KJFST.2015.47.4.525]

- Wise, LS, Green, H, (1979), Participation of one isozyme of cytosolic glycerolphosphate in adipose conversion of 3T3 cell , J Biol Chem, 254(2), p273-275.
- Yook, CS, (1989), Coloured medicinal plants of Korea, Seoul, Academic Publishing Co., p261.
-
Zimmermann, R, Strauss, JG, Haemmerle, G, Schoiswohl, G, Birner-Gruenberger, R, Riederer, M, Lass, A, Neuberger, G, Eisenhaber, F, Hermetter, A, Zechner, R, (2004), Fat mobilization in adipose tissue is promoted by adipose triglyceride lipase
, Sci, 306(5700), p1383-1386.
[https://doi.org/10.1126/science.1100747]

