씨간장으로부터 Bacillus velezensis SS360-1의 분리 및 특성 규명
조선대학교 식품영양학과 김치연구센터1)전남도립대학교 호텔조리제빵과
2)목포대학교 식품공학과
1)Dept. of Hotel Cusine & Baking, Jeonnam State College, Jeonnam, Korea
2)Dept. of Food Engineering, Mokpo National University, Mokpo, Korea
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0), which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Four bacteria harboring proteinase activity were isolated from seed soy sauce. Thereafter, their proteinase and amylase activities were assayed. Among the four isolated strains, one strain that showed the highest proteinase and amylase activities was selected tentatively as a starter culture for soy sauce and its characteristics for soy sauce starter culture were investigated. The selected strain was identified as Bacillus velezensis based on Gram-staining, spore-staining, and 16S rRNA gene sequences and finally designated as B. velezensis SS360-1. It showed high growth (A600=1.00~4.55) at 0~12% NaCl concentration. The optimum NaCl concentration for its growth was 3% NaCl. B. velezensis SS360-1 also grew well at 0% NaCl condition; however, its growth was dramatically decreased after 12 h incubation at this condition. The off-odor production ability of B. velezensis SS360-1 was investigated using portable odor measurement and GC-MS analysis. B. velezensis SS360-1 showed definitely lower production of off-odor compounds than did B. subtilis KCTC 3014, which was isolated from fermented soybean. Moreover, B. velezensis SS360-1 produced 3-methyl butanal and 2-heptanone, compounds that are considered as pleasant flavored-compounds for soy sauce. These results suggest that B. velezensis SS360-1 can be used as a suitable starter culture for soy sauce.
Keywords:
seed soy sauce, Bacillus velezensis, starter culture, characterizationI. 서론
간장은 콩을 자연 발효시켜 배양된 메주를 사용한 한식간장, 콩과 전분질 원료를 혼합사용하여 곰팡이를 발효균주로 사용하는 양조간장, 콩을 식용염산으로 가수분해 후 중화시킨 산분해간장, 그리고 생선을 발효시킨 어간장 등으로 분류되고 있다(Lee & Park 2004; Ministry of Food and Drug Safety 2017). 이중 Aspergillus oryzae 등의 특정 곰팡이를 사용하는 개량식 양조간장의 제조법과 달리 우리나라 전통 간장인 한식간장은 콩만을 원료로 하여 메주를 만들고 메주의 제조과정 중 자연계의 미생물 중 포자를 형성하는 Aspergillus 속, Mucor 속, Rhizopus 속 등의 곰팡이류와 더불어 Bacillus 속이 중요한 역할을 한다고 보고되고 있다(Yoo et al. 1999; Kang et al. 2000). 이와 같이 제조된 메주는 염수에 담그어 간장덧의 발효 및 숙성이 진행되며, 이 과정은 곰팡이류, Bacillus 속 및 젖산균 등의 세균 그리고 효모의 효소작용에 의하여 이루어진다(Cho & Lee 1970; Lee & Cho 1971). 숙성이 끝난 간장덧은 여과와 달임 과정을 거친 후 간장으로 완성되며, 이 간장은 숙성시킬수록 깊은 향과 단맛, 색이 짙어지고 짠맛이 순화된다. 또한 매년 장을 새로 담글 때 이전에 제조된 간장을 추가로 첨가하기도 하여 기존 장맛을 지속적으로 유지하도록 하였다. 이를 씨간장이라 하고 우리나라 종가에서는 수십, 수백 년을 전해오는 씨간장을 보존하여 오기도 하였다. 간장 숙성시 씨간장을 첨가하였을 때 새로 담근 장의 맛이 기존의 씨간장 맛과 유사하게 구현될 수 있는 이유는 씨간장에 존재하는 발효미생물의 발효 작용 때문이다. 전통 장류 발효 및 숙성에는 곰팡이류에 의한 주발효과정인 단백질 가수분해 경로 외에 맛과 향에 관여하는 이차적 발효 경로에 Bacillus 속이 중요한 역할을 하는 것으로 보고되고 있다(Kwon et al. 1986; Chang & Chang 2007). 즉 새로 담근 간장의 발효 및 숙성에는 새로이 제조된 메주의 단백질 분해와 전분 분해 과정과 더불어 씨간장 첨가에 의하여 씨간장내의 발효미생물이 간장의 맛과 향을 결정하는 것으로 사료된다. 씨간장의 발효미생물(Bacillus 속) 역시 포자형성균으로써 장의 달임 공정이나 수십~수백 년간의 오랜 기간에도 포자형태로 씨간장내에 생존할 수 있어 이를 새로운 간장 제조시 첨가하면 포자의 발아 및 균주 생육으로 간장의 발효ㆍ숙성에 관여할 수 있다.
본 연구에서는 전라남도 지역의 종가에서 제조된 씨간장에서부터 우수 발효미생물을 분리하여 이를 간장용 종균으로 개발하고자 하였다. 이에 오랜 기간 숙성된 씨간장으로부터 균주를 분리ㆍ동정하고 이 분리균주의 내염성, protease와 amylase 활성, 관능적 냄새 강도 측정 및 냄새성분 분석 등을 시행하였다. 이와 같은 연구를 통하여 분리균주의 간장용 종균 활용 가능성에 대한 기초 자료를 제공하고자 하였다.
Ⅱ. 연구방법
1. 균주의 분리
전라남도 지역의 가정에서 제조되어 오랜 기간 보관되어온 씨간장을 시료로 취하였다. 시료 1 mL를 멸균증류수 10 mL에 현탁한 후 순차적으로 희석하고, 희석액을 100 μL 또는 200 μL 취하여 평판배지에 도말하였다. 이때 배지는 Luria broth(LB, 1% bacto-tryptone, 0.5% yeast extract, 1% NaCl, Difco, Sparks, MD, USA)에 2% skim milk(Difco)와 3% NaCl을 첨가한 배지를 사용하였다. 평판배지는 37℃에서 24시간 배양하면서 균주가 생성하는 단백분해효소에 의해 skim milk가 첨가된 동배지에서 투명환을 형성하는 콜로니를 일차적으로 선별하였다. 선별한 균주는 TSB(Tryptic Soy Broth, Difco) 액체배지에 2~3회 계대배양 후 streaking하여 순수분리를 확인하였다.
2. 분리 균주의 효소활성(protease, amylase) 측정
분리 균주에 의해 생산된 효소의 활성을 측정하기 위하여 분리균주로부터 조효소액을 준비하였다. 분리균주를 전배양하여 LB 액체배지에 1% 접종하고 24시간 배양한 다음 원심분리(9,950×g, 15 min, 4℃)하여 회수한 배양상징액을 membrane filter(0.45 μm pore size, Advantec MFS, Dublin, CA, USA)로 제균하여 조효소액으로 사용하였다. Proteases 활성 측정은 Boonyaras 등에 의한 azocasein법을 변형하여 측정하였다(Sookkheo et al. 2000). 기질로는 azocasein (Sigma, St. Louis, MO, USA) 0.2 g을 20 mM Tris-HCl-5 mM CaCl2(pH 7.0) 100 mL에 현탁하여 사용하였다. 기질용액 1 mL에 조효소액 0.1 mL를 혼합하여 37℃에서 1시간 반응시킨 다음 12%(w/v) trichloroacetic acid(Sigma) 2 mL를 첨가하여 반응되지 않은 azocasin을 침전시켰다. 이 후 4℃에서 30분 동안 방치한 후 원심분리(9,950×g, 15 min, 4℃)하여 상등액을 취하고 동량의 0.5 M NaOH를 혼합하여 440 nm에서 흡광도를 측정하였다. 효소활성은 1시간 동안 조효소액 1 mL가 효소 반응액을 440 nm에서 0.01을 증가시켰을 때 1 unit/mL로 정의하였다.
α-Amylase 활성 측정은 0.5% soluble starch를 기질로 사용하였으며 기질용액 2 mL에 조효소액 1 mL를 혼합하여 50℃에서 30분간 반응하였다. 반응액 0.3 mL에 0.01 N I2 solution을 첨가한 후 증류수로 10 mL가 되도록 정용하고 660 nm에서 흡광도를 측정하였다. 효소활성은 1시간 동안 조효소액 1 mL가 효소 반응액을 660 nm에서 푸른색의 강도를 50% 감소시켰을 때 1 unit/mL로 정의하였다(Kim et al. 1998).
3. 분리 균주의 동정
분리 균주는 LB 평판 배지에서 37℃, 12시간 동안 배양 후 집락의 형태학적 관찰 및 그람염색 kit(BD Diagnostics Co., Sparks, MD, USA) 및 포자염색(Schaeffer & Fulton 1933)을 통한 세포 형태 관찰을 하였다. 최종적인 균주의 동정을 위하여 16S rRNA 염기서열을 결정하고 이를 Gen Bank에 등록된 표준균주(type strain)와의 상동성 비교를 수행하였다. 먼저 16S rRNA 염기서열 분석을 위하여 분리균주의 chromosomal DNA를 Wizard genomic DNA purification kit(Promega, Madison, WI, USA)를 이용하여 분리한 뒤 universal primer인 518F(5′-CCAGCAGCCGCGGTAATACG-3′)와 800R(5′-TACCAGGGTATCTAATCC-3′) primer을 사용하여 PCR을 수행하였으며 증폭된 PCR 산물은 Wizard SV Gel and PCR clean-up system(Promega, Madison, WI, USA)을 이용하여 정제하였다(Yang & Chang 2007). 정제된 PCR 산물은 ABI PRISM 3730 DNA analyzer(Applied Biosystems, Foster City, CA, USA)을 이용하여 분석하였다. 염기서열 분석은 BLASTN 프로그램(http://www.ncbi.nlm.nih.gov/genbank)을 사용하여 염기서열 비교 후, CLUSTAL W 프로그램(http://www.genome.jp/tools-bin/clustalw)을 사용하여 상동성 비교 분석을 시행하였다.
4. 분리 균주의 내염성
LB 액체 배지에 37℃에서 24시간 전배양한 균주를 NaCl이 0, 3, 6, 9, 12, 15%(w/v)까지 농도로 첨가한 LB 액체배지에 1% 접종하였다. NaCl 첨가량이 다른 각각의 배지에서 120시간 진탕배양하며 12시간 간격으로 600 nm에서 흡광도를 측정하여 NaCl 농도에 따른 균체 생육도를 측정하였다.
5. 분리 균주 배양상징액의 냄새강도 측정
균주의 이취 생성 여부를 조사하기 위하여 균주 배양액의 냄새강도를 측정하였다. 휴대용 냄새 측정기인 OMX-SR(Shinyei, Kobe, JAPAN)을 이용하여 배양상징액의 냄새의 상대적인 강약 정도를 측정하였다(Byeon et al. 2008; Goto et al. 2016). 이때 대조구로서 장류에서 분리된 Bacillus 속 균주인 B. subtilis KCTC 3014를 한국생물자원센터에서 구입하여 사용하였다. B. subtilis KCTC 3014와 분리 균주를 각각 3% NaCl이 첨가된 LB 액체배지에서 37℃, 24시간 배양한 후 원심분리(9,950×g, 15 min, 4℃)하여 균체를 제거하고, 회수한 배양상징액을 사용하였다. 냄새강도 측정은 600 mL 멸균된 비커에 배양상징액 100 mL를 넣고 밀봉한 다음 상온에서 3시간 방치한 후 냄새를 측정하였다.
6. 분리 균주 배양상징액의 냄새성분 분석
배양상징액의 냄새성분 분석을 위해 B. subtilis KCTC 3014와 분리 균주는 각각 단백질 함유 배지인 LB 액체배지에서 37℃에서 24시간 배양한 후 원심분리(9,950×g, 15 min, 4℃)하여 균체를 제거하고, 회수한 배양상징액을 냄새성분 분석에 이용하였다. Nickerson-Likens의 연속증류 추출장치(simultaneous steam distillation and extraction: SDE)를 이용하여 균주 배양상징액의 냄새성분을 추출하였다(Nickerson & Likens 1966). 배양상징액 1 L에 증류된 diethyl ether 100 mL을 용매로 사용하여 상압 하에서 2시간동안 100℃하에서 냄새성분을 추출하였다. 추출액은 무수 황산나트륨을 넣고 암소에서 하룻밤 정치하여 수분을 완전히 제거한 후 vigreux column을 이용하여 1 mL까지 농축하였다. 추출된 배양상징액의 냄새성분 분석은 GC/MS(HP 6890 GC/HP 5973 MSD, Hewlett Packard, Palo Alto, CA, USA)를 사용하여 시행하였으며, 이때 컬럼은 J&W DB-5 MS(30 m×0.25 mm×0.25 μm; J&W Scientific, Folsom, CA, USA)를 사용하였고 검출기는 Agilent 6890/5873 mass selective detector(MSD)(Agilent, Santa Clara, CA, USA)를 사용하였다. 오븐의 온도는 50℃에서 5분 유지 후 1분마다 5℃씩 250℃까지 상승시켰으며 250℃에서 25분간 유지하였다. 운반 기체는 헬륨을 사용하였으며 주입기 온도는 250℃, split ratio 15:1로 2 μL를 주입하였다(Chang & Chang 2007). Mass spectrum은 wiley 7N database(Hewlett Packard)로 분석하였다.
7. 통계 분석
SPSS 23.0 statistics 프로그램(SPSS Inc., Chicago, IL, USA)을 이용하여 평균과 표준편차를 구하였다. 각 변수에 대해 일원배치분산분석(one-way ANOVA)를 실시하였으며 사후검정으로는 Tukey’s test를 적용하였고 통계적 유의성은 p<0.05를 기준으로 하였다.
Ⅲ. 결과 및 고찰
1. 균주의 분리
본 연구에서는 전라남도 지역의 한 종가에서 조상 대대로 전래된 방법으로 전통 한식간장을 빚고 이를 100년 이상 보관해 왔다고 하는 씨간장을 얻어 시료로 사용하였다. 수집된 씨간장은 일반간장보다 확연히 높은 점도와 더불어 투명도가 거의 없는 짙은 간장 색을 나타내었다(data not shown). 이 씨간장으로부터 일차적으로 단백분해효소 생성균주를 분리하고자 하였다. 단백분해효소를 생성하는 균주는 skim milk가 첨가된 LB 평판배지에서 집락(colony)주변에 투명환을 형성하므로 동배지에서 집락 주변으로 투명환을 생성하는 서로 다른 형태의 균주를 분리하였다. 이때 집락주변에 투명환을 생성함과 동시에 확연한 차이로 시료 내 높은 우점율을 나타내는 미생물 4종(KS5-1, KS5-4, SS360-1, SS360-3)이 관찰되었다(data not shown). 선별된 4종의 우점 미생물은 2~3차례 계대배양을 통해 순수분리를 확인하였다. 이후 순수 분리된 4종의 균주들의 protease와 amylase 활성을 측정하여 간장 제조용 종균으로써의 활용가능성을 조사하였다.
2. 분리 균주의 효소 활성
분리균주 4종의 protease와 amylase 활성을 측정하였다(Table 1). 이때 대조구로 기존에 기개발된 된장용 세균형 코지 균주 B. subtilis DJ1(Chang & Chang 2007)과 된장 제조사인 (주)D사로부터 분양받은 된장 종균 곰팡이 Asp. oryzae의 protease와 amylase 활성을 함께 측정하였다. 전반적으로 장류에서 분리된 5종의 세균 모두가 1종의 곰팡이 종균에 비하여 protease 활성과 amylase 활성이 높음을 확인할 수 있었다. 본 연구의 간장에서 분리된 균주 4종 모두 높은 protease 활성(300 unit/mL 이상)을 나타내었다. Amylase 활성의 경우 SS360-1 균주가 다른 균주들에 비해 특이적으로 높게 측정됨을 확인하였다. 전통된장으로부터 분리된 된장 제조용 세균형 코지 미생물인 B. subtilis DJ1은 높은 protease 활성을 지님과 동시에 amylase 활성이 높아 된장 제조에 적합한 균주라고 보고된바 있다(Chang & Chang 2007). 본 연구에서 분리된 SS360-1의 경우는 B. subtilis DJ1 균주보다 더 높은 amylase 활성을 나타냄을 확인하였다. 된장용 종균은 우선적으로 단백분해능이 뛰어나야 함에 비해 간장용 종균은 된장용 종균과 달리 단백질 분해에 의한 아미노산 생성능과 더불어 전분분해에 의한 당 생성능이 뛰어나야 구수한 맛과 더불어 단맛, 향긋한 풍미, 짙은 색 등을 부여할 수 있다. 이에 분리 균주 4종 중 protease와 amylase 활성이 모두 뛰어난 SS360-1 균주를 간장용 종균으로 일차 선발하고, 이를 동정한 후 이 균주의 간장종균으로써 활용 가능성을 다음과 같이 조사하였다.
3. 분리 균주의 동정
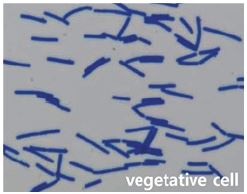
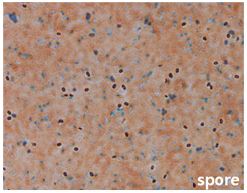
분리균주 SS360-1은 그람염색과 위상차 현미경을 통한 형태학적 관찰결과 그람양성, 간균의 세포형태를 나타내었다. 또한 포자를 형성하며, 3% NaCl이 첨가된 LB 평판배지에서 배양시 집락의 모양은 둥글고 표면에는 점질을 형성하였고 아이보리색을 나타내었다(Table 2). 분리균주의 16S rRNA 염기서열을 결정한(1,412 bp) 후, 이를 GenBank에 등록된 다른 균주의 염기서열과 비교한 결과 표준균주인 B. velezensis CR-502와 98.3% 상동성을 나타내었다(Fig. 1). 이에 분리균주는 B. velezensis로 동정되었으며, 최종적으로 B. velezensis SS360-1로 명명하였다.
4. 분리 균주의 NaCl 농도에 따른 생육도
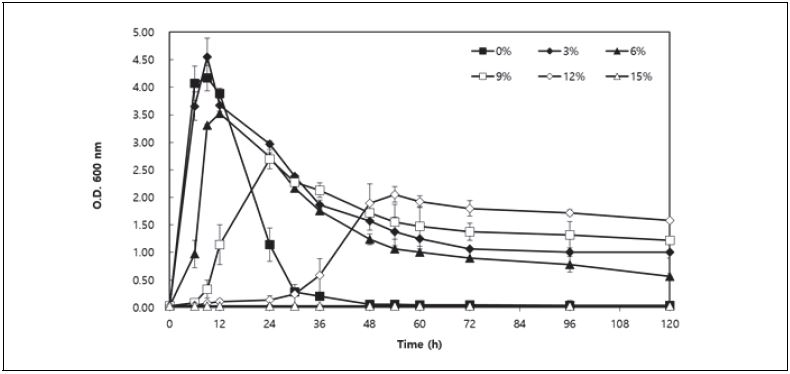
B. velezensis SS360-1는 LB 배지에 NaCl을 전혀 첨가하지 않은 경우(0%) 배양 12시간 이후 생육이 급속히 감소하였으며, 생육 30시간 이후에는 완전히 사멸기에 도달하면서 포자형성에 의한 세포 자기소화현상이 일어남을 알 수 있었다(Fig. 2). LB 배지에 3% NaCl을 첨가한 경우(3%) 최대 생육(A600=4.55)을 나타내었고, 배양 72시간 이후에도 A600=1.00 정도의 생육을 유지하였다. 배지에 최대 12%까지 NaCl을 첨가한 경우에는 다른 첨가구에 비해 초기 생육속도가 느리지만 배양 48시간부터 120시간까지 A600= 1.50~2.00 정도의 생육을 유지하였다. 그러나 NaCl 15% 이상의 농도에서는 B. velezensis SS360-1의 생육은 관찰되지 않았다. 통상 일반적인 Bacillus sp.은 12% NaCl에서 거의 생육할 수 없음에 비해(Kwon et al. 1986; Ko et al. 2004; Cho et al. 2009; Lee et al. 2011) B. velezensis SS360-1 균주는 내염성이 뛰어남을 알 수 있었다. 이로부터 B. velezensis SS360-1은 3% NaCl 조건에서 가장 잘 생육할 수 있으며, 고농도 식염하(12% NaCl)에서도 잘 생육할 수 있는 내염성 균주임을 확인할 수 있었다. 이와 같은 B. velezensis SS360-1의 특징은 고농도 식염하에서 간장발효가 이루어진다는 점을 고려시 간장 발효종균으로 활용 가능성이 높음을 시사한다.
5. 분리 균주 배양상징액의 냄새강도 측정
B. velezensis SS360-1과 B. subtilis KCTC 3014의 배양상징액 냄새를 직접 관능한 결과, B. subtilis KCTC 3014는 Bacillus 속 특유의 쿰쿰하고 구린내가 강하게 느껴진 반면, B. velezensis SS360-1은 쿰쿰한 냄새가 약하고 후미에 구수한 발효취를 나타내었다.
휴대용 냄새 측정기 OMX-SR은 각종 취기 및 향기를 냄새강약에 따라 저농도에서부터 고농도까지 자동 측정하는 장비로서, 주로 폐수처리장, 각종 공장, 축사 등의 악취 강도 측정 또는 탈취효과 등을 측정할 때 사용되어진다(Byeon et al. 2008; Goto et al. 2016). 본 연구에서는 분리균주 배양상징액의 냄새 강도를 보다 객관적으로 표현하기 위하여 휴대용 냄새 측정기인 OMX-SR을 이용하여 냄새강도를 측정하였다. B. subtilis KCTC 3014는 냄새강도 171으로 강하고 구린 냄새를 생성하는 반면 B. velezensis SS360-1은 냄새강도 28로 쿰쿰한 냄새가 약하게 형성됨을 확인할 수 있었다(Table 3). 이와 같은 B. velezensis SS360-1의 낮은 이취 생성능은 이 균이 간장발효에 사용 시, 전통 한식간장에서 문제점으로 제시되고 있는 고린 냄새와 같은 악취생성(Lee et al. 2013)을 저감화 시킬 수 있는 가능성에 대한 간접적 지표가 될 수 있다.
6. 분리 균주 배양상징액의 냄새성분 분석
분리 균주 배양상징액의 후각을 통한 관능평가와 더불어 냄새 측정기를 사용한 단순 냄새생성 정도의 강약측정에서 더 나아가 B. velezensis SS360-1의 냄새 생성물의 정성적 분석을 하고자 하였다. GC-MS를 사용하여 B. velezensis SS360-1과 B. subtilis KCTC 3014의 배양상징액의 냄새성분 분석결과, B. velezensis SS360-1은 총 46종, B. subtilis KCTC 3014는 총 50종의 화합물이 동정되었다. 동정된 화합물 가운데 배양상징액의 냄새에 영향을 미치는 것으로 추정되는 화합물을 정리하였다(Table 4). 냄새에 영향을 미치는 화합물의 총 함량을 산출했을 때 B. subtilis KCTC 3014는 2,582.5 μg/kg로 B. velezensis SS360-1의 1,936.4 μg/kg에 비해 높은 함량이 검출되었다. 또한 B. subtilis KCTC 3014의 경우 강한 자극을 부여하는 것으로 알려져 있는(Bensafi et al. 2002; Kim 2006; Han et al. 2014) acetaldehyde, acetic acid, indole과 불쾌취를 부여하는(Ji et al. 1992a; Kim et al. 1992) 2-butanol, 1-butanol 등의 화합물이 높게 검출되었으며, 마늘류 등에서 느껴지는 강하고 자극적인 냄새의 원인물질인(Ji et al. 1992b; Cha et al. 1998) sulfide 류가 검출되었다. 이에 반해 B. velezensis SS360-1은 이러한 자극적인 냄새성분들은 적게 검출되거나 검출되지 않았으며 동시에 fresh한 과일 발효취 등을 부여하는(Lersen & Poll 1992; Park et al. 1997) 3-methyl butanal, 2-heptanone 등이 검출되었다. 특히 B. velezensis SS360-1에서는 고소한 아몬드와 같은 향을 부여하는(Park et al. 1997; Han et al. 2014) benzaldehyde가 검출되어 구수한 향을 생성함이 확인하였다. 그러나 B. subtilis KCTC 3014의 경우 benzaldehyde는 B. velezensis SS360-1과 동일한 양이 검출되었으나, 전통 청국장이나 일본 natto 특유의 쿰쿰한 냄새를 부여하며 자극적인 화합물로 알려져 있는(Choi & Ji 1989; Choi et al. 1997; Han et al. 2014; Lee et al. 2015) 2,5-methyl pyrazine과 2-methyl benzaldehyde의 함량이 B. velezensis SS360-1에 비해 높게 검출되었으며, 이러한 쿰쿰한 냄새성분이 서로 복합적으로 작용하면서 B. subtilis KCTC 3014의 경우 B. velezensis SS360-1보다 균주 특유의 강하고 쿰쿰한 냄새를 더 많이 생성함을 확인할 수 있었다.
Ⅳ. 요약 및 결론
우리나라 전통 씨간장으로부터 간장용 발효미생물을 분리하여 이를 간장제조용 종균으로 개발하고자 하였다. 이에 수집된 씨간장으로부터 일차적으로 4종의 protease 활성이 뛰어난 균주를 분리할 수 있었다. 분리균주의 protease와 amylase 활성 측정 시, 4종의 분리균주 중 1종의 균주에서 protease와 amylase 활성이 동시에 모두 뛰어남을 확인할 수 있었다. 이에 이 균주의 간장 종균 활용 가능성을 조사하였다. 최종 선별된 1종의 균주는 Gram 염색, 포자염색, 16S rRNA 염기서열 분석 등을 통하여 Bacillus velezensis로 동정되어 B. velezensis SS360-1로 칭하였다. B. velezensis SS360-1은 3% NaCl 조건하에서 가장 잘 생육할 수 있으며(A600=4.55), 고농도 식염(NaCl 12%)하에서도 48시간 이후 A600=1.89 이상의 생육을 할 수 있는 내염성 균주임을 확인할 수 있었다. 분리 균주의 불쾌취 생성 조사를 위하여 단백질 함유 배지(LB 배지)에서 균주를 배양 후 그 배양액의 냄새를 맡았을 때 Bacillus 속 특유의 쿰쿰한 냄새, 구린 냄새가 약하고 후미에 구수한 발효취를 나타내었다. GC-MS를 통한 배양상징액의 성분 분석에서도 B. velezensis SS360-1은 불쾌취 화합물이나 강한 자극성 물질의 생성능은 약하고 구수하고 향기로운 물질(3-methyl butanal, 2-heptanone, benzaldehyde류) 등의 생성능은 뛰어난 것으로 조사되었다.
이와 같은 본 연구결과로부터 씨간장에서 분리된 B. velezensis SS360-1은 단백질과 전분분해능이 모두 뛰어났으며 이와 더불어 불쾌취 생성을 저감화 할 수 있는 균주임을 알 수 있었다. 이에 B. velezensis SS360-1는 발효간장의 우수한 맛과 향을 부여할 수 있는 간장발효 종균으로서 적합한 특성을 지닌 균주로 여겨진다. 그러나 간장발효는 발효미생물과 더불어 사용 원료, 발효 공정 및 조건 등에 의하여 최종 다양한 품질의 간장이 제조될 수 있다. 이에 후속 연구를 통하여 본 연구에서의 B. velezensis SS360-1을 발효종균으로 사용하여 간장 발효 후 제조 간장의 품질 평가에 관한 연구가 이루어져야 할 것이다.
References
-
Bensafi, M, Rouby, C, Farget, V, Vigouroux, M, Holley, A, (2002), Asymmetry of pleasant vs. unpleasant odor processing during affective judgment in humans, Neuro Letters, 328, p309-313.
[https://doi.org/10.1016/s0304-3940(02)00548-7]

-
Byeon, JH, Park, CW, Yoon, KY, Park, JH, Hwang, JH, (2008), Size distributions of total airborne particles and bioaerosols in municipal composting facility, Bioresour Technol, 99, p5150-5154.
[https://doi.org/10.1016/j.biortech.2007.09.014]

-
Cha, YJ, Kim, H, Cadwallader, KR, (1998), Aroma-active compounds in Kimchi during fermentation, J Agric Food Chem, 46, p1944-1953.
[https://doi.org/10.1021/jf9706991]

- Chang, M, Chang, HC, (2007), Characteristics of Bacterial-Koji and doenjang(soybean paste) made by using Bacillus subtilis DJ1, Korean J Microbiol Biotechnol, 35(4), p325-333.
- Cho, DH, Lee, WJ, (1970), Microbiological studies of Korean native soy-sauce fermentation: a study on the microflora of fermented Korean maeju loaves, J Korean Agric Chem Soc, 13(1), p35-42.
- Cho, KM, Math, RK, Hong, SY, Asraful Islam, SM, Mandanna, DK, Cho, JJ, Yun, MG, Kim, JM, Yun, HD, (2009), Iturin produced by Bacillus pumilus HY1 form Korean soybean sauce(Kanjang) inhibits growth of aflatoxin producing fungi, Food Control, 20, p402-406.
- Choi, MJ, Sohn, KH, Jeon, HJ, (1997), Changes in odor characteristics of doenjang with different preparing methods and ripening periods, Korean J Diet Cult, 12(3), p265-274.
- Choi, SH, Ji, YA, (1989), Changes in flavor of chungkookjang during fermentation, Korean J Food Sci Technol, 21(2), p229-234.
-
Goto, T, Higaki, N, Yagi, K, Ishida, Y, Watanabe, M, Nagao, K, Ichikawa, T, (2016), An innovative masticatory efficiency test using odour intensity in the mouth as a target marker: a feasibility study, J Oral Rehabil, 43, p883-888.
[https://doi.org/10.1111/joor.12444]

-
Han, DH, Park, JM, Bai, DH, (2014), Changes in microflora and flavor of soy sauce(Ganjang) according to the salt concentration, Food Eng Prog, 18(3), p248-255.
[https://doi.org/10.13050/foodengprog.2014.18.3.248]

- Ji, WD, Lee, EJ, Kim, JK, (1992a), Volatile flavor components of soybean pastes manufactured with traditional meju and improved meju, J Korean Agric Chem Soc, 35(4), p248-253.
- Ji, WD, Lee, EJ, Kim, SY, Kim, JK, (1992b), Characteristic volatile components of traditional Korean soy sauce, J Korean Agric Chem Soc, 35(5), p346-350.
- Kang, MJ, Kim, SH, Joo, HG, Lee, GS, Lim, MH, (2000), Isolation and identification of microorganisms producing the soy protein-hydrolyzing enzyme from traditional mejus, J Korean Soc Agric Chem Biotechnol, 43(2), p86-94.
- Kim, GE, Kim, MH, Choi, BD, Kim, TS, Lee, JH, (1992), Flavor compounds of domestic meju and doenjang, J Korean Soc Food Nutr, 21(5), p557-565.
- Kim, HJ, Lee, JJ, Cheigh, MJ, Choi, SY, (1998), Amylase, protease, peroxidase and ascorbic acid oxidase activity of kimchi ingredients, Korean J Food Sci Technol, 30(6), p1333-1338.
- Kim, ND, (2006), Trend of research papers on the soy sauce flavor in Japan, Food Indus Nutr, 11(2), p66-84.
- Ko, BK, Choi, IS, Lee, SH, Lin, CH, Lee, SH, Gal, SW, Choi, YJ, (2004), Isolation and characterization of chitinolytic strain, Bacillus atrophaeus CJ-3, J Life Sci, 14(3), p501-508.
- Kwon, OJ, Kim, JK, Chung, YG, (1986), The characteristics of bacteria isolated from ordinary Korea soy sauce and soybean paste, J Kor Agric Chem Soc, 29(4), p422-428.
-
Lee, DY, Chung, SJ, Kim, KO, (2013), Sensory characteristics of different types of commercial soy sauce, Korean J Food Cult, 28(6), p640-650.
[https://doi.org/10.7318/kjfc/2013.28.6.640]

- Lee, HC, Park, IS, (2004), Food fermentation, Seoul, Shinkwang publishing Co., p33-70.
-
Lee, JE, Kang, SH, Kim, HR, Lim, SI, (2015), Volatile compounds analysis of certified traditional doenjang, J Korean Soc Food Sci Nutr, 44(6), p944-950.
[https://doi.org/10.3746/jkfn.2015.44.6.944]

-
Lee, SY, Kim, JY, Baek, SY, Yeo, SH, Koo, BS, Park, HY, Choi, HS, (2011), Isolation and characterization of oligotrophic strains with high enzyme activity form buckwheat Sokseongjang, Korean J Food Sci Technol, 43(6), p735-741.
[https://doi.org/10.9721/kjfst.2011.43.6.735]

- Lee, WJ, Cho, DH, (1971), Microbiological studies of Korean native soy-sauce fermentation: a study on the microflora changes during Korean native soy-sauce fermentation, J Korean Agric Chem Soc, 14(2), p137-143.
- Lersen, M, Poll, L, (1992), Odour thresholds of some important aroma compounds in strawberries, Z Lebensm Unters Forsch, 195, p120-123.
- Ministry of Food and Drug Safety, (2017), Korea food code, MFDS, Seoul, Korea, p129-130.
-
Nickerson, GB, Likens, ST, (1966), Gas chromatography evidence for the occurrence of hop oil components in beer, J Chromagr A, 21, p1-5.
[https://doi.org/10.1016/s0021-9673(01)91252-x]

- Park, HK, Sohn, KH, Park, OJ, (1997), Analysis of significant factors in the flavor of traditional Korean soy sauce (Ⅲ) - aroma compound analysis -, Korean J Diet Cult, 12(2), p173-182.
- Schaeffer, AB, Fulton, MD, (1933), A simplified method of staining endospores, Science, 7, p194.
-
Sookkheo, B, Sinchaikul, S, Phutrakul, S, Chen, ST, (2000), Purification and characterization of the highly thermostable proteases from Bacillus stearothermophilus TLS33, Protein Expr Purif, 20, p142-151.
[https://doi.org/10.1006/prep.2000.1282]

- Yoo, SK, Cho, WH, Kang, SM, Le, SH, (1999), Isolation and identification of microorganisms in Korean traditional soybean paste and soybean sauce, Korean J Appl Microbiol Biotechnol, 27(2), p113-117.
- Yang, EJ, Chang, HC, (2007), Characterization of bacteriocinlike substances produced by Bacillus subtilis MJP1, Korean J Microbiol Biotechnol, 35(4), p339-346.