곰보배추 추출물의 항산화 활성 및 MCF-7 유방암세포에서의Apoptosis 유도 효과
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0), which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Breast cancer is one of the most common cancers in women. On the other hand, severe side effects associated with current chemotherapy are still a problem in breast cancer treatments. Therefore, potential drug targets, such as phytochemicals, are needed to prevent and treat breast cancer. This study examined the antioxidant and potential anti-cancer activity of Salvia plebeia R. Br (SP) extract against MCF-7 human breast cancer cells. The SP extract contained a large amount of total flavonoids and total polyphenol as well as free radical scavenging capacity towards ABTS+ and DPPH. The SP extract decreased the cell viability of MCF-7 cells significantly at 0.2, 0.4, and 0.8 mg/mL for 48h and 72h. MCF-7 cells treated with the SP extract showed the typical morphological hallmarks using DAPI staining. To confirm the apoptotic activity, the pro-apoptotic and anti-apoptotic proteins were measured by western blot analysis. The protein expression of Bax, proteolytic activation of caspase–3. −9, cleaved poly(ADP-ribose) polymerase (PARP), Bak, and p53 were increased and Bcl-2 was inhibited after the SP extract treatment compared to the control. Furthermore, the SP extract suppressed the expression of the phospho-Akt in MCF-7 cells. These results suggest that the SP extract has potential for the treatment of breast cancer.
Keywords:
Salvia plebeia R. Br, antioxidant activity, apoptosis, breast cancer cellsI. 서론
유방암은 여성에게 주로 발병되는 암으로, 2015년 발표된 자료에 따르면 우리나라 여성의 유방암 발병률은 갑상선암 다음으로 높다(National Cancer Information Center 2015). 유방암을 일으키는 요인은 나이, 성별, 가족력, 여성호르몬 등으로 알려져 있으며, 특히 고지방, 고단백질 등의 고칼로리 식사를 하는 경우나 운동 부족 등을 보일 때 발병률이 높다(Paik 2014). 유방암의 치료는 외과적 수술이나 방사선 요법 등의 국소적요법, 화학요법과 호르몬요법 등의 전신요법이 있으며 치료를 위해 Tamoxifen과 같은 항암제 투여를 할 경우, 정상세포에 영향을 주어 심각한 부작용 및 내성을 일으키는 등의 문제점이 제기되고 있어 새로운 치료법의 모색이 필요한 실정이다(Paik 2014). 최근 유방암의 예방 및 치료를 위해 상대적으로 부작용이 적은 식품 내 생리활성물질에 대한 관심이 높아지고 있으며, 주로 암의 성장 및 전이 억제, apoptosis 유도 등에 미치는 영향 등의 연구가 활발히 진행 중에 있다(Lee et al. 2011). 이 중 apoptosis는 세포사멸에 이르는 능동적인 반응으로 암 치료를 위한 중요한 표적 중 하나이다. Apoptosis는 세포막에 존재하는 수용체에 의한 외인성 경로(extrinsic pathway)와 미토콘드리아와 관련된 내인성 경로(intrinsic pathway)로 나눌 수 있으며, 이러한 경로를 통해 caspase를 활성화시켜 apoptosis 정도를 파악할 수 있다(Evans 1993). 또한 apoptosis는 세포의 생성 및 제거 조절을 위해 중요한 역할을 하며, 활성산소에 의한 산화적 스트레스의 체내 조절은 apoptosis를 통한 암세포의 증식 또는 사멸에 중요한 역할을 한다고 알려져 있다(Ozben 2007).
곰보배추(Salvia plebeia R. Br.)는 꿀풀과에 속하는 한해 또는 두해살이 풀로 잎의 모양이 배추 잎과 비슷하다하여 붙여진 이름으로 배암차즈기, 뱀배추, 설견초, 동생초 등으로 불리기도 한다(Jeong et al. 2015). 주로 인도, 일본, 중국 및 한국 등의 여러 곳에 서식하는 식물로 가을부터 봄 사이에 뿌리부터 잎 모두가 약초로 사용된다고 알려져 있다(Sales et al. 2010; Nugroho et al. 2012). 최근 곰보배추를 이용한 연구로는 항비만(Choi et al. 2016), 항인플루엔자(Bang et al. 2018) 역할 뿐만 아니라 아토피성 피부염(Choi et al. 2014), 천식(Choi et al. 2015) 등에 효과적이라고 보고되었다. 곰보배추에 포함된 성분으로는 세스퀴테르펜, flavonoids, phenol성 물질, 지방족 화합물(Gu et al. 2011; Jin et al. 2015; Tripathi et al. 2006) 등이 함유되어 있어 항산화 작용과 같은 여러 가지 생리활성을 나타낸다.
이에 본 연구에서는 곰보배추 추출물에 함유되어있는 항산화 활성을 측정하고, 유방암세포주를 이용하여 곰보배추 추출물에 의해 발현되는 apoptosis 유도에 대해 알아보고자 하였다. 이러한 결과를 통해 곰보배추가 인체에 안전하고 부작용이 적은 천연 소재로서 유방암 증식을 억제하는 효과 가능성을 확인하였다.
Ⅱ. 연구방법
1. 실험재료
본 실험에 사용된 곰보배추는 제주시 조천읍에 소재한 제주발효명가에서 유기농으로 재배된 것을 2017년 8월에 구입하여 사용하였다. 곰보배추의 뿌리는 제거하고 잎을 깨끗이 수세하였다. 곰보배추 잎을 냉동시킨 후 동결건조기(ED 8512, IlshinBioBase Co., Ltd., Yangju, Korea)를 이용하여 72시간 동안 동결건조 하였다. 동결건조가 끝난 시료는 분쇄기(HR1378, Philips N.V., Karner, Slovenia)를 이용하여 분쇄한 후 시료분말을 –70℃ deep freezer(MDFU52V, Sanyo Electric Co., Ltd., Osaka, Japan)에 보관하였다.
2. 시료추출
건조된 곰보배추 분말 100 g에 80% 에탄올 1.5 L를 첨가한 후 65℃의 heating mantle(Mtops ms-265, Seoul, Korea)에 환류냉각관을 부착하여 3시간씩 3회 반복 추출하였다. Whatman filter paper (Whatman No. 2)로 곰보배추 추출액을 여과한 후 여액을 rotary vacuum evaporator(VACUUM NVC-1100, EYELA Co., Ltd., Tokyo, Japan)를 이용하여 40℃ 수욕상에서 감압ㆍ농축한 후에 동결건조 하였다. 시료는 –70℃에 보관하여 사용하였다.
3. 총 polyphenol 함량 및 총 flavonoid 함량 측정
총 polyphenol 함량은 Folin-Denis의 방법(1912)에 따라 곰보배추 잎 에탄올 추출물을 1 mg/mL 농도로 조제하여 사용하였다. 시료 0.5 mL와 Folin reagent (Sigma-Aldrich Inc., St. Louis, MO, USA)를 0.5 mL를 혼합하여 3분간 실온에서 반응시킨 후, 10% Na2CO3용액 0.8 mL를 넣고 40분간 암소에서 반응시켰다. UV-spectrophotometer(Bio-Rad Laboratories, Inc., Hercules, CA, USA)를 이용하여 760 nm에서 흡광도를 측정하고, 표준물질로 tannic acid(Sigma, St. Louis, MO, USA)를 이용하여 표준검량곡선을 적용하여 곰보배추 추출물의 총 polyphenol 함량을 산출하였다. 총 flavonoid 함량은 Davis법을 변형한 Chae 등의 방법(2002)에 따라 측정하였다. 시료 0.5 mL와 diethylene glycol(Sigma, St. Louis, MO, USA)을 0.5 mL를 넣고 1N NaOH 10 µL을 첨가한 후 37℃ heating block에서 1시간 반응시켰다. UV-spectrophotometer(Bio-Rad, Hercules, CA, USA)를 이용하여 420 nm에서 흡광도를 측정하고, 표준물질로 rutin(Sigma, St. Louis, MO, USA)를 이용하여 표준검량곡선을 적용하여 곰보배추 추출물의 총 flavonoid 함량을 산출하였다.
4. DPPH 라디칼 소거능 측정
곰보배추 추출물의 0.2 mM 2,2-diphenyl-1-picryhydrazyl(DPPH) 라디칼 소거능은 Blois의 방법(1958)을 이용하여 다음과 같이 측정하였다. 에탄올에 0.2 mM DPPH 시약(Sigma, St. Louis, MO, USA) 900 µL에 농도별 시료 100 µL를 첨가하여 37℃ heating block에 30분간 반응시켰다. 96 well plate에 200 µL씩 분주하고 UV-spectrophotometer (Bio-Rad, Hercules, CA, USA)를 이용하여 517 nm에서 흡광도를 측정하였다.
5. ABTS+ 라디칼 소거능 측정
곰보배추 추출물의 ABTS+ 라디칼 소거능은 Re의 방법(1999)을 변형하여 다음과 같이 측정하였다. 7 mM 2,2-azinobis-3-ethylbenzothiazoline-6-sul fonic acid(ABTS)시약(Sigma, St. Louis, MO, USA)에 2.4 mM potassium persulfate를 혼합하여 암소에서 24시간 반응시킨다. 반응이 끝난 ABTS시약 900 µL에 농도별 시료 100 µL를 첨가하여 37℃ heating block에 30분간 반응시킨 후, 96 well plate에 200 µL씩 분주하여 UV-spectrophotometer(Bio-Rad, Hercules, CA, USA)로 734 nm에서 흡광도를 측정하였다
6. 세포배양
실험에 사용된 인체 유방암세포주 MCF-7은 한국세포주은행(Korean Cell Line Bank, Seoul, Korea)으로부터 분양받아 본 실험실에서 배양하여 사용하였다. MCF-7 세포는 1% penicillin/streptomycin과 10% fetal bovine serum (FBS)을 포함한 RPMI 1640 배지(Gibco-BRL, Grand Island, NY, USA)를 사용하여 37℃, 5% CO2 incubator(MCO-18AIC, Sanyo, Osaka, Japan)에서 배양하였다.
7. MTS assay
MCF-7 세포를 96 well plate에 2×103/well로 분주하여 24시간 배양한 후, dimethyl sulfoxide(DMSO)에 녹인 곰보배추 추출물을 0.2, 0.4, 0.8 mg/mL의 농도로 처리하였다. 48시간 및 72시간 경과 후에 CellTiter 96® AQueous One Solution Cell Proliferation Assay(MTS) 용액(Promega Co., CA, USA)을 각 well에 20 µL씩 첨가하고 37℃, 5% CO2 incubator에서 4시간동안 반응시킨 후, UV-spectrophotometer(Bio-Rad, Hercules, CA, USA)를 이용하여 490 nm에서 흡광도를 측정하였다.
8. MCF-7 세포 형태 관찰
MCF-7 세포를 60 mm dish에 5×105cell/well이 되도록 분주하여 37℃, 5% CO2 incubator(MCO-18AIC, Sanyo, Osaka, Japan)에서 24시간 배양한 후 곰보배추 추출물을 0.2, 0.4, 0.8 mg/mL로 처리하고 72시간동안 반응시켰다. 광학현미경(CKX41, OLIMPUS Co., Tokyo, Japan)을 이용하여 100배율로 농도에 따른 암세포 형태 변화를 관찰하였다.
9. DAPI stainning
MCF-7 세포를 12 well plate에 1x105/well로 분주하고 안정화시킨 후, 곰보배추 추출물을 0.2, 0.4, 0.8 mg/mL 처리하고 37℃, 5% CO2 incubator (MCO-18AIC, Sanyo, Osaka, Japan)에서 배양하였다. 72시간 후, 배지를 제거하고 phosphate buffered saline(PBS)로 세척한 후에 4% paraformaldehyde solution(Biosesang, Seongnam, Korea)을 첨가하여 1시간동안 실온에서 고정시하였다. 이 후 상층액을 제거하고 0.5% Triton X-100 solution(Sigma, St. Louis, MO, USA)을 첨가한 후. 4’, 6-diamidino-2-phenylindole(DAPI) staining 용액(Vector laboratories, Burlingame, CA, USA)을 처리하여 염색한 후 암실에서 형광현미경(BX41, OLIMPUS, Tokyo, Japan)을 이용하여 200배의 배율로 apoptosis 형태 변화를 관찰하였다.
10. Western blotting
곰보배추 추출물을 처리한 MCF-7 세포의 apoptosis 관련 단백질의 발현을 확인하기 위하여 Western blotting을 수행하였다. 곰보배추 추출물을 농도별로 처리한 세포를 회수하여 lysis buffer(150 mM NaCl, 0.1% SDS, 1% Triton X-100, and 50 mM Tris-Hcl, pH 8.0)를 첨가하고 4℃에서 30분간 반응시킨 후 14,000 rpm에서 25분 동안 원심분리하여 상층액을 분리하였다. 단백질 농도는 Bradford assay(Bio-Rad, CA, USA)를 사용하여 정량하였고, sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE)에서 전기영동하여 분리한 후에 polyvinylidene difluoride(PVDF) membranes(Bedford, MA, USA)에 옮겼다. Transfer가 끝난 membrane을 5% skim milk를 이용하여 1시간동안 blocking한 후 1차 antibody를 넣고 4℃에서 24시간 반응시킨 후, 2차 antibody를 사용하여 실온에서 1시간 반응시켰다. 반응이 끝난 후 암실에서 enhanced chemiluminoesence solution (Amersham Biosciences Co., Buckinghamshire, UK)을 이용하여 필름에 노출시켜 단백질 발현을 확인하였다. 단백질 분석을 위해 사용된 Akt, phospho-Akt, poly(ADP-ribose) polymerase(PARP), Bak, Bcl-2, p53, caspase-3, caspase-8, caspase-9, β-actin등 1차 antibody 및 horseradish peroxidase (HRP)-conjugated anti-mouse 항체는 Santa Cruz (Santa Cruz Biotechnology Inc., CA, USA)에서 구입하여 사용하였다.
11. 통계처리
모든 실험은 독립적으로 3회 반복을 통해 얻었으며, 각 실험군 간의 유의성 검증은 GraphPad Prism 6 program (GraphPad Software, Inc., La Jolla, CA, USA)을 이용하여 평균 (mean)과 표준편차 (SD)로 나타내었다. 각 시료간의 통계적 유의성은 p<0.05 수준에서 Student t-test를 이용하여 유의성을 검정하였다.
Ⅲ. 결과 및 고찰
1. 총 polyphenol 및 총 flavonoid 함량
식물체에 존재하는 polyphenol류와 flavonoid류는 대표적인 항산화성 물질이며, 항균, 항암 등의 다양한 생리활성을 나타내는 것으로 알려져 있다(Ames et al. 1987). 본 연구에 사용된 곰보배추 에탄올 추출물의 수율은 33.22%로 나타났으며, 총 polyphenol 함량은 330.46 mg TAE/g, 총 flavonoid 함량은 256.61 mg RE/g였다(Table 1). Joo(2013)의 연구의 의하면, 꿀풀과에 속하는 황금 추출물의 총 polyphenol 및 총 flavonoid 함량은 각각 103.53 mg TAE/g과 101.98 mg RE/g으로 본 연구와의 차이를 보였다.
2. DPPH 및 ABTS+ 라디칼 소거능
활성산소는 에너지 생성을 위한 산화과정 등에서 발생하게 되며, 과도하게 많아진 활성산소는 체내에 작용하는 방어기전을 파괴하여 노화 및 암 등에 광범위하게 적용되는 원인이 된다(Rice-Evans et al. 1996). 따라서 질병의 예방을 위해 항산화능을 보유한 다양한 생리활성 후보물질의 확인이 매우 중요하다고 할 수 있겠다. 본 연구 결과, 곰보배추 에탄올 추출물을 이용한 DPPH 라디칼 소거능은 0.125 mg/mL, 0.25 mg/mL, 0.5 mg/mL, 1 mg/mL 농도에서 각각 15.11%, 35.17%, 57.70%, 61.76%, ABTS+ 라디칼 소거능은 각각 41.39%, 80.51%, 94.66%, 94.71%를 보여주었다(Table 2). 50%의 라디칼 소거능의 값인 IC50을 구한 결과, DPPH의 IC50은 0.42 mg/mL, ABTS의 IC50은 0.20 mg/mL로 나타났다. 꿀풀과에 속하는 들깨 새싹 추출물의 DPPH 라디칼 소거능은 0.5 mg/mL 농도에서 83.2%, ABTS 라디칼 소거능은 79.4%로 나타나 본 연구결과보다 높은 함량에서 동일한 효과를 나타내었다(Jeong et al. 2014).
3. 곰보배추 추출물이 유방암세포의 성장에 미치는 영향
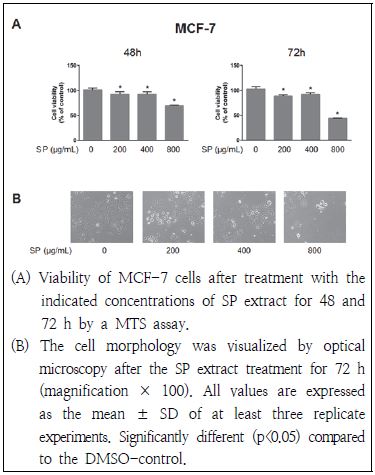
곰보배추 추출물이 인체 유방암세포인 MCF-7 세포의 성장에 미치는 영향을 MTS assay를 통해 측정하였으며 그 결과는 Fig. 1과 같다. MCF-7 세포에 48시간 또는 72시간 동안 곰보배추 추출물을 0.2 g/mL, 0.4 mg/mL 및 0.8 mg/mL 농도 처리 하였을 경우, 암세포의 성장이 유의적으로 억제되는 효과를 나타내었다. Hwang et al.(2013)은 꿀풀과에 속하는 황금 추출물을 Caki-1 신세포암 세포주에 48시간 처리한 경우, 0.2 g/mL 농도에서부터 세포증식억제 효과를 보였으며 0.8 g/mL 농도에 이르러 약 72%의 증식억제 효과를 나타낸다고 하여 본 연구 결과와 유사함을 보였다. 또한 72시간 동안 곰보배추 추출물 처리에 따른 MCF-7 세포주의 형태학적인 변화를 살펴보았을 때, 곰보배추 추출물의 처리농도가 증가할수록 세포 형태 변화가 심하고 세포가 잘 부착되지 않았으며 세포의 수도 감소함을 관찰하였다(Fig. 1B).
4. DAPI 형광염색을 이용한 apoptosis 확인
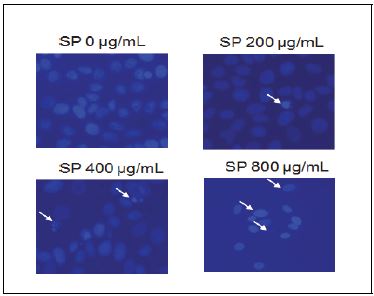
조절되지 않는 세포 분열과 apoptosis의 억제는 암의 주요한 특징이다(Vidya et al. 2010). 본 연구에서는 곰보배추 추출물에 의한 유방암세포의 증식 억제가 apoptosis에 의한 효과인지 확인하기 위해 DAPI staining을 실시하였다. Apoptosis 현상에 의해 nucleosome의 linker DNA 부분이 절단되고 단편화되어 염색질의 응축에 의한 apoptotic body가 생성되며, 이들은 염색시약에 의해 관찰 가능하다(Shi et al. 1994). 본 연구 결과, 유방암세포에 72시간 동안 곰보배추를 처리했을 경우, 곰보배추를 처리하지 않은 군에 비해 곰보배추 처리군에서 농도가 증가할수록 핵의 응축 및 분절(apoptotic body)이 증가하는 것을 확인하였다(Fig. 2).
5. 곰보배추 추출물이 유방암세포의 caspase 발현에 미치는 영향
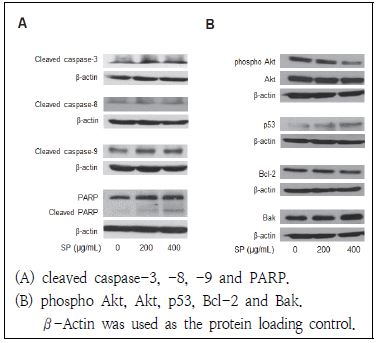
Apoptosis 유발에 있어서 중요한 조절 역할을 하는 것으로 알려진 caspase는 핵과 mitochondria의 외막에 불활성화 상태인 pro-enzyme 형태로 존재하다가, apoptosis 유도 활성화 신호에 의해 protease로 전환된다(Cohen 1997). 이들 caspase는 initiator caspase(caspase-8과 -9)와 effector caspase(caspase-3)로 구분되어지며, 특히 caspase-3는 initiator caspase인 caspase 8과 9에 의해 활성화되어 다른 여러 가지 기질 단백질의 분해를 일으키는 중요한 요인으로 알려져 있다(Cohen 1997; Li et al. 2008). 본 연구에서는 MCF-7 유방암 세포에 곰보배추 추출물을 농도별로 처리하였을 경우 caspase의 단백질 활성에 미치는 영향에 대해 알아보고자 하였다. 본 연구 결과, 활성형의 caspase-8은 곰보배추 추출물에 의해 단백질 발현에 큰 차이를 나타내지 않았으나, 활성형의 caspase-3 및 caspase-9의 단백질발현은 농도 의존적으로 증가함을 보였다(Fig. 3A). 또한 곰보배추 추출물에 의해 caspase-3의 기질단백질로 DNA repair와 genomic stability에 관여하는 PARP 단백질의 단편화 현상이 관찰되었다. 따라서 본 연구 결과, 곰보배추 추출물은 caspase-8과 caspase-9의 활성화에 의해 외인성 경로와 내인성 경로 모두를 통해 MCF-7 유방암세포의 apoptosis를 유도한다고 사료된다.
6. p53 및 Bcl-2 family 단백질 발현에 곰보배추 추출물이 미치는 영향
p53은 종양 억제 유전자로 알려져 있으며, 활성화된 p53은 세포주기 억제 단백질인 p21, Bcl-2 family인 Bax 등의 단백질 발현을 증가시키고 caspase 활성을 유도해 apoptosis를 유발한다(Gross et al. 1999). 또한 Bcl-2 family는 anti-apoptotic(Bcl-2, Bcl-xL)과 pro-apoptotic(Bax, Bak, Bid) 단백질이 서로 균형을 이루며, 세포 내 여러 자극에 의해 균형이 깨질 경우에는 pro-apoptotic 단백질의 발현이 증가하여 미토콘드리아의 막전위의 변화로 미토콘드리아내막에서 cytochrom C가 방출 된다(Conseiller et al. 1998). 본 연구 결과, MCF-7 유방암 세포에 곰보배추 추출물을 처리하였을 경우, p53의 단백질 발현이 증가함을 보였으며, anti-apoptotic 단백질인 Bcl-2의 발현이 감소하고 pro-apoptotic 단백질인 Bak의 경우는 증가함을 보였다(Fig. 3B). Haldar et al.(1994)의 연구에 의하면, MCF-7 유방암주의 p53에 돌연변이가 일어날 경우 Bcl-2의 발현이 감소함이 관찰되었다. 위와 같은 결과로 볼 때, 본 연구에 사용된 곰보배추가 유방암 세포주의 p53과 Bcl-2 family 단백질 발현에 관여하여 apoptosis를 유발하였다고 할 수 있겠다.
7. PI3K/Akt 경로의 발현에 미치는 곰보배추 추출물의 영향
본 연구에서는 곰보배추 추출물에 의한 apoptosis 유발 중, phosphatidylinositol 3 kinase(PI3K)/Akt 세포신호전달계에 미치는 영향에 대해 조사하고자 하였다. PI3K/Akt는 serine/threonine 인산화에 관여하며 활성화에 따라 세포의 증식 및 분화와 세포 주기 등에 관여하는 것으로 알려져 있다(Osaki et al. 2004). 이들의 활성화는 pro-apoptosis나 caspase-9 발현을 저해하여 apoptosis를 억제하는 것으로 알려져 있다(Hwang et al. 2013). 본 연구에서는 유방암 세포주에 곰보배추 추출물 0.2 g/mL, 0.4 mg/ mL 농도로 처리하였을 때, Akt의 단백질 변화는 관찰되지 않았으나, 인산화된 Akt의 발현이 감소하는 것을 확인 할 수 있었다(Fig. 3B). 이에 곰보배추가 MCF-7 유방암세포의 apoptosis와 연관된 PI3K/Akt 세포신호전달계와 관련되어 있음을 보여주었다.
Ⅳ. 요약 및 결론
본 연구는 곰보배추 추출물을 이용하여 총 polyphenol 및 총 flavonoid 함량, DPPH와 ABTS+ assay를 이용한 free radical 소거능을 측정하고, 인체 유래 유방암세포인 MCF-7 세포를 사용하여 곰보배추 추출물 처리에 의해 유발되는 유방암 세포의 증식 억제와 apoptosis 유도 작용기전에 관하여 연구하였다. 실험 결과, 총 polyphenol 함량은 330.46 mg TAE/g, 총 flavonoid 함량은 256.61 mg RE/g로 측정되었으며, DPPH와 ABTS+ assay를 이용한 IC50는 각각 0.42 mg/mL와 0.2 mg/mL로 나타났다. 곰보배추 추출물(0.2, 0.4, 0.8 mg/mL)에 의해 유방암세포의 증식이 억제되었고, apoptosis에 의한 세포질의 응축과 핵이 분절되는 apoptotic body가 형성됨을 관찰하였다. Apoptosis와 관련된 단백질의 발현을 관찰하고자 western blotting을 수행한 결과, 곰보배추 추출물에 의해 활성화된 형태인 cleaved caspase-3 및 -9의 단백질발현과 PARP의 절단 현상이 증가함을 보였다. 또한 pro-apoptotic 단백질인 Bak와 p53의 발현이 곰보배추 추출물에 의해 농도 의존적으로 증가되었고, anti-apoptotic 단백질인 Bcl-2의 발현이 감소되었으며 PI3K/Akt 경로의 발현이 억제됨을 확인하였다. 이상의 결과를 통하여 곰보배추 추출물은 높은 항산화활성을 가지고 있으며, 유방암세포에서 apoptosis 유발에 의한 항암효과를 가지고 있는 것으로 사료되며, 향후 암의 예방 및 치료를 위한 기초자료로 사용될 수 있을 것으로 사료된다.
Acknowledgments
This research was supported by grants from National Research Foundation of Korea(NRF-2017R1C1B1007646)
References
- Ames, BN, Saul, RL, (1987), Oxidative DNA damage, cancer and aging, Ann Inter Med, 107, p536-539.
-
Bang, S, Li, W, Ha, TKQ, Lee, C, Oh, WK, Shim, SH, (2018), Anti-influenza effect of the major flavonoids from Salvia plebeia R.Br. via inhibition of influenza H1N1 virus neuraminidase, Nat Prod Res, 32(10), p1224-1228.
[https://doi.org/10.1080/14786419.2017.1326042]

-
Bolois, MS, (1958), Antioxidant determination by the use of a stable free radical, Nature, 181, p1199-1200.
[https://doi.org/10.1038/1811199a0]

- Chae, SK, Kang, GS, Ma, SJ, Bang, KW, Oh, MW, Oh, SH, (2002), Standard food analysis, Paju, Jigu-Moonwha Sa, p381-382.
-
Choi, JK, Oh, HM, Lee, S, Kwon, TK, Shin, TY, Rho, MC, Kim, SH, (2014), Salvia plebeia suppresses atopic dermatitis-like skin lesions, Am J Chin Med, 42(4), p967-985.
[https://doi.org/10.1142/S0192415X1450061X]

- Choi, JK, Oh, HM, Park, JH, Choi, JH, Sa, KH, Kang, YM, Park, PH, Shin, TY, Rho, MC, Kim, SH, (2015), Salvia plebeia extract inhibits the inflammatory response in human rheumatoid synovial fibroblasts and a murine model of arthritis, Phytomed, 42(4), p967-985.
-
Choi, SI, Cho, IH, Han, SH, Jeon, YJ, Choi, JG, Kim, JS, Lee, JH, (2016), Antiobesity effects of Salvia plebeia R. Br. extract in high-fat diet-induced obese mice, J Med Food, 19(11), p1048-1056.
[https://doi.org/10.1089/jmf.2016.3763]

- Cohen, GM, (1997), Caspases: the executioners of apoptosis, Biochem J, 326(1), p1-16.
-
Conseiller, E, Debussche, L, Landais, D, Venot, C, Maratrat, M, Sierra, V, Tocque, B, Bracco, L, (1998), CTS1: a p53-derived chimeric tumor suppressor gene with enhanced in vitro apoptotic properties, J Clin Invest, 101(1), p120-127.
[https://doi.org/10.1172/JCI1140]

-
Evans, VG, (1993), Multiple pathways to apoptosis, Cell Biol, 17(5), p461-476.
[https://doi.org/10.1006/cbir.1993.1087]

- Folin, O, Denis, W, (1912), On phosphotungasticphospho molybdic compounds as color regents, J Biol Chem, 12(2), p239-249.
-
Gross, A, McDonnell, JM, Korsmeyer, SJ, (1999), BCL-2 family members and the mitochondria in apoptosis, Genes Dev, 13(15), p1899-1911.
[https://doi.org/10.1101/gad.13.15.1899]

-
Gu, L, Weng, X, (2001), Antioxidant activity and components of Salvia plebeia R. Br.,—a Chinese herb, Food Chem, 73(3), p299-305.
[https://doi.org/10.1016/S0308-8146(00)00300-9]

- Haldar, S, Negrini, M, Monne, M, Sabbioni, S, Croce, CM, (1994), Down-regulation of bcl-2 by p53 in breast cancer cells, Cancer Res, 54(8), p2095-2097.
- Hwang, WD, Im, YG, Son, BY, Park, C, Park, DI, Choi, YH, (2013), Induction of Apoptosis by Ethanol Extract of Scutellaria baicalensis in Renal ell Carcinoma Caki-1 Cells, J Life Sci, 23(4), p518-528.
- Jeong, JS, Kim, YJ, Ahn, EK, Shin, JY, Go, GB, Son, BG, (2015), Antioxidative Activities and Qualitative Characteristics of Substitute Tea using Salvia plebeia R. Br, Korean J Food Cook Sci, 31(1), p41-52.
- Jeong, SI, Kim, HS, Jeon, IH, Kang, HJ, Mok, JY, Cheon, CJ, Yu, HH, Jang, SI, (2014), Antioxidant and Anti-inflammatory Effects of Ethanol Extracts from Perilla frutescens, Korean J Food Sci Technol, 46(1), p87-93.
-
Jin, MR, Xu, H, Duan, CH, Shou, GX, (2015), Two new flavones from Salvia plebeian, Nat Prod Res, 29(14), p1315-1322.
[https://doi.org/10.1080/14786419.2014.999241]

-
Joo, SY, (2013), Antioxidant Activities of Medicinal Plant Extracts, J Korean Soc Food Sci Nutr, 42(4), p512-519.
[https://doi.org/10.3746/jkfn.2013.42.4.512]

-
Lee, KW, Bode, AM, Dong, Z, (2011), Molecular targets of phytochemicals for cancer prevention, Nat Rev Cancer, 11(3), p211-218.
[https://doi.org/10.1038/nrc3017]

-
Li, J, Yuan, J, (2008), Caspases in apoptosis and beyond, Oncogene, 27(48), p6194-6206.
[https://doi.org/10.1038/onc.2008.297]

- National Cancer Information Center, (2015), Cancer fact and figures 2015 in the Republic of Korea, Available from https://www.cancer.go.kr [cited 2018 April 23].
-
Nugroho, A, Kim, MH, Choi, J, Baek, NI, Park, HJ, (2012), In vivo sedative and gastroprotective activities of Salvia plebeia extract and its composition of polyphenols, Arch Pharm Res, 35(8), p1403-1411.
[https://doi.org/10.1007/s12272-012-0810-7]

-
Osaki, M, Oshimura, M, Ito, H, (2004), PI3K-Akt pathway: Its functions and alterations in human cancer, Apoptosis, 9(6), p667-676.
[https://doi.org/10.1023/B:APPT.0000045801.15585.dd]

-
Ozben, T, (2007), Oxidative stress and apoptosis: impact on cancer therapy, J Pharm Sci, 96(9), p2181-2196.
[https://doi.org/10.1002/jps.20874]

-
Paik, NS, (2014), Current status of breast cancer in Korea, Ewha Med J, 37(2), p69-74.
[https://doi.org/10.12771/emj.2014.37.2.69]

-
Re, R, Pellegrini, N, Proteggente, A, Pannala, A, Yang, M, Rice-Evans, C, (1999), Antioxidant activity applying an improved ABTS radial cation decolorization assay, Free Radic Biol Med, 26(9-10), p1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Rice-Evans, CA, Miller, NJ, Paganga, G, (1996), Structure-antioxidant activity relationships of flavonoids and phenolic acids, Free Radic Biol Med, 20(7), p933-956.
[https://doi.org/10.1016/0891-5849(95)02227-9]

- Sales, F, Hedge, IC, Christie, F, (2010), Salvia plebeia R. BR.: Taxonomy, Phytogeography, Autogamy and Myxospermy, Pak J Bot, 42, p99-110.
-
Shi, L, Nishioka, WK, Th’ng, J, Bradbury, EM, Litchfield, DW, Greenberg, AH, (1994), Premature p34cdc2 activation required for apoptosis, Sci, 263(5150), p1143-1145.
[https://doi.org/10.1126/science.8108732]

- Tripathi, SK, Asthana, RK, Ali, A, (2006), Isolation and characterization of 5-ethylhentriacontane and nonacosane from Salvia plebeia, Asian J Chem, 18, p1554-1556.
-
Vidya Priyadarsini, R, Senthil Murugan, R, Maitreyi, S, Ramalingam, K, Karunagaran, D, Nagini, S, (2010), The flavonoid quercetin induces cell cycle arrest and mitochondria‐mediated apoptosis in human cervical cancer (HeLa) cells through p53 induction and NF-kappaB inhibition, Eur J Pharmacol, 649(1–3), p84-91.
[https://doi.org/10.1016/j.ejphar.2010.09.020]