유산균 측정을 위한 형광측정법의 안전성 평가
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The intrinsic fluorescence method is effective for microbial identification and characterization, but there is a need for such a method for monitoring fermentation-related bacteria in fermented food. This methodology is based on monitoring live bacteria that contain a variety of intracellular biomolecules harboring specific emitting photons following excitation by ultraviolet (UV) radiation that characterize their intrinsic fluorescence; however, UV photons can damage cells. Therefore, a safety assessment of the developed method is required before it is used in the food industry to distinguish and enumerate food-associated bacteria. In this study, six lactic acid bacteria (LAB) strains were exposed to UV for four weeks (total irradiation time: 3,009 min) and their safety, including hemolytic activity, undesirable biochemical characteristics, and antibiotic resistance, was evaluated. Moreover, LAB growth inhibition by a UV treatment was also investigated. The results indicated that the six UV-treated LAB strains did not pose any health risk, as they were not hemolytic, exhibited no undesirable biochemical activity, and no antibiotic resistance. Nevertheless, prolonged UV radiation (3,009 min) caused LAB growth inhibition, and that the effect was different depending on the LAB strain and LAB culture medium. Among the six LAB strains, the growth of two strains cultivated in MRS at −1.5℃ was inhibited by long-term UV radiation. On the other hand, the same treatment with UV radiation did not affect the growth of any of the six strains cultivated in kimchi filtrate. Therefore, the intrinsic fluorescence method can be used safely in the food (kimchi) industry for the identification of LAB strains and monitoring their growth during fermentation.
Keywords:
safety assessment, fluorescence method, monitoring, lactic acid bacteriaI. 서론
살아있는 세균들은 세포내에 수많은 생물학적 분자를 지니고 있고, 이들 중에는 특정 파장의 에너지를 조사받으면 특정 파장에서 발광하는 특성을 지닌 물질이 있다(Ammor 2007). 이와 같은 생물학적 특성을 나타내는 물질은 tryptophan, tyrosine, phenylalanine과 같은 방향족 아미노산, 핵산, NAD(P)H와 같은 조효소(co-enzyme) 등이며, 이 물질들은 250~450 nm의 파장을 조사받으면 280~540 nm 파장에서 발광하는 것으로 알려지고 있다(Cantor & Schimmed 1980). 이에 이와 같은 특징을 이용하여 특정 세균을 계수(enumeration)하거나 동정(identification)하는 방법으로 활용하고자 하는 연구들이 수행되고 있다(Leblanc & Dufour 2002; Ammor 2007; Tourkya et al. 2009). 즉, 세균이 포함된 시료에 특정 파장을 조사한 후 특정 파장에서 발광되는 빛의 강도를 측정하는 방식으로 시료 내 어떤 세균이 존재하며(identification) 동시에 얼마만큼의 세균이 존재하는지 계수하는 것이다. 이 방법은 기존에 알려진 미생물 계수법이나 동정법에 비하여 시료에 직접 접촉할 필요도 없고, 시료 내 세균이 자랄 때까지 기다릴 필요도 없고, 반응 시약도 필요 없으며, 빠르고 간단하고, 낮은 비용으로, 그리고 무엇보다 신뢰도가 높은 결과를 얻을 수 있다는 장점을 지닌다(Ammor 2007). 현재까지 이루어진 연구성과들은 이 방법을 활용하여 수질에서 미생물 오염 측정, 식품에서 유해 세균의 오염 등을 측정하는 것과 관련된 연구가 주를 이루고 있다(Ju & Trivedi 1992; Lee et al. 2002; Leriche et al. 2004; Huang & Ju 2007). 또한 이 방법의 적용으로 유해세균 뿐만 아니라 유산균과 같은 유용한 세균들을 검출하고, 더 나아가 속(genus), 종(species), 아종(subspecies) 수준까지 동정이 가능할 수 있는 수단이 될 수 있음이 보고되기도 하였다(Ammor et al. 2004). 그러나 이와 같은 형광측정법에 의한 미생물 생육 측정은 대부분 배지 내에서 이루어진 결과이다. 이 방법은 향후 다양한 식품, 특히 발효 식품 등에서 발효에 따른 미생물의 생육정도를 측정하는 목적 등에도 활용될 수 있어, 그 필요성이 지속적으로 언급되고 있다(Genot et al. 1992; Marangoni 1992). 예를 들어 우리나라 전통 발효 식품인 김치나 발효 유제품 등에서 중요한 역할을 하는 유산균에 형광측정법을 적용하여 발효 식품에서부터 직접 발효 유산균을 계수할 수 있고, 더 나아가 어떠한 속과 종이 발효 식품 내 우점을 이루는지 정확히 분석할 수 있다면 그 활용도 및 중요성은 매우 클 것이다.
한편, 발효 식품 등과 같은 식품 산업에 이 방법이 실제로 적용할 때 고려되어야 하는 점은 자외선이 조사된 발효 미생물을 식품과 더불어 소비자가 직접 섭취하게 된다는 것이다. 자외선은 파장의 길이에 따라 long wave UV-A (315~400 nm), medium wave UV-B (280~315 nm), short wave UV-C (100~280 nm) 3종으로 나뉘게 된다(Svobodova et al. 2006). UV-B는 가장 파괴적인 형태의 자외선광이며 생물 조직에 심각한 유해 작용을 미칠 수 있으며 UV-A는 상대적으로 유해도가 거의 없는 자외선 광원이다(Alexander 1998; Svobodova et al. 2006). 그러므로 유산균 발효 식품 내 유산균의 검출 및 속ㆍ종에 따른 측정을 형광측정법으로 실시하기 전, 선행되어야 할 연구는 형광 측정 시 사용되는 조사 자외선 광에 대한 미생물(유산균)의 안전성 평가이다.
본 연구의 궁극적인 목표는 형광측정법을 사용하여 유산균의 증식과 더불어 김치의 발효 숙성 정도를 모니터링 하고자 함이다. 그러나 이를 적용하기 전 자외선 조사 방식과 같은 방법을 실제 식품(김치)에 적용 시 균주의 돌연변이 발생에 의하여 유산균이 기존에는 없던 유해한 형질을 나타낼 수 있는지, 그 가능성에 대한 과학적 검증을 하고자 하였다. 이에 본 연구에서는 김치 발효에 중요한 역할을 하며 동시에 김치 발효ㆍ숙성 중 우점종으로 검출되는 것으로 알려진 Lactobacillus 속, Leuconostoc 속, Weissella 속(Jung et al. 2014)에 대하여 각 2종씩 총 6종의 유산균에 자외선(355 nm)을 지속적으로 노출시킨 후, 균주의 안전성 평가를 수행하였다. 즉, 자외선 노출 유ㆍ무에 따라 균주의 생육도, 용혈성, 효소활성, 항생제 내성 등의 특성이 어떻게 달라지는지를 조사하여 형광측정법이 유산균에 미치는 특성에 대한 안전성 평가를 수행하였다.
Ⅱ. 연구방법
1. 사용 균주
김치에서 분리된 유산균 Lactobacillus plantarum HD1(Ryu et al. 2014), Lactobacillus sakei SC1(Moon et al. 2015), Leuconostoc citreum GR1(Moon et al. 2018), Leuconostoc mesenteroides TA(Lee & Chang HC 2016), Weissella koreensis SK(Kim 2015), Weissella cibaria EB1(Chae et al. 2018) 6종을 사용하였다. 유산균은 deMan Rogosa and Sharpe(MRS; Difco, Sparks, MD, USA) 배지에 30℃에서 24시간 동안 배양하여 사용하였다. 용혈성 검사를 위하여 β-hemolysis 양성균주인 Bacillus cereus ATCC 14579 균주(Lee & Chang 2017)를 사용하였다. B. cereus ATCC 14579는 LB 배지에 37℃에서 24시간 동안 배양하였다.
2. 자외선(355 nm) 노출
미생물(세균)의 형광측정법은 측정하고자 하는 생물학적 분자에 따라 250~450 nm의 파장을 조사하면 280~540 nm 파장에서 발광이 일어나고 이 발광의 세기를 측정하는 방법이다(Cantor & Schimmed 1980). 이 중 조효소인 NADH 측정에는 355 nm를 조사(emission)한 후 460 nm에서 발광(excitation)되는 정도를 측정하는 형광측정법이 많이 사용되어진다(Kasimova et al. 2006; Blacker et al. 2014).
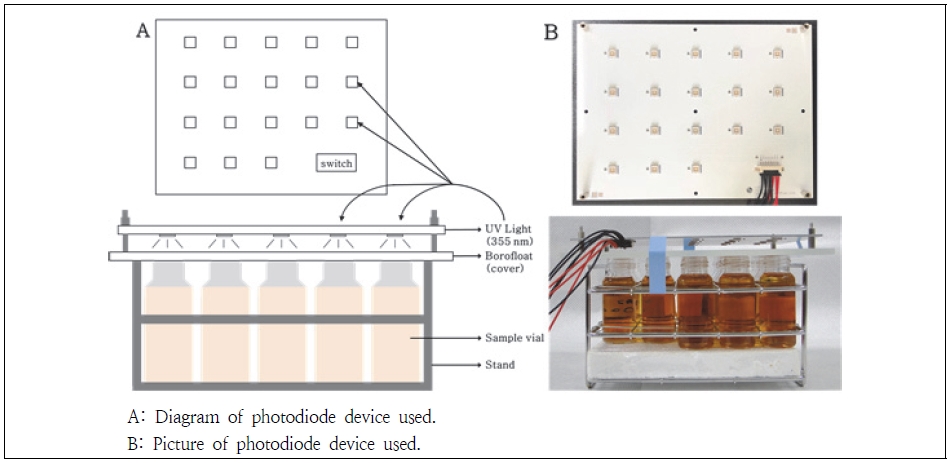
본 연구에서는 355 nm의 지속적인 자외선 조사가 유산균 특성에 미치는 영향을 연구하고자 하였다. 이때, 조사 시간과 더불어 자외선 조사 시 균주의 배양온도 및 영양물에 따른 영향도 동시에 살펴보았다. 본 실험에 사용된 자외선 조사 장치는 Fig. 1과 같이 제작하여 사용하였다.
MRS 액체배지에 6종 유산균을 각각 초기 접종 농도 약 5 log CFU/mL 로 접종한 후, 30℃에서 24시간 동안 배양하였다. 유산균의 배양동안 355 nm의 자외선 조사 스위치를 5분 동안 켜고 155분 동안 끄는 동작을 10회 반복하여, 총 자외선 조사시간을 50분에 이르게 하였다. 이는 유산균이 배지에 접종되어 24시간 동안 배양되는 동안 lag-log-stationary-death phase에 이르는 생육 전주기 동안 고르게 자외선(355 nm)에 노출되게 하기 위하여 설계된 실험이다.
자외선 조사가 미생물에 미치는 영향 중 미생물의 영양원은 자외선 노출에 대한 영향을 더 심각하게 하거나 이와 반대로 완충 보호 작용을 할 수도 있다. 이에 실험 균주를 유산균 전용 배지인 MRS에서 배양하면서 자외선을 조사하는 것과 더불어 김치여액 내에서 유산균을 배양하면서 자외선 조사 실험을 동시에 수행하였다.
MRS 배양과 김치여액 배양을 위하여 MRS 액체배지와 김치여액에 6종의 유산균을 각각 약 5 log CFU/mL로 접종한 후 배양하였다. 김치여액 내 배양을 위하여 김치를 2분 동안 마쇄 후(Handblender; Hanil, Seoul, Korea) 멸균된 거즈로 걸러서 김치여액을 준비하였다. MRS 액체배지와 김치여액에 균주 접종 후 김치냉장고 보관모드(-1.5℃)에서 4주 동안 배양 시 6종의 유산균 생육은 균종에 따라 다소 차이가 있으나, 최대 6.9~8.8 log CFU/mL의 생육도를 나타내는 결과에 따라(Kim 2015; Kim 2017) 자외선 노출에 따른 배양기간은 MRS 배양, 김치여액 배양 모두 김치냉장고 보관모드(-1.5℃)에서 4주 동안으로 하였다. 이때, 자외선 조사가 세포에 미치는 영향은 생육시기에 따라 달라질 수 있으므로 자외선 조사는 생육 전주기에 노출되도록 하였다. 즉, 자외선 조사 스위치는 10분 동안 켜고 124분 동안 끄는 동작을 301회 반복하여 총 3,009분 동안 조사하였다.
3. 효소 활성 측정
효소활성 측정은 API-ZYM kit(BioMérieux, Lyon, France)를 사용하여 제조사의 사용방법에 따라 수행하였다. 유산균 배양액을 원심분리(13,475 xg, 15 min, 4℃)하여 균체를 회수한 후 멸균수로 현탁액을 준비하였다. 각 cuple에 5 Mcfarland에 탁도를 맞춘 현탁액을 65 μL씩 떨어뜨린 후, 4시간 동안 37℃에서 암실에 배양 시킨 후, ZYM-A시약과 ZYM-B시약을 각각 떨어뜨려서 결과를 판독하였다. 판정 방법은 색의 변화 정도를 관찰하여 0~5까지의 값으로 표시하여 반응이 3 이상이면 양성으로 판정하였다(0 = 0 nM, 1 = 5 nM, 2 = 10 nM, 3 = 20 nM, 4 = 30 nM, 5 ≥ 40 nM). 활성 측정 효소는 alkaline phosphatase, esterase, esterase lipase, lipase, leucine arylamidase, valine arylamidase, cystine arylamidase, trypsin, α-chymotrypsin, acid phosphatase, naphthol-AS-BI-phosphohydrolase, α-galactosidase, N-acetyl-β-glucosaminidase, β-glucuronidase, β-galactosidase, α-fucosidase, α-glucosidase, β-glucosidase, α-mannosidase 총 19종이였다.
4. 용혈성 검사
Blood agar base(Oxoid, Hampshire, England)를 멸균한 후에 7% horse blood(Oxoid)를 첨가하여 용혈성 배지(horse blood agar)를 만들어서 시료를 백금이로 획선 도말하였다. 유산균을 획선 도말한 배지는 30℃에서, B. cereus ATCC 14579는 37℃에서 24시간 동안 배양 후에 적혈구 용혈에 의한 균체 주위의 투명환 생성 여부를 확인하여 hemolysis 음성 또는 양성을 판정하였다.
5. 항생제 내성 검사
자외선(355 nm) 조사 유ㆍ무에 따른 항생제 내성의 변화를 측정하기 위하여 액체배지 희석법(Broth microdilution method)을 이용하였다(Choi & Chang 2015). European Food Safety Authority(EFSA 2012)에 따라 항생제 8종(ampicillin, vancomycin, gentamycin, kanamycin, streptomycin, erythromycin, tetracycline, chloramphenicol)에 대하여 MIC(Minimum inhibitory concentration)를 측정하였으며, 항생제는 규정된 용매에 녹인 후 사용하였다. 항생제 내성을 측정하기 위해서 MH(Mueller-Hinton, Difco) 액체배지에 0.5% dextrose를 첨가한 MH 액체배지에 현탁하여 단계별로 준비한 항생제에 접종하여 30℃에서 24시간 동안 배양하였다. 배양 후 생육정도를 spectrophotometer(Ultra spec 2100 pro, Amersham Bioscience, Bristol, UK)를 사용하여 600 nm에서 배양액의 흡광도를 측정하였다. 이때, EFSA(2012)의 규정을 참고하여 배양액에서 균주가 증식하지 않는 최소 생육 저해 농도를 결정하였다. Weissella 속은 EFSA(2012)에서 제공하는 항생제 종류별 break point에 대한 guide line이 현재 제공되지 않아서 기존에 보고된 연구논문들의 결과(Muñoz-Atienza et al. 2013; Anandharaj et al. 2015; Jeong & Lee 2015; Choi et al. 2018)와 비교하였다.
6. 유산균의 생육도 측정
자외선(355 nm) 노출 시험에 따라 자외선에 노출된 유산균 배양액을(MRS 또는 김치여액) 배양 완료 한 후, MRS 액체배지에 1% 접종하여 30℃에서 30시간 동안 배양하면서 6시간마다 생균수를 측정하였다. 이때 대조구로는 동일한 배양 조건에서 자외선 노출만을 하지 않은 유산균 배양액으로 하여, 자외선 노출 유무에 따른 유산균 생육도의 차이를 비교하였다.
7. 통계처리
SPSS 23.0 statistics 프로그램(SPSS Inc., Chicago, IL, USA)을 이용하여 평균과 표준편차를 구하였다. 두 시료 간의 유의성 검정은 독립 t-test(independent t-test)로 시행하였다.
Ⅲ. 결과 및 고찰
1. 효소 활성
유산균 6종을 30℃ MRS 액체배지에서 그리고 –1.5℃ 김치여액에서 각각 배양하면서 자외선을 조사한 후, 자외선 조사에 따른 효소활성의 차이를 대조구(자외선 무처리구)와 비교하였다. 실험에 사용된 6종의 유산균 MRS 배양구와 김치여액 배양구 모두에서 자외선 조사 유ㆍ무에 상관없이 동일한 효소 활성을 나타내었다(Table 1).
본 실험에서 측정된 19개 효소 중 β-glucuronidase와 α-chymotrypsin 활성은 장에 유해한 영향을 끼치는 것으로 알려진 효소이다(Ryu & Chang 2013). 본 실험에서는 6종의 유산균 모두 자외선 조사 전ㆍ후 모두 이 두 효소의 활성은 없는 것으로 나타났다.
2. 용혈성
적혈구의 부분적 용혈을 일으키는 α-hemolysis나 완전한 용혈을 일으키는 β-hemolysis 검사를 수행하였다. MRS와 김치여액에서 배양한 6종의 유산균 모두 자외선 노출 유ㆍ무와 상관없이 용혈성 배지(horse blood agar)에서 투명환을 생성하지 않아 용혈성이 나타나지 않음을 확인하였다. 그러나 용혈성 양성 대조구로 사용된 B. cereus ATCC 14579는 용혈성 배지 위의 집락 주변에 투명환을 생성하였다(data not shown).
3. 항생제 내성
MRS나 김치여액에서 배양된 6종의 유산균 모두 자외선 노출 전ㆍ후 8종의 항생제에 대하여 동일한 MIC 값을 나타내었다(Table 2). 유산균 Lactobacillus 속과 Leuconostoc 속에 해당하는 4종의 유산균은 EFSA에서 제시한 유산균 속과 종에 따른 항생제의 break point 보다 같거나 낮은 MIC 값을 나타내었고, 자외선(355 nm) 조사에 의해 항생제 내성이 더 올라가는 현상은 관찰되지 않았다. Weissella 속은 주로 김치에서 검출되는 유산균으로 발효 유제품에서는 잘 쓰이지 않기 때문에 Weissella 속의 경우는 EFSA에서 제시하는 break point 값이 없다.
이에 본 연구에서는 기존에 타 연구들에서 보고된 W. koreensis 와 W. cibaria에 대한 8종의 항생제에 대한 MIC를(Muñoz-Atienza et al. 2013; Anandharaj et al. 2015; Jeong & Lee 2015; Choi et al. 2018) 비교 기준값으로 설정하였다. Table 2에 보여진 바와 같이 본 연구에서 사용된 W. koreensis SK와 W. cibaria EB1은 타 연구의 MIC 값들보다 더 낮은 값을 나타내었고, 특히 자외선 조사 유ㆍ무에 따른 차이도 발생하지 않았다. 또한 사용 배지(MRS와 김치여액)에 따른 MIC 값도 동일하게 나타났다. 본 연구 결과로부터 지속적인(50~3,009분) 자외선 조사를 유산균 배양 온도(30℃, -1.5℃)와 배지 영양원(MRS, 김치여액)에 따라 시행하였을 때 유산균의 용혈성, 유해효소활성, 항생제 내성과 같은 유해한 특성 변화는 관찰되지 않음을 알 수 있었다.
4. 자외선 조사가 유산균의 생육에 미치는 영향
유산균 6종을 각각 MRS 배지에 접종(5 log CFU/mL)한 후, 30℃에서 24시간 배양하면서 자외선을 총 50분간 조사하였다. 자외선 조사가 완료된 후 배양액의 1%를 다시 MRS 액체배지에 접종하여 30℃에서 30시간 배양 한 후, 이때의 총 생균수를 측정하였다(Table 3). 그 결과 유산균 6종 모두 자외선 노출 유ㆍ무에 따른 생균수의 차이는 관찰되지 않았다.
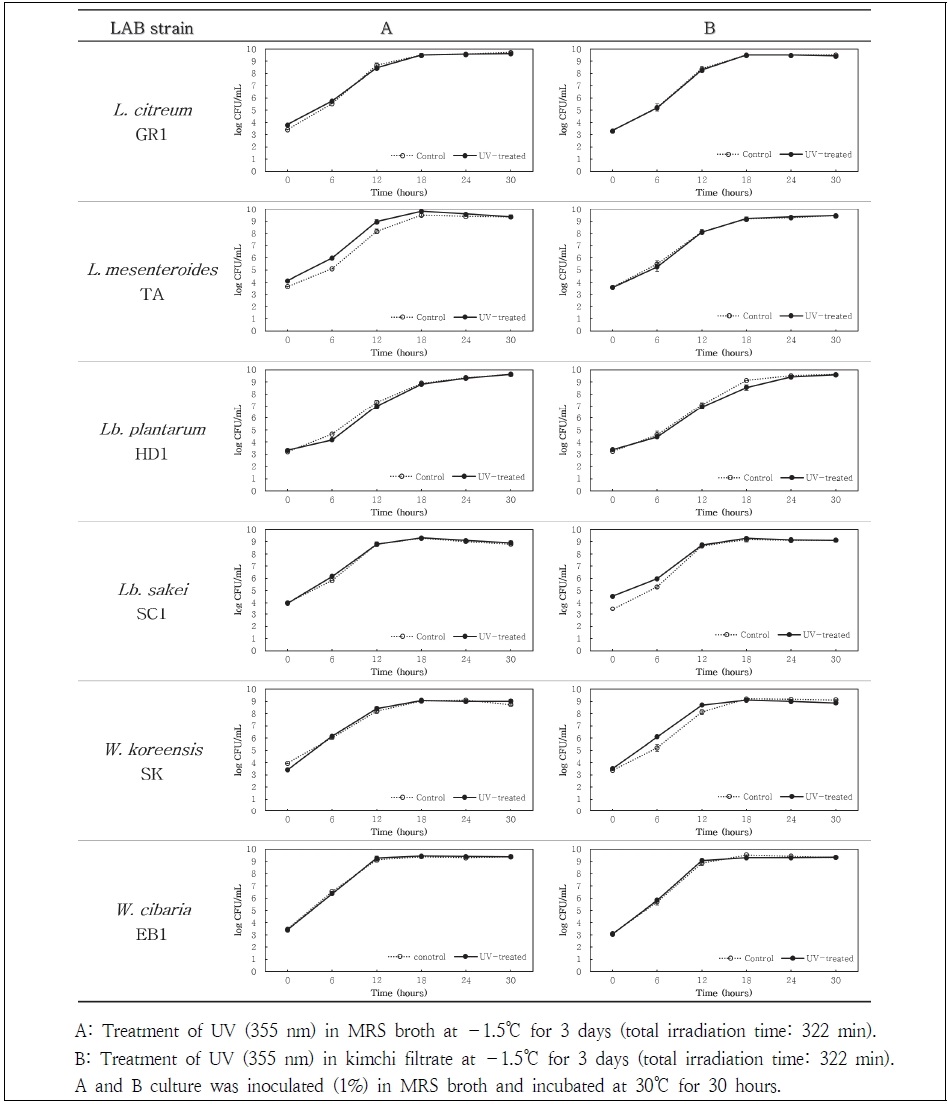
유산균 6종을 김치여액과 MRS 배지에 5 log CFU/mL로 각각 접종 후, 김치냉장고 보관 모드인 –1.5℃에서 4주 동안 배양하면서 자외선을 조사하였다. 자외선 조사가 유산균 생육에 미치는 영향과 더불어 조사시간에 따른 영향을 살펴보기 위하여, 배양 3일(자외선 조사시간: 총 322분)과 배양 4주(자외선 조사시간: 총 3,009분)된 MRS와 김치여액 배양액을 각각 MRS 액체배지에 1% 접종하여 30℃에서 0~30시간 동안 배양하면서 매 6시간 마다 생균수를 측정하였다. 이때, 동일 조건에서 자외선 조사 처리를 하지 않은 유산균 배양액을 대조구로 삼아 총 생균수 및 균 생장 속도를 비교하였다. Fig. 2에 보여지는 바와 같이 유산균 6종 모두 김치여액과 MRS 배지에서 각각 배양 3일 된(자외선 조사시간: 322분) 시료에서는 자외선 노출 유ㆍ무에 따른 차이 없이 유사한 생육도를 나타내었다.
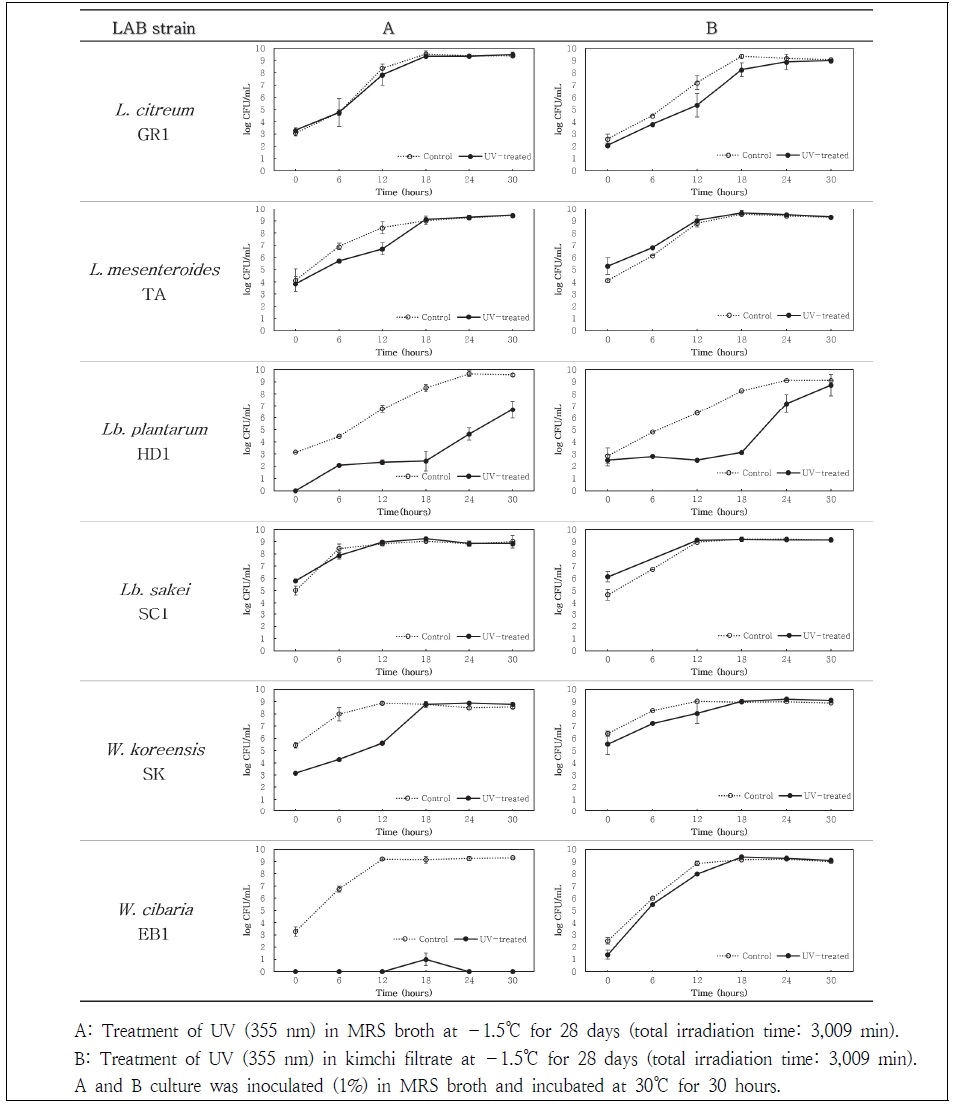
Fig. 3에 보여지는 바와 같이 배양 4주 시료의(자외선 조사시간: 3,009분) 경우에는 본 연구에 사용된 6종의 유산균 중 2종의 유산균, W. cibaria EB1과 Lb. plantarum HD1에서 자외선 처리구의 생육도가 낮아짐을 확인할 수 있었다. 이러한 현상은 자외선 노출 시 사용된 배지에 따라 그 결과가 크게 다르게 나타났다(Fig. 3-A, B). 즉, MRS 배지에서 자외선 조사를 받은 경우(Fig. 3-A) W. cibaria EB1은 대부분 모두 사멸되어 이를 다시 MRS 배지에 접종하여 30℃에서 30시간 배양하였을 때 균체 생육 관찰을 거의 할 수 없었다. Lb. plantarum HD1은 W. cibaria EB1 보다 그 영향이 훨씬 약하지만 자외선 처리에 의해 생균수가 많이 낮아졌음을 확인할 수 있었다(무처리구: 5.1 log CFU/mL, 처리구: 1.5 log CFU/mL). 이와 같이 자외선 처리된 Lb. plantarum HD1을 MRS 액체배지에 다시 접종(1%)하여 30℃에서 30시간 배양 후 생육도를 측정하였을 때 자외선 무처리구보다도 낮은 생육도(무처리구: 9.6 log CFU/mL, 처리구: 6.7 log CFU/mL)를 나타내었다(Fig. 3-A).
그러나 사용배지가 김치여액인 경우(Fig. 3-B) 자외선 조사(3,009분)에도 W. cibaria EB1과 Lb. plantarum HD1의 생존율은 자외선 무처리구와 유사하게 나타났다. 특히 W. cibaria EB1의 경우에는 자외선 조사 시 MRS 배지 사용에서는 배양 4주 후 균의 생육도가 관찰되지 않음에 비하여, 김치여액 사용에서는 자외선 조사 후 이 시료를 다시 MRS에 접종 후 30℃에서 배양 시 자외선 무조사구와 거의 유사한 패턴의 생육도를 나타내었다. Lb. plantarum HD1은 김치여액에서 자외선 조사 후 이를 다시 MRS에 접종하여 30℃에서 배양 시 접종 균수는 자외선 조사 유ㆍ무에서 거의 비슷한 생균수를 나타내었다(Fig. 3-B). 그러나 이후 자외선 조사구는 lag에서 log phase로 진입하는데 훨씬 많은 시간이 소요되어 자외선 무처리구가 배양 21~24시간 만에 stationary phase에 도달함에 비해 자외선 처리구는 배양 30시간 만에 stationary phase에 도달하였다. 그러나 최종 최대 생균수는 자외선 처리 유ㆍ무구 모두 비슷한 생균수(9.1~9.2 log CFU/mL)를 나타내었다.
이와 같은 결과로부터 자외선(355 nm)의 장시간(3,009분) 처리는 유산균의 생육을 억제하거나 사멸을 유도할 수도 있음을 알 수 있었다. 그러나 그 정도는 유산균의 종류에 따라 크게 달라서, 자외선의 장시간 노출이 유산균의 생육에 별 영향을 미치지 않는 균종(L. citreum GR1, L. mesenteroides TA, Lb. sakei SC1, W. koreensis SK)과 크게 생육이 저해되거나 아예 사멸되는 균종(Lb. plantarum HD1, W. cibaria EB1)으로 다르게 나타났다. 이와 더불어 자외선 조사 시 사용된 배지에 따라 자외선 노출에 대한 영향이 다르게 나타남을 알 수 있었다. 즉, 유산균 전용 배지인 MRS 배지에 배양된 경우는 유산균의 생육이 억제되거나(Lb. plantarum HD1) 사멸되는(W. cibaria EB1) 균종이 관찰되었지만, 김치여액에서 배양된 경우 실험에 사용된 대부분의 유산균에서 자외선 조사가 별다른 생육저해 현상을 유도하지 못하는 것으로 나타났다. 김치여액 배양에서 자외선 조사에 의하여 가장 크게 영향을 받는 것으로 나타난 Lb. plantarum HD1 김치여액배양의 경우, 자외선 처리 후 초기에 균의 생육이 다소 늦게 증식되어 stationary state에 도달하는데 좀 더 늦게(6시간) 도달하였지만, 최종 생육도는 동일한 값(9.1~9.2 log CFU/mL)을 나타내었다. 이와 같은 현상은 유산균 배양 시 사용된 배지 성분에 따른 생육과 세포 완충작용에 기인한 결과로 추측된다. 유산균 전용배지인 MRS 배지는 유제품 기원 유산균의 생리ㆍ생화학적 특성에 맞춤화된 배지 조성으로서 proteose peptone No.3 10.0 g/L, beef extract 10.0 g/L, yeast extract 5.0 g/L, dextrose 20.0 g/L, polysorbate 80 1.0 g/L, ammonium citrate 2.0 g/L, sodium acetate 5.0 g/L, magnesium sulfate 0.1 g/L, manganese sulfate 0.05 g/L, dipotassium phosphate 2.0 g/L 와 같은 성분과 함량으로 구성되어 있다. 이에 반해 김치여액은 배추 71.95%, 무 9.55%, 찹쌀풀, 고춧가루, 마늘, 파, 생강, 멸치액젓, 새우젓, 양파, 부추 또는 갓, 재제소금, 백설탕 등으로 구성되어 균체 생육에 필요한 탄소원, 질소원 및 미량무기원소의 근원(source)과 함량이 다르다는 것을 알 수 있다. 본 연구에서 김치여액에서 배양된 유산균이 자외선 조사에 의한 영향을 덜 받는 이유는 본 연구에서 사용된 유산균 6종 모두 김치 유래 유산균으로써 김치 환경 하에서 생리적, 생화학적 특성이 최적화 되도록 오랜 시간 동안 적응되었거나, 또는 김치여액 성분이 위와 같은 자외선 조사로부터 유산균을 보호하는 완충작용에 기인한 것으로 유추할 수 있다.
향후 이에 대한 보다 명확한 과학적 규명이 요구되지만, 현 단계에서 김치의 숙성정도를 김치유산균의 생육측정에 의한 방법으로 하고자 할 때 NADH 형광측정법을 사용한다면 안전상 문제는 고려하지 않아도 될 것으로 사료된다.
Ⅳ. 요약 및 결론
NADH 형광측정법에 의한 미생물의 계수(enumeration) 및 동정(identification)은 간편하고, 빠르고, 저렴하면서도 신뢰도 높은 결과를 얻을 수 있다는 점에서 많은 연구가 이루어지고 있다. 그러나 이 방법은 실험실적 수준에서 검증되고 있는 수준으로 아직 식품에 적용되는 등 실용화 단계에 이르지 못하고 있다. 향후 이와 같은 기초 연구 결과들을 바탕으로 형광측정법을 사용하여 발효 식품에서 우점 미생물 종과 그 숫자를 계수할 수 있게 된다면 그 활용도 및 중요성은 매우 클 것이다.
본 연구에서는 유산균 생육을 monitoring하기 위하여 형광측정법을 사용하기 전, 이때 사용되는 자외선이 유산균에 미치는 영향을 조사하고자 하였다. 즉, 지속적인 자외선 조사에 따라 미생물의 돌연변이, 사멸 등이 일어 날 수 있으며 이러한 인위적 자외선 노출이 미생물의 원래 특성을 얼마만큼 변화시키며, 특히 그 변화가 미생물의 원래 특성에는 없던 유해한 형질 발현으로 귀결되는지에 대한 과학적 연구가 반드시 필요하기 때문이다. 이에 유산균에 자외선을(355 nm) 지속적으로 노출시킨 후 자외선 노출 유ㆍ무에 따라 균주의 생육도, 용혈성, 효소활성, 항생제 내성 등의 특성이 어떻게 달라지는지를 조사하여 형광측정법이 유산균에 미치는 특성에 대한 안전성 평가를 수행하였다.
본 연구 결과 형광측정법에 사용된 355 nm의 자외선 조사(50~3,009분)는 유산균의 유해 효소 활성, 용혈성, 항생제 내성 등에 어떠한 영향을 미치지 않는 것으로 나타났다. 한편, 자외선(355 nm)의 장시간(3,009분) 처리는 유산균의 생육을 억제하거나 사멸시킬 수도 있는 것으로 나타났다. 그러나 이러한 현상은 유산균의 종류에 따라 그 정도가 크게 다르고, 동시에 자외선 처리 시 사용된 배지에 따라서도 크게 달라짐을 알 수 있었다. 즉, 유산균 배지인 MRS 액체배지에서 자외선을 장시간 조사 시 일부 유산균에서 생육 저해 및 사멸현상이 관찰되었지만, 김치에서는 이러한 현상이 거의 관찰되지 않았고, 더 나아가 자외선 처리를 받고 생존된 균들에서 어떠한 유해한 특성이 촉발되지 않음을 검증하였다. 사용된 배지에 상관없이 단시간(322분) 조사 시에는 자외선 조사에 의한 유산균의 생육저해 현상은 일어나지 않았고, 일부 유산균의 생육저해 현상이 일어난 경우는 MRS 액체배지에서 자외선에 장시간(3,009분) 노출된 경우였다. 결론적으로 실제 식품에서 형광측정법을 사용 시에는 이렇게 장시간 자외선 노출이 되지 않는다는 점을 고려시 유산균 생육측정을 위한 형광측정법은 식품(김치)에 사용 가능한 안전한 방법으로 제안된다.
Acknowledgments
This research was supported by the 2018 research fund of LG electronics.
References
- Alexander DR(1998) Light measurement handbook: chap 1. What is light? 2nd ed. USA: International Light Inc. pp5-6
-
Ammor MS(2007) Recent advances in the use of intrinsic fluorescence for bacterial identification and characterization. J Fluoresc 17(5), 455-459.
[https://doi.org/10.1007/s10895-007-0180-6]

-
Ammor S, Yaakoubi K, Chevallier I, Dufour E(2004) Identification by flourescence spectroscopy of lactic acid bacteria isolated from a small-scale facility producing traditional dry sausages. J Microbiol Methods 59(2), 271-281.
[https://doi.org/10.1016/j.mimet.2004.07.014]

-
Anandharaj M, Sivasankari B, Santhanakaruppu R, Manimaran M, Rani RP, Sivakumar S(2015) Determining the probiotic potential of cholesterol-reducing Lactobacillus and Weissella strains isolated from gherkins (fermented cucumber) and south Indian fermented koozh. Res Microbiol 166(5), 428-439.
[https://doi.org/10.1016/j.resmic.2015.03.002]

-
Blacker TS, Mann ZF, Gale JE, Ziegler M, Bain AJ, Szabadkai G, Duchen MR(2014) Separating NADH and NADPH fluorescence in live cells and tissues using FLIM. Nat communications 5, 3936.
[https://doi.org/10.1038/ncomms4936]

- Cantor CD, Schimmed PR(1980) In: Cantor CR, Schimmel PR(eds) Biophysical chemistry. Part Ⅱ: Techniques for the study of biological structure and function. NY: Freeman, pp409-480
- Chae SJ, Jeon YB, Moon SH, Moon SY, Seo YJ, Choi HJ, Chang HC(2018) Characteristics of Lactobacillus sakei SC1 as a starter culture for kimchi. Proceedings of the Korean Society of Microbiology and Biotechnology, p373
-
Choi AR, Patra JK, Kim WJ, Kang SS(2018) Antagonistic activities and probiotic potential of lactic acid bacteria derived from a plant-based fermented food. Front Microbiol 9, 1963.
[https://doi.org/10.3389/fmicb.2018.01963]

-
Choi EA, Chang HC(2015) Cholesterol-lowering effects of a putative probiotic strain Lactobacillus plantarum EM isolated from kimchi. LWT-Food Sci Technol 62(1), 210-217.
[https://doi.org/10.1016/j.lwt.2015.01.019]

-
EFSA(2012) Guidance on the assessment of bacterial susceptibility to antimicrobials of human and veterinary important. EFSA J 10, 2740
[https://doi.org/10.2903/j.efsa.2012.2740]

- Genot C, Tonetti F, Montenay-Garestier T, Drapon R(1992) Front-face fluorescence applied to structural studies of proteins and lipid-protein interaction of visco-elastic food products. Sci Aliments 12(2), 199-212
-
Huang L, Ju LK(2007) Sludge settling and online NAD(P)H fluorescence profiles in wastewater treatment bioreactors operated at low dissolved oxygen concentrations. Water Res 41(9), 1877-1884.
[https://doi.org/10.1016/j.watres.2007.01.040]

-
Jeong DW, Lee JH(2015) Antibiotic resistance, hemolysis and biogenic amine production assessments of Leuconostoc and Weissella isolates for kimchi starter development. LWT-Food Sci Technol 64(2), 1078-1084.
[https://doi.org/10.1016/j.lwt.2015.07.031]

-
Ju LK, Trivedi HK(1992) Monitoring of denitrification by Pseudomonas aeruginosa using on-line fluorescence technique. Biotechnol Techniques 6(6), 549-554.
[https://doi.org/10.1007/BF02447830]

-
Jung JY, Lee SH, Jeon CO(2014) Kimchi microflora: history, current status, and perspectives for industrial kimchi production. Appl Microbiol Biotechnol 98(6), 2385-2393.
[https://doi.org/10.1007/s00253-014-5513-1]

-
Kasimova MR, Grigiene J, Krab K, Hagedorn PH, Flyvbjerg H, Peter E, Andersen PE, Møller IM(2006) The free NADH concentration is kept constant in plant mitochondria under different metabolic conditions. Plant Cell 18(3), 688-698.
[https://doi.org/10.1105/tpc.105.039354]

- Kim CR(2017) Change of lactic acid bacteria profile and identification of responsible microorganism for bitter taste during kimchi storage. Master’s Thesis, Chosun University
- Kim EJ(2015) Characterization of Weissella sp., Leuconostoc sp., and Lactobacillus sp. isolated from kimchi. Master’s Thesis, Chosun University
-
Leblanc L, Dufour É(2002) Monitoring the identity of bacteria using their intrinsic fluorescence. FEMS Microbiol Lett 211(2), 147-153.
[https://doi.org/10.1111/j.1574-6968.2002.tb11217.x]

-
Lee D, Song SH, Kim JH, Yoo YJ(2002) On-line monitoring of the denitrification process by measurement of NADH fluorescence. Biotechnol Lett 24(11), 949-952.
[https://doi.org/10.1023/A:1015577132408]

-
Lee SG, Chang HC(2017) Assessment of Bacillus subtilis SN7 as a starter culture for Cheonggukjang, a Korean traditional fermented soybean food, and its capability to control Bacillus cereus in Cheonggukjang. Food Control 73, 946-953.
[https://doi.org/10.1016/j.foodcont.2016.10.015]

-
Lee SH, Chang HC(2016) Isolation of antifungal activity of Leuconostoc mesenteroides TA from kimchi and characterization of its antifungal compounds. Food Sci Biotechnol 25(1), 213-219.
[https://doi.org/10.1007/s10068-016-0032-8]

-
Leriche F, Bordessoules A, Fayolle K, Karoui R, Laval K, Leblanc L, Dufour E(2004) Alteration of raw-milk cheese by Pseudomonas spp.: monitoring the sources of contamination using fluorescence spectroscopy and metabolic profiling. J Microbiol Methods 59(1), 33-41.
[https://doi.org/10.1016/j.mimet.2004.05.009]

-
Marangoni AG(1992) Steady-state fluorescence polarization spectroscopy as a tool to determine microviscosity and structural order in food system. Food Res Int 25(1), 67-80.
[https://doi.org/10.1016/0963-9969(92)90027-3]

-
Moon SH, Kim CR, Chang HC(2018) Heterofermentative lactic acid bacteria as a starter culture to control kimchi fermentation. LWT-Food Sci Technol 88, 181-188.
[https://doi.org/10.1016/j.lwt.2017.10.009]

-
Moon SH, Moon JS, Chang HC(2015) Rapid manufacture and quality evaluation of long-term fermented kimchi (mukeunji) using Lactobacillus sakei SC1. Food Sci Biotechnol 24(5), 1797-1804.
[https://doi.org/10.1007/s10068-015-0234-5]

-
Muñoz-Atienza E, Gómez-Sala B, Araújo C, Campanero C, Campo R, Hernandez PE, Herranz C, Cintas LM(2013) Antimicrobial activity, antibiotic susceptibility and virulence factors of lactic acid bacteria of aquatic origin intended for use as probiotics in aquaculture. BMC Microbiol 13(15), 1-22.
[https://doi.org/10.1186/1471-2180-13-15]

-
Ryu EH, Chang HC(2013) In vitro study of potentially probiotic lactic acid bacteria strains isolated from kimchi. Ann Microbiol 63(4), 1387-1395.
[https://doi.org/10.1007/s13213-013-0599-8]

-
Ryu EH, Yang EJ, Woo ER, Chang HC(2014) Purification and characterization of antifungal compounds from Lactobacillus plantarum HD1 isolated from kimchi. Food Microbiol 41, 19-26.
[https://doi.org/10.1016/j.fm.2014.01.011]

-
Svobodova A, Walterova D, Vostalova J(2006) Ultraviolet light induced alteration to the skin. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 150(1), 25-38.
[https://doi.org/10.5507/bp.2006.003]

-
Tourkya B, Boubellouta T, Dufour E, Leriche F(2009) Fluorescence spectroscopy as a promising tool for a polyphasic approach to Pseudomonad taxonomy. Curr Microbiol 58(1), 39-46.
[https://doi.org/10.1007/s00284-008-9263-0]