쇠미역사촌 추출물의 항산화 효과와 항균 효과
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study investigated the effect of Costaria Costata (C. Agardh) Saunders extracts on dermal cells. The total extract of C. Agardh Saunders was partitioned into the chloroform (CHCl3) and distilled water (DW) fractions. C. Agardh Saunders extracts did not show cytotoxicity on HaCaT human keratinocytes and B16F10 mouse melanoma cell lines at concentrations of 10 μg/mL, 20 μg/mL, and 40 μg/mL. Both the CHCl3 and DW extracts inhibited oxidative stress, and the effect was superior to glutathione, which was used as a positive control. Moreover, the DW extracts of C. Agardh Saunders inhibited melanin synthesis in the cells activated with α-melanocyte-stimulating hormone. The CHCl3 extracts of C. Agardh Saunders exhibited antibacterial effects toward Staphylococcus aureus, Staphylococcus epidermidis, and Pseudomonas aeruginosa. The CHCl3 fraction (Minimum Inhibitory Concentration, MIC: 0.5 mg/mL) of C. Agardh Saunders extracts was effective in terms of antibacterial activity against S. aureus. The present study suggests that applications of C. Agardh Saunders extracts can be used in terms of novel cosmetic materials as well as antibacterial food preservatives.
Keywords:
Antibacterial, Antioxidant, Costaria Costata (C. Agardh) SaundersI. 서론
오래 전부터 인류는 육상의 천연물로부터 여러 가지 항산화 물질을 선별하고 이용하여 왔다(Ryu et al. 2008). 그러나 육상보다 해양의 표면적은 지구의 70%를 차지할 정도 넓고 생물종의 80% 이상이 분포할 정도로 다양성이 있는 공간이다(Ahn et al. 2010). 해양생물은 육상생물과는 다른 고유의 대사 체계를 가지고 있으며 바다라는 독특한 환경에 적응하며 생존하고 있다. 해양생물의 대사산물은 양이 극히 적어 생리활성과 구조를 규명하기 어렵지만 서식환경의 독특함으로 인해 강력하고 다양한 생리활성을 갖춘 카로티노이드, 폴리페놀 등의 2차 대사산물을 포함하고 있다(Kim 2003; Bhaskar & Miyashita 2005; Kumar et al. 2008). 한국 지형의 삼면은 바다로 이루어져 있고 난류와 한류가 교차하기에 비교적 해조류가 풍부하게 서식하고 있다. 연안에 자생하는 해조류는 총 63과 178속 414종에 이르며 이 중에 홍조류는 32과 111속 247종, 갈조류는 17과 46속 95종, 녹조류는 11과 16속 61종, 남조류는 3과 5속 11종이다(Kang 1966; Park et al. 1976). 한국의 연안에 서식하고 있는 해조류 중에는 54종이 의학적으로 효능이 있다고 알려져 왔고 해조류 추출물이 항균, 항산화, 항염, 항암, 면역조절작용 및 항혈액응고에 관여하는 천연화합물을 포함하고 있다는 연구들도 있다(Oh et al. 1990; Kim et al. 2004; Smit 2004; Duan et al. 2006; Lee et al. 2006).
쇠미역사촌(Costaria Costata (C. Agardh) Saunders)은 일년생의 대형 갈조류로 다시마목(Laminariales) 다시마과(Laminariaceae)에 속한다. 배우체와 포자체가 세대교번하며 포자엽(sporophyll)이 없으나 엽상(blade)의 표면에 자낭반을 형성하고 절간생장(intercalary growth)을 한다(Han 2002; Choi et al. 2007). 일반적으로 수심 5~10 m에서 서식하는데 한국의 동해안 중북부의 조간대에서 많이 발견된다(Kim et al. 2006). 갈조류인 미역과 비교해서 줄기가 짧고 엽상(blade)이 직립하는 형태로 식감이 딱딱하고 질기나 맛이 독특하여 식용으로 선호되고 있다(Han 2002; Kim et al. 2006). 쇠미역사촌에 대한 연구는 거의 생장조건에 대한 연구(Park et al. 2011; Na et al. 2016)가 있으며 이 또한 많은 연구가 진행되지 못하고 있다. 쇠미역사촌 추출물의 효과에 대한 연구에는 메탄올을 통해 성분을 추출, 분석한 보고가 있는데 총 플라보노이드가 2.31 ± 011 mg/g이고 총 폴리페놀은 5.48 ± 0.11 mg/g이라고 하였다(Ahn et al. 2010). 그리고 쇠미역사촌을 포함한 해조류들에 대한 항산화와 항혈전, 멜라닌 합성 저해 효과를 살펴본 연구도 있다(Choi 2008; Ahn et al. 2010; Ahn et al. 2011). 그러나 쇠미역사촌 추출물을 이용한 효과에 대한 연구가 크게 부족하고 활성화 되고 있지 않는 상황이다. 따라서 앞선 효과적인 결과에 대한 계속적인 연구가 필요하여 본 연구를 통해 쇠미역사촌 추출물의 효과를 확인하고 이를 통해 화장품 원료로서 가능성을 살펴보고자 한다.
Ⅱ. 연구방법
1. 실험 재료
본 연구에서 사용되어진 쇠미역사촌은 2017년 3월, 부산시 기장군 일대에서 채취되어진 것을 구입하였다. 구입한 쇠미역사촌은 깨끗한 물로 염분을 제거하고 그늘에서 말려서 사용하였다. 쇠미역사촌의 화장품 원료로서의 가능성을 알아보기 위한 세포 실험에서는 각질형성세포인 HaCaT cell(Korea Cell Line Bank, Seoul, Korea)과 멜라노마 세포인 B16F10 cell(Korea Cell Line Bank, Seoul, Korea)이 이용되었다. 그리고 세포들은 Dulbecco’s modified Eagle’s medium(DMEM; HycloneTM, GE Healthcare Life Sciences, Utah, USA) 배지에 10% 우태아혈청(FBS, Fetal Bovine Serum, HycloneTM, GE Healthcare Life Sciences, Utah, USA)과 1% 항생제(AB, Antibiotics, HycloneTM, GE Healthcare Life Sciences, Utah, USA)를 첨가한 영양배지로 incubator(37℃, 5% CO2)에서 배양되었다. 세포의 세척을 위해서 Phosphate buffered saline(PBS; HycloneTM, GE Healthcare Life Sciences, Utah, USA)이 사용되었다. 시료의 독성은 CellTiter 96® AQueous One Solution Cell Proliferation Assay (Promega, Wisconsin, USA)를 통해서 MTS assay (3-(4,5-dimethylthiazol-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium,inner salt)를 시행하였다. 세포의 항산화 실험은 2’,7’–dichlorofluorescin diacetate(DCFDA) Cellular Reactive Oxygen Species (ROS) Detection Assay Kit(Abcam, Cambridge, UK)로 진행하였다. 양성대조군으로 glutathione(Sigma-Aldrich, St. Louis, USA)을 사용하였다. 멜라닌 합성 저해 실험은 α-MSH (Simga-Aldrich, St. Louis, USA)를 이용하였고 양성대조군은 Arbutin (Simga-Aldrich, St. Louis, USA)을 통해 효과를 관찰하였다. 항균 실험에는 그람양성균인 황색포도상구균(S. aureus, KCTC 1927; Korean Collection for Type Cultures, Jeongeup, Korea)과 표피포도상구균(S. epidermidis, KCTC 1917; Korean Collection for Type Culture, Jeongeup, Korea)을, 그람음성균인 녹농균(P. aeruginosa, KCTC 2004; Korean Collection for Type Culture, Jeongeup, Korea)과 대장균(E. coli, KCTC 2571; Korean Collection for Type Culture, Jeongeup, Korea)을 이용하였다. 박테리아들은 Luria-Bertai (LB) 액체 배지에 접종되고 shaking incubator(37℃, 200 rpm)에서 배양되었다. LB배지는 1L 기준으로 증류수 950 g, tryptone(BD Biosciences, San Diego, USA) 10 g, yeast extract (Duchefa Biochemie, RV Haarlem, Netherlands) 5 g, sodium chloride(NaCl; Sigma-Aldrich, St. Louis, USA) 10 g으로 만들었다. 그 외에 사용된 시약인 ethanol, chloroform, ethyl-acetate, hydrogen peroxide (H2O2), dimethyl sulfoxide(DMSO) 등은 대정화금(Daejeon, Korea)의 1급 시약이었다.
2. 기기
본 연구에서 사용된 기기에는 auto clave(DAE HAN BIO LINK CO., LTD., eumseong, Korea), CO2 incubator(MCO-175, SANYO Electric, Osaka, Japan), shaking incubator(VS-8480SF, Vision Scientific, Daejeon, Korea), rotary evaporator(Rotavapor R-114, BÜCHI Labortechnik AG, Flawil, Switzerland), micro highspeed centrifuge(Micro17TR, Hanil Science Industrial Co., Ltd., Gimpo, Korea), centrifuge (Union32R, Hanil Science Industrial Co., Ltd., Gimpo, Korea), shaker(BF-350SK, BioFree, Seoul, Korea), microplate reader(SynergyHT, BioTek Instruments, Winooski, USA) 등이 있다.
3. 추출
본 연구에서 사용된 쇠미역사촌은 건조하여 분말로 만든 후 플라스크에 85% 에탄올 1 L와 분말 100 g를 더하고 24 h 동안 외부의 빛을 차단하고 보관하였다. 이를 감압 여과와 농축의 과정을 통해 추출물을 얻었다. 이 과정을 3회 반복하여 1차 추출물을 얻고 추가로 클로로포름(CHCl3)과 증류수(DW)를 각각 300 mL씩 가하였다. 이를 분획 깔때기를 이용하여 CHCl3층과 DW층으로 분리한 후 다시 DW층에 에틸아세테이트(EtOAc)를 300 mL 더해 주어 분획하여 EtOAc층과 DW층을 얻었다. 추출을 통해 쇠미역사촌 CHCl3층의 추출물은 1.27 g(1.27%), DW층은 5.36 g(5.36%)를 얻었으나 EtOAc층은 실험이 진행될 만큼 추출물을 얻지 못하여 CHCl3층과 DW층의 추출물로 실험을 진행하였다.
4. 세포 생존율 실험
96 well plate에 HaCaT cell과 B16F10 cell을 각각 1.5×104cells/well로 분주한 후 incubator(37℃, 5% CO2)에서 24 h 동안 배양하였다. 추출물들을 DMSO에 용해하고 10 μg/mL, 20 μg/mL, 40 μg/mL 농도로 세포들에 처리한 후 24 h 동안 incubator에서 배양하였다. 배지를 둔 채로 MTS시약을 20 μL씩 첨가하고 incubator에서 3 h 동안 보관하면서 formazan의 상태를 관찰하였다. 이후 microplate reader기를 통해 495 nm에서 흡광도 값을 구하였다. 세포 생존율은 대조군에 대한 추출물 처리군들 간의 흡광도 차이를 백분율로 하여 나타내었다.
Cell viability (%) = (A/B) × 100
A: 추출물 처리군의 흡광도
B: 추출물 무처리된 DMSO 용매 대조군 흡광도
5. 항산화 실험
96 well plate에 HaCaT cell을 1.5×104cells/well로 분주하고 24 h 동안 incubator에서 배양하였다. PBS로 세척하여 phenol red를 제거하고 DCFDA를 well마다 20 μM로 처리한 다음 45 min 동안 incubator에서 보관하였다. PBS로 다시 세척한 후 H2O2(hydrogenperoxide) 500 μM을 10 μg/mL, 20 μg/mL, 40 μg/mL 농도의 추출물 처리군들에 가하고 45 min 간 다시 incubator에 보관하였다. Microplate reader기의 485/528 nm에서 형광값을 구한 후 대조군에 대한 추출물 처리군들의 값을 계산하여 이를 백분율로 나타내었다.
Relative activity (%) = (A/B) × 100
A: 추출물 처리군의 형광값
B: 추출물 무처리된 DMSO 용매 대조군 형광값
6. 멜라닌 합성 저해 실험
6 well에 B16F10 cell을 1×105cells/well로 분주하고 24 h 동안 incubator에서 배양하였다. 대조군 외의 추출물 처리군들에 DMEM(serum free)에 α-MSH(100 nM)를 용해한 배지를 30 min 동안 처리하였다. 추출물 처리군들의 배지를 그대로 둔 채로 추출물를 2배로 가한 후 48 h 동안 incubator에서 배양하였다. well들의 배지를 제거한 후 PBS로 세척하고 세포들을 원심분리(4℃, 3 min, 12,000 rpm)하였다. 상층액은 제거하고 세포의 pellet에 RIPA lysis buffer(Tris-Cl (pH 7.5) 50 mM, NP-40 1%, NaCl 50 mM, SDS 0.1%, sodium deoxycholate 0.5%, protease inhibitor cocktail (Roche, Switzerland))를 처리한 후 ice box에서 30 min 동안 보관하였다. 이를 다시 원심분리(4℃, 14,000 rpm, 10 min)한 다음 상층액을 제거하고 pellet만 둔 채로 60℃ oven에서 건조시켰다. 건조된 pellet에 2N NaOH 200 μL와 20% DMSO를 첨가하여 섞어준 후 60℃ oven에서 pellet을 완전 용해시켰다. 96 well에 용해물을 100 μL씩 담아 microplate reader기의 405 nm에서 흡광도 값을 측정하였다.
Relative activity (%) = (A/B) × 100
A: 추출물 처리군의 흡광도
B: 추출물 무처리된 DMSO 용매 대조군 흡광도
7. 항균 활성 실험
시험관에 액체 배지(LB 배지)를 5 mL씩 담고 Auto clave에서 멸균 처리하였다. 4종류의 균주들은 액체 배지에서 24 h 동안 배양된 뒤 고체 배지에 도말하여 24 h 동안 다시 배양하였다. 그 중에서 single strain를 따서 액체 배지에서 다시 18 h 동안 배양한 후 이를 사용하였다. 액체 배지 시험관에 배양된 균주들을 5 uL씩 처리하였다. 추출물들은 0.1 mg/mL, 0.2 mg/mL, 0.5 mg/mL의 농도로 처리되었다. 균주와 추출물들을 고루 섞은 시험관의 배지에서 100 uL씩 따서 96 well에 담고 microplate reader기의 600 nm에서 흡광도 값을 측정한 다음 이를 0 h의 값으로 하였다. 시험관들을 shaking incubator에서 보관하고 6 h 부터 3 h 간격으로 24 h 동안 흡광도를 측정하였다. 항균 효과는 0 h의 대조군 흡광도에 대한 각 시간대별 추출물 처리군들의 흡광도로 나타내어 농도와 시간대별에 대한 변화를 관찰하였다. 측정된 흡광도 값에 시료들의 색채값을 제한 값을 대조군 값에 대해 계산하여 효과값으로 하였다.
Relative activity (%) = (At-[A0-B0]/B0)×100
At: 추출물 처리군(균 접종 후 시간별 상태)의 흡광도
B0: 시료 무처리된 DMSO 용매 대조군의 흡광도 (0 h)
A0: 시료 처리군(균이 없는 상태)만의 흡광도 (0 h)
8. 통계 분석
본 연구에서 진행된 실험들은 3회 이상 반복하였다. 그래프는 각각의 실험 횟수들에 대한 평균(mean)과 표준편차(standard deviation)로 나타내었다. 유의성은 student’s t-test를 통해 검증하였다(*p<0.05, **p<0.01, ***p<0.001).
Ⅲ. 결과 및 고찰
1. 세포생존율
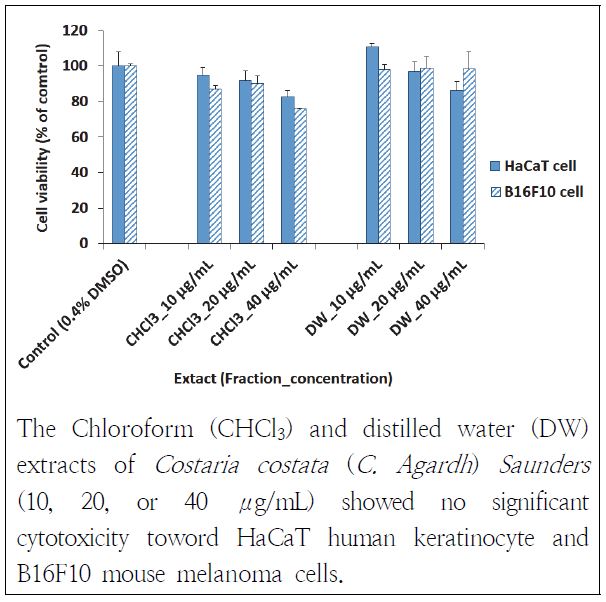
쇠미역사촌 추출물이 HaCaT cell과 B16F10 cell에 영향을 주는지 알아보기 위해 MTS를 시행한 결과는 다음과 같다(Fig. 1). HaCaT cell에 쇠미역사촌 CHCl3층과 DW층의 10 μg/mL와 20 μg/mL 추출물들은 세포 생존에 영향을 주지 않았고 40 μg/mL의 추출물을 처리했을 때도 각각 82%와 86%의 생존율을 보여 독성이 크지 않았다. B16F10 cell에서도 쇠미역사촌 DW층의 추출물들을 처리했을 때, 각각 98%와 99%, 99% 생존하였다. CHCl3층 추출물들에 대해서는 87%, 90%, 76%로 세포 생존율이 나타났다. 이러한 결과로 쇠미역사촌 추출물이 HaCaT cell과 B16F10 cell의 생존에 크게 영향을 미치지는 않았으나 농도의존적으로 세포 생존을 낮추는 경향이 있음을 확인하였다. Choi(2008)의 연구에서도 쇠미역사촌 에탄올 추출물 5, 25, 50, 100, 200 μg/mL을 B16F10 세포에 처리했을 때 농도의존적으로 생존율이 낮아져서 100 μg/mL까지는 80%가량의 생존율이 나타났다. 200 μg/mL에서는 58%로 급격히 낮아져서 쇠미역사촌 추출물의 농도가 높아지면 B16F10 세포에 영향을 줄 수 있다는 본 연구와 유사하였다.
2. 항산화 효과
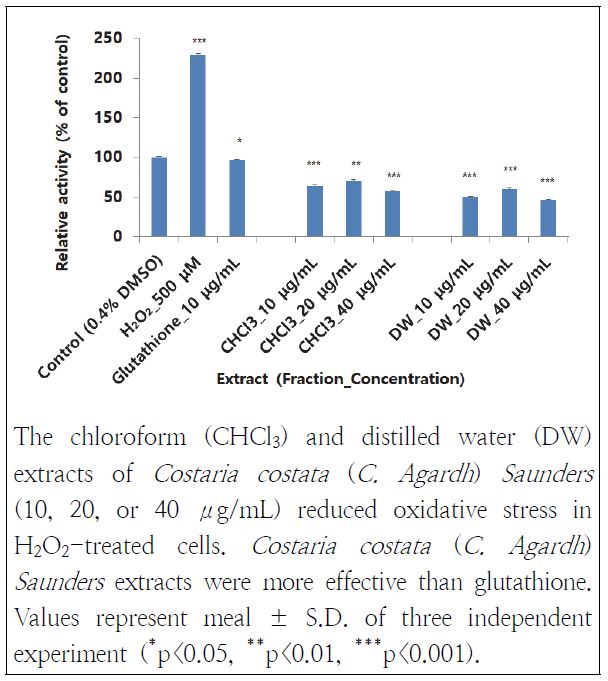
쇠미역사촌 추출물들이 산화적 스트레스에 대해 방어력이 있는지 알아보기 위해 항산화 실험을 시행한 결과는 다음과 같다. 쇠미역사촌 추출물들에서 모두 우수한 산화억제력을 확인할 수 있었다(Fig. 2). 그 중에서 CHCl3층과 DW층 10 μg/mL 추출물들이 H2O2 대조군(100%)에 대응하여 각각 28%, 22%로 산화스트레스가 감소하였다. 쇠미역사촌의 항산화 능력은 양성대조군인 glutathione(42%)과 비교하여도 우수한 것으로 관찰되었다. 이것은 Choi(2008)의 연구에서 5종의 식용 해조류 추출물 중에서 쇠미역사촌 에탄올 추출물의 DPPH 라디컬 소거하는 능력이 대조군에 비해 10 μg/mL에서 121% 활성을 보여 우수한 항산화 경향을 보인 결과와도 비교했을 때 유사하였다.
2. 멜라닌 합성 저해 효과
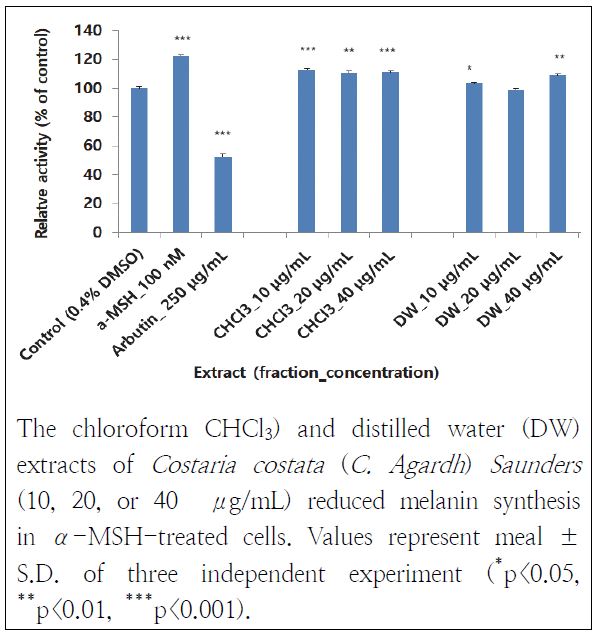
쇠미역사촌 추출물이 외부자극에 대한 방어로 생겨나는 멜라닌 합성을 저해하는지 알아본 결과는 다음과 같다. 쇠미역사촌 추출물들은 α-MSH 대조군과 비교했을 때 멜라닌 합성이 저해되게 하는 것을 확인할 수 있었다(Fig. 3). 특히, DW층 20 μg/mL 추출물은 멜라닌 합성을 19% 억제하였고 CHCl3층 추출물들도 미약하지만 멜라닌 합성을 억제하는 것을 관찰할 수 있었다. 양성대조군이 arbutin(57%)과 비교했을 때 쇠미역사촌 추출물들이 다소 미약한 효과를 보였지만 대조군의 상태와 유사한 것을 고려하면 멜라닌 합성을 억제하는 효과가 있다고 판단된다. 이것은 Choi(2008) 연구에서 쇠미역사촌 에탄올 추출물이 멜라닌 합성을 저해했던 결과와 유사하였다.
3. 항균 효과
쇠미역사촌 추출물들이 박테리아의 증식에 영향을 줄 수 있는지를 확인하기 위해 항균 실험을 진행하였다. 먼저, 쇠미역사촌 추출물들이 그람양성균인 S. aureus에 대해서 항균 작용을 하는지를 살펴보았다(Fig. 4). S. aureus에 대해 쇠미역사촌 CHCl3층 추출물들은 농도의존적으로 항균 효과를 보였다. CHCl3층 0.5 mg/mL 추출물은 관찰 6 h에 미약하게 균이 증식되는 것으로 관찰되었지만 이후로 균이 0 h과 유사한 상태로 21 h까지 유지하였다. 0.2 mg/mL 추출물은 관찰 15 h까지 균의 증식이 보이지 않았고 0.1 mg/mL 추출물은 관찰 9 h까지 균의 성장이 확인되지 않았다. DW층 추출물들은 대조군과 유사하게 균이 증식하여 항균 작용을 하지 못하였다. 이에 통해 쇠미역사촌 추출물 중에 CHCl3층 추출물 0.5 mg/mL는 균의 증식을 저지하는 최소저해농도이기도 함을 알 수 있었다. Choi(2008)의 연구에서는 쇠미역사촌 에탄올 추출물이 S. aureus에 대해 10 mg/mL에서 최소저해농도가 나타났다고 했는데 본 연구 결과와 비교하면 Chloroform으로 분획한 CHCl3층 추출물에 S. aureus에 대항하는 항균 물질이 좀더 풍부하기 때문인 것으로 짐작된다.
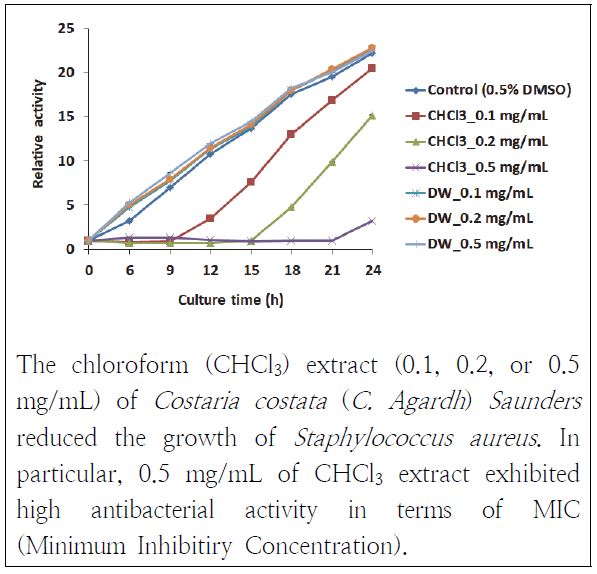
Antibacterial activity of Costaria Costata (C. Agardh) Saunders extracts against Staphylococcus aureus.
둘째, 쇠미역사촌 추출물의 그람양성균인 S. epidermidis에 대한 항균 활성을 살펴보았다(Fig. 5). 쇠미역사촌 추출물들 중에서 CHCl3층 추출물들이 항균 효과를 보이는 것을 관찰할 수 있었다. 추출물들은 관찰 9 h까지 균이 증식하지 못하게 하였는데 0.1 mg/mL 추출물이 우수한 항균 효과를 보였다. 이러한 결과는 Choi(2008)의 연구에서 쇠미역사촌 에탄올 추출물이 S. epidermidis에 대해 효과가 없었던 것과 비교할 때, 쇠미역사촌 에탄올을 CHCl3층 추출물에는 epidermidis 균의 성장을 억제하는 항균 물질이 있기 때문인 것으로 추측된다.
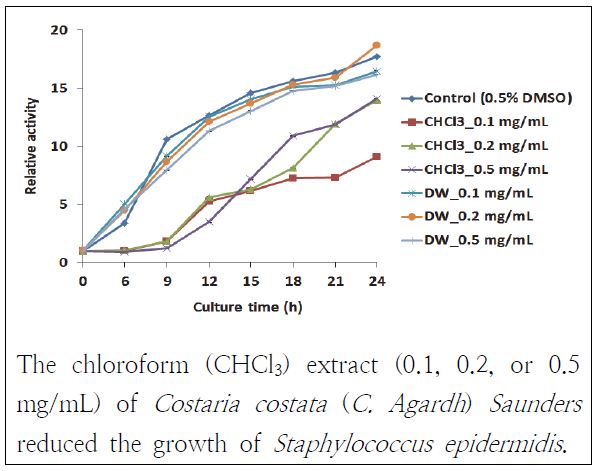
Antibacterial activity of Costaria Costata (C. Agardh) Saunders extracts against Staphylococcus epidermidis.
쇠미역사촌 추출물들이 그람음성균인 P. aeruginosa에 대해 항균 효과가 있는지도 살펴보았다(Fig. 6). 그 중에서 쇠미역사촌 CHCl3층 0.5 mg/mL 추출물이 항균 효과를 보였고 0.2 mg/mL 추출물도 미약하지만 균의 증식에 영향을 주었다. 0.1 mg/mL 추출물은 관찰 12 h까지 항균 활성이 미약하게 나타났다. DW층 추출물들은 대조군과 유사한 경향성을 보여 항균 효과가 없는 것으로 관찰되었다.
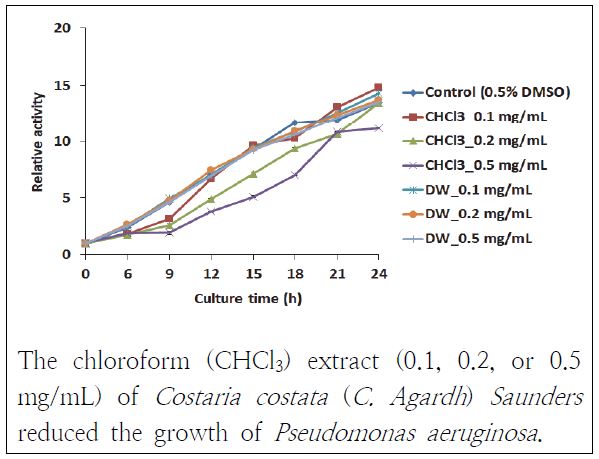
Antibacterial activity of Costaria Costata (C. Agardh) Saunders extracts against Pseudomonas aeruginosa.
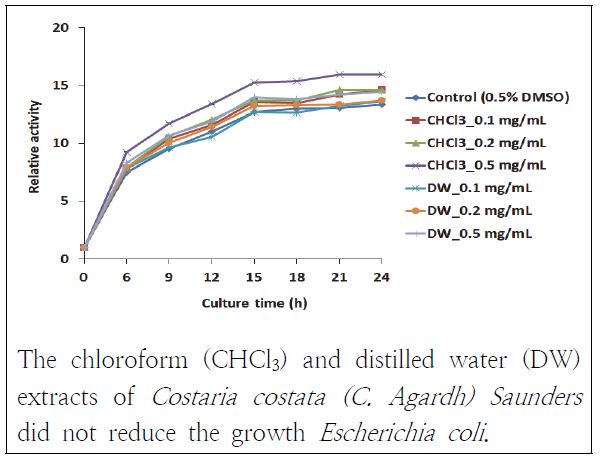
또한, 그람음성균인 E. coli에 대해서도 항균 활성이 있는지를 살펴보았다(Fig. 7). 쇠미역사촌 추출물들 모두 E. coli에 대해서 항균 효과가 없었다.
Ⅳ. 요약 및 결론
본 연구에서는 쇠미역사촌 추출물들이 피부 세포에 어떤 영향을 미치는지 조사하였다. 동물세포와 박테리아를 이용해서 관찰한 결과는 다음과 같다. 동물세포에 진행한 항산화 실험과 멜라닌 합성 저해 실험에 선행한 독성실험에서는 40 μg/mL의 농도 이하에서 세포 생존율 75%이상 나타나 세포 실험을 진행하였다. 항산화 효과를 측정하는 실험을 통해 쇠미역사촌 CHCl3층과 DW층 추출물 모두 산화스트레스를 감소시키는 효과를 보인다는 결과를 확인할 수 있었다. 그리고 쇠미역사촌 DW층 추출물이 멜라닌이 합성되는 외부 자극에 대해서 자극이 주어지지 않는 대조군과 유사한 정도로 합성을 저해하는 것을 알 수 있었다. 쇠미역사촌 추출물 중에는 CHCl3층 추출물이 항균 효과를 나타내었는데 그람음성균 보다 그람양성균에서 좀더 우수한 항균 작용을 하는 것으로 관찰되었다. 특히, S. aureus에 CHCl3층 추출물을 0.5 mg/mL로 처리했을 때 균의 증식을 저지할 수 있음을 확인할 수 있었다. CHCl3층 추출물은 그람음성균 중에서도 P. aeroginosa에 대해서 미약하지만 항균 효과를 나타내었다. 본 실험을 통해 쇠미역사촌 추출물을 분획하였을 때, 분획용매에 따라 항산화, 미백, 항균 효과가 효과적으로 나타났다. 용매에 대한 위험성을 적극적으로 배제할 수 있는 방법을 통해 화장품의 신규 원료와 식품의 방부제로 적극 활용할만하다고 판단되었다.
Acknowledgments
This study was carried out by Dongduk Women's University Research Year Support. This work was funded by a National Research Foundation of Korea (NRF) grant for Basic Science (NRF-2016R1D1A1B03930171).
References
-
Ahn SM, Hong YK, Kwon GS, Sohn HY(2010) Evaluation of in-vitro anticoagulation activity of 35 different seaweed extracts. J Life Sci 20(11), 1640-1647.
[https://doi.org/10.5352/JLS.2010.20.11.1640]

-
Ahn SM, Hong YK, Kwon GS, Sohn HY(2011) Evaluation of antioxidant and nitrite scavenging activity of seaweed extracts. J Life Sci 21(4), 576-583.
[https://doi.org/10.5352/JLS.2011.21.4.576]

-
Bhaskar N, Miyashita K(2005) Lipid composition of Padina tetrastomatica (Dictyotales, Phaeophyta), a brown seaweed of the west coast of India. Ind J Fish 52(3), 263-268.
[https://doi.org/10.5897/AJB11.2765]

-
Choi HG, Kim YS, Lee SJ, Nam KW(2007) Growth and reproductive patterns of Undaria pinnatifida sporophytes in a cultivation farm in Busan, Korea. J Appl Phycol 19(2), 131-138.
[https://doi.org/10.1007/s10811-006-9119-6]

- Choi YJ(2008) Antimicrobial and antioxidant activities of edible seaweeds. Master’s Thesis, Wonkwang Unviersity
-
Duan XJ, Zhang WW, Li XM, Wang BG(2006) Evaluation of antioxidant property of extract and fractions obtained from a red alga, Polysiphonia urceolata. Food chemistry 95(1), 37-43.
[https://doi.org/10.1016/j.foodchem.2004.12.015]

- Han KS(2002) Cultural studies of Costaria costata from Kangnung province. Master’s Thesis, Kangnung University
- Kang JW(1966) The geographical distribution of marine algae in Korea. Bull Pusan Fish Coll 7, 1-125
- Kim SK(2003) Development of novel bioactive substances from fishery byproducts. Food Ind Nutr 8(3), 1-8
- Kim YD, Jeong MH, Koo IR, Cho IK, Kwak SH, Kim BE, Kim KM(2006) Chemical composition of Prunus mume flower varieties and drying method. Korean J Food Preserv 13(2), 186-191
- Kim YM, Kim DS, Choi YS(2004) Anticoagulant activities of brown seaweed extracts in Korea. Korean J Food Sci Technol 36(6), 1008-1013
- Kumar CS, Ganesan P, Suresh PV, Bhaskar N(2008) Seaweeds as a source of nutritionally beneficial compounds-a review. J Food Sci Technol 45(1), 1-13
-
Lee JH, Lee KH, Yoo HI, Zhou XL, Kim YS, Choi HG, Nam KW(2006) Antimicrobial activity of Neorhodomela aculeata extracts against human skin pathogens. J Korean Fish Soc 39(3), 292-296.
[https://doi.org/10.5657/kfas.2006.39.3.292]

-
Na YJ, Jeon VJ, Han SJ, Maranguy CAO, An DS, Cha HK, Lee JB, Yang JH, Lee HW, Choi HG(2016) Crossed effects of light and temperature on the growth and maturation of gametophytes in Costaria costata and Undaria pinnatifida. Korean J Fish Aquat Sci 49(2), 190-197.
[https://doi.org/10.5657/KFAS.2016.0190]

- Oh YS, Lee IK, Boo SM(1990) An annotated account of Korean economic seaweeds for food, medical and industrial uses. Korean J Phycol 5(1), 57-71
- Park YH, Pyeun JH, Oh HK, Kang YJ(1976) Utilization of unexploited algae for food of other industrial uses, 1. Chemical composition unexploited algae and extraction of algae protein. J Korean Fish Soc 9(3), 155-162
-
Park SK, Heo JS, Kim BY, Song JN, Lim GY, Kim HN, Choi HG(2011) Comparison on the growth of Costaria costata and Undaria pinnatifida sporophytes in culture and their field populations. Korean J Fish Aquat Sci 44(1), 71-77.
[https://doi.org/10.5657/kfas.2011.44.1.071]

-
Ryu HY, Heo JC, Hwang JS, Kang SW, Yun CY, Lee SH, Sohn HY(2008) Screening of thrombin inhibitor and its DPPH radical scavenging activity from wild insects. J Life Sci 18(3), 363-368.
[https://doi.org/10.5352/JLS.2008.18.3.363]

-
Smit AJ(2004) Medicinal and pharmaceutical uses of seaweed natural products: a review. J appl phycol 16(4), 245-262.
[https://doi.org/10.1023/B:JAPH.0000047783.36600.ef]