건조방법을 달리한 세발나물의 영양성분 및 항산화 효과 비교
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study compared the physicochemical properties and antioxidative effects of hot air-dried Spergularia marina (HSM) and freeze-dried Spergularia marina (FSM). The crude fat content in the HSM were higher than in the FSM, but the crude ash content was lower than that in the FSM. The crude protein and carbohydrate contents were similar, regardless of the drying methods. The organic acid contents of oxalic acid, citric acid, tartaric acid, malic acid, and succinic acid were higher in the FSM than the HSM. The contents of vitamin E and C were higher in the FSM than in the HSM. The total mineral content of the FSM was significantly higher than that of the HSM. Regardless of the drying methods, K and Na were the most abundant elements in the samples. The total polyphenol contents of the Spergularia marina ethanol extract were 36.98 mg TAE/g in the HSM and 95.07 mg TAE/g in the FSM. The total flavonoid contents of Spergularia marina ethanol extract were 10.53 mg RE/g in the HSM and 21.53 mg RE/g in the FSM. Total polyphenol and flavonoid contents were significantly higher in the FSM than in the HSM. The DPPH radical scavenging activities of the HSM and FSM ethanol extracts were 17.65% and 19.70% in 1,000 ppm, respectively. The antioxidative index of the HSM and FSM ethanol extracts measured by Rancimat were lower than those in the BHT, BHA, and ascorbic acid, but higher than those in the control.
Keywords:
Spergularia marina, drying method, physicochemical properties, antioxidative activityI. 서론
세발나물(Spergularia marina Griseb)은 우리나라의 서해안 및 남해안의 해안지역, 염전 근처 및 간척지 논 등 소금기가 있는 곳에서 자생하는 석죽과(Caryophyllaceae) 1~2년생 초본이다(Yang 1999; Heo et al. 2009; Lee & Jung 2012; Cho et al. 2014; Son et al. 2015; Kim et al. 2016a; Kim et al. 2016b; Lee et al. 2017). 세발나물은 갯개미자리라고도 불리며(Lee & Jung 2012), 높이 10~20 cm, 반원기둥형 줄 모양의 잎이 밑쪽부터 여러 마디로 마주 보며 갈라지고, 소나무 잎과 같이 가늘고 길며 뾰족하고 윗부분 및 꽃받침에는 선모가 있고 전체적으로 세발낙지와 닮았다 하여 세발나물이라는 이름이 붙여졌다고 한다(Yang 1999; Heo et al. 2009; Lee & Jung 2012; Jeong et al. 2014; Kim et al. 2016b). 전라남도 서부지역 특히, 신안, 해남, 무안, 함평 및 영암지역에서 주로 생산된다(Yang 1999; Heo et al. 2009; Lee & Jung 2012; Son et al. 2015). 주 생산기간은 10월부터 5월까지이며, 내건성ㆍ내한성이 강해 산채류 생산이 드문 가을과 겨울에도 출하가 가능하며(Lee & Jung 2012), 노지생산도 가능하여 생산비가 낮고, 저온기간에 생산되어 무농약 신선채소로 맛과 향이 좋아 생산지 근처 학교급식과 식당 등에서 이용되어 오다가 점차 전국적인 수요가 지속적으로 증가하고 있다(Cho et al. 2005; Heo et al. 2009; Lee et al. 2017).
세발나물과 같은 염생식물은 해안가를 비롯하여 소금기가 있는 염습지, 내륙지역의 암염 지대에 자라는 식물로(Jung et al. 2008) 전 세계적으로는 1,500여 종 이상이 있고, 우리나라 서해안 갯벌지역에는 약 40여종 이상 분포한다(Lee et al. 1999; Lee et al. 2004; Lokhande & Suprasanna 2012; Cho et al. 2014). 식물은 토양 중에 Na+와 Cl-가 고농도로 존재할 경우 염 스트레스를 받는데, 염 스트레스는 이온의 독성, 수분 포텐셜의 저하. 이온의 흡수 및 수송의 억제에 의한 영양 불균형을 일으켜 식물의 생장억제를 초래하는 것으로 알려져 있다(Munns & Termaat 1986). 염생식물은 염 stress에 저항성이 강해 염으로부터 스스로 보호하기 위해 삼투압 조절을 통해 세포기능 보호, 자기 방어기작 및 페놀성 화합물이 포함된 2차 대사산물을 다량 함유하고 있다(Lokhande & Suprasanna 2012; Cho et al. 2014). 세발나물은 짠맛이 있는 염생식물 특성상 소금 대용으로 활용될 수 있어, 소금을 대신한 다양한 저염식 및 대체염 관련 식재료 및 레시피 연구도 활발히 진행되고 있다(Kim et al. 2016a, b; Lee et al. 2017).
현재까지 보고된 세발나물의 효능에 관련된 연구는 전남지역에서 생산된 세발나물 유통실태, 이화학적 성분 및 생리활성(Heo et al. 2009), blanching방법에 의한 세발나물의 이화학적 특성 변화(Lee & Jung 2012), 세발나물로부터 분리된 항산화 화합물의 단리 및 구조해석(Kim 2013), 칠면초 및 세발나물 인슐린 저항성 개선 효과(Cho et al. 2014), 세발나물의 총 페놀 함량 및 항산화 활성도에 대한 연구(Cho et al. 2014), 조리법에 따른 세발나물 추출물의 항산화 및 암세포 성장억제 활성 변화(Lee et al. 2017), 지방세포의 분화 억제 효과와 고지방식이를 급여한 흰쥐의 항비만 효과(Park et al. 2020) 등이 있다. 세발나물은 Ca, Mg, K 등의 천연 무기질이 풍부하고 Na 함량이 높으며, 엽록소, 식이섬유소가 다량 함유되어 변비 및 비만예방에 좋으며, β-carotene, choline, betain 등 기능성 물질이 다량 함유되어 노화방지와 생활습관병 예방에 효능이 있다고 보고되었다(Heo et al. 2009; Lee & Jung 2012; Kim 2013; Shim et al. 2013; Son et al. 2015; Kim et al. 2016).
세발나물을 활용한 기능성 식품으로 이용 가능성에 대한 연구로는 세발나물 분말 첨가 쿠키 품질특성(Son et al. 2015), 세발나물 첨가 쌀머핀의 품질특성 및 최적화(Kim et al. 2016b), 세발나물 첨가 쌀쿠키의 품질특성 및 최적화(Kim et al. 2016a) 등이 있다. 세발나물은 우수한 생리활성기능을 보유하고 있는 무농약 신선채소로 인식이 확산되어 건강식품으로 관심이 높아지고 있지만 대부분 샐러드, 나물, 발효음식, 절임류 등의 주ㆍ부재료로 활용되고 있다(Kong 2015; Lee et al. 2017). 세발나물 분말은 저장성 향상을 통한 유통 간편화를 통해 다양한 식품 가공 소재로 활용된다면 부가가치 향상을 통해 농가소득에 많은 도움을 줄 수 있을 것으로 사료된다.
식재료를 분말화하여 식품에 사용할 경우 열풍, 냉풍, 동결 및 진공건조 등과 같이 기계를 이용하여 건조하는 방법과 태양과 음지에서 자연 건조하는 방법이 있으나, 기능성 식재료로의 사용을 위해서는 영양성분이나 기능성 성분의 손실을 최소화하기 위하여 동결 건조하는 방법(Park 1995)을 많이 사용하고 있다. 그러나 동결건조를 할 경우 건조 속도가 느리고 비용이 많이 들어 생산효율이 떨어지는 단점이 있다(Lee et al. 2004).
따라서 본 연구에서는 국내산 세발나물을 동결건조 및 열풍건조 방법별 이화학적 성분과 항산화성분의 변화에 대해 비교 분석을 하고자 한다. 건조 방법에 따라서 국내산 세발나물의 영양소 손실을 최소화시킬 수 있는 최적의 방법을 찾고, 기능성 성분 손실을 최소화하여 건강기능성 향상을 통해 건강기능식품으로 활용 가치 향상을 위한 기초 자료로 제시하고자 한다.
Ⅱ. 연구방법
1. 실험재료 및 건조방법
본 실험 사용한 세발나물은 전라남도 무안군에서 구입하였다. 세발나물은 이물질를 제거하고 3회 수세 후, Salad spinner(Caous, WINDAX, Seoul, Korea)를 통해 물기를 제거한 다음 건조하였다. 열풍건조는 열풍건조기(GNO12, Hanil GNCO Co., Ltd., Jangseong, Korea)를 이용 60℃에서 40시간 건조시켰고, 냉동건조는 –70℃에서 냉동 후 동결건조기(ED 8512, Ilshin, Yangju, Korea)로 72시간 동결건조시켰다. 열풍건조 및 동결건조된 세발나물은 분쇄기(Food mixer, Hanil, Seoul, Korea)로 마쇄 후 –70℃로 냉동 보관하여 시료로 사용하였다.
2. 일반성분 분석
세발나물은 A.O.A.C.(Association of Official Analytical Chemists)방법(AOAC 1997)에 준하여 일반성분 분석 실시 결과 수분은 105℃ 상압가열 건조법, 조지방은 soxhlet 추출법, 조회분은 회화법, 조단백질은 micro-kjeldahl법 으로 분석하였다. 탄수화물은 100에서 수분, 조단백질, 조회분, 조지방 함량을 제외한 후 값으로 나타내었다.
3. 유기산 분석
유기산의 분석 방법은 Kim et al.(1997)에 준하여 증류수 50 mL에 시료 1 g을 가하여 수조에서 80℃, 4시간 가열 후 Qualitative Filter paper No. 2(Advantec, Tokyo, Japan)로 여과하였고, 그 여액을 rotary vacuum evaporator(UT-1000, EYELA, Tokyo, Japan)로 감압·농축 하여 증류수 10 mL로 정용한 후 Ion chromatography(DX-600, Dionex, CA, USA)를 통해 분석하였다.
4. 비타민 분석
비타민 A 및 비타민 E의 분석 방법은 식품공전법(Korea 2005)에 준하여 시험방법 기준을 설정하였다. 시료 0.5 g, ethanol 5 mL 및 ascorbic acid 0.1 g를 취해 80℃에서 10분 동안 가열하여 50% KOH용액 0.25 mL를 첨가하고 20분간 가열 후 증류수 24 mL, hexane 5 mL를 가하여 1,900 × g에서 20분 동안 원심분리하였다. 상징액에 hexane 40 mL를 첨가하고 원심분리하여 상징액을 다시 분리 후, 증류수를 가하여 10분 동안 방치한 다음 하층부 물질을 제거하였다. 이 과정은 3회 반복하였고, 전체 용액은 합하여 Na2SO4로 탈수하여 rotary vacuum evaporator(UT-1000, EYELA, Tokyo, Japan)로 hexane을 감압·농축한 다음 10 mL ethanol을 가한 후 0.2 μm membrane filter로 여과하여 HPLC(LC-10-AVP, Shimadzu, Kyoto, Japan)를 이용해 분석하였다. 비타민 C 분석은 Rizzolo 등의 방법(Rizzolo et al. 1984)으로 시료 5 g은 metaphosphoric acid(HPO3) 용액 20 mL를 첨가하여 추출 후 1,900 × g에서 20분 동안 원심분리 후 0.45 μm membrane filter로 여과하고 HPLC(LC-10 AVP, Shimadzu, Kyoto, Japan)를 이용해 분석하였다.
5. 무기질 분석
무기질은 A.O.A.C. 방법(AOAC 1997)으로 분석하였다. 시료 0.5 g, 60 % HClO4 3 mL 및 20 % HNO3 10 mL를 첨가하여 투명해지는 시점까지 가열 후 0.5 M HNO3으로 50 mL를 정용하였다. 분석항목별로 표준용액은 혼합한 후 다른 vial에 각각 8 mL씩 취하고 표준용액으로 사용하였고 0.5 M HNO3을 대조구로 해서 원자흡수분광광도계(AA-6501GS, Shimadzu, Kyoto, Japan)를 통해 분석하였다.
6. 세발나물 에탄올 추출
열풍건조 및 동결 건조한 세발나물 분말 각각의 시료 100 g당 80% ethanol 1,500 mL을 첨가 후 환류 냉각관이 부착된 65℃의 Heating mantle(Mtops ms-265, Seoul, Korea)에서 3시간, 3회 추출 후 Qualitative filter paper No.2(Advantec, Tokyo, Japan)로 여과하였고, 여액은 40℃의 수욕 상에서 rotary vacuum evaporator(UT-1000, EYELA, Tokyo, Japan)로 용매를 제거하고 감압·농축 후 동결건조시켰고 고형물 함량의 추출물 수율을 구하였다(Jung et al. 2000). 열풍건조 및 동결 건조한 세발나물 에탄올 추출물의 수율은 각각 13.92%와 12.36%로 나왔다. 시료는 산화 방지를 위해서 –70℃로 냉동 보관하여 사용하였다. Lee & Kim(2009)의 연구를 토대로 80% 에탄올 추출물이 열수 추출물보다 DPPH radical 소거 활성이 높고 항산화 활성도 높다고 보고하여 본 실험에서는 에탄올 추출 방법을 실시하였다.
7. 총 polyphenol 함량 측정
열풍건조 및 동결 건조한 세발나물 에탄올 추출물 총 polyphenol 함량은 Folin-Denis방법(Folin & Denis 1912)으로 측정하였다. 세발나물 에탄올 추출물을 test tube에 1 mL와 Folin reagent 2 mL를 가한 후 실온에 3분 동안 정치한 후 10% Na2CO3 2 mL를 첨가하고, 혼합 후 30℃, 40분간 정치하였으며, UV-spectrophotometer(UV-1601PC, Shimadzu, Kyoto, Japan)를 사용하여 760 nm에서 흡광도 측정을 하였다. 표준 곡선은 tannic acid(TA)로 최종 농도 0, 0.2, 0.4, 0.6, 0.8, 1.0 mg/mL가 되도록 작성하였고, 검량 곡선으로부터 시료 중 총 polyphenol의 함량을 구하였다.
8. 총 flavonoid 함량 측정
총 flavonoid 함량은 Davis법 변형법(Chae et al. 2002)으로 측정하였다. 세발나물 에탄올 추출물은 1 mL에 diethylene glycol 2 mL을 첨가한 다음 1N NaOH 20 μL을 넣고 37℃ water bath에서 1시간 동안 반응시킨 후 UV-spectrophotometer(UV-1601PC, Shimadzu, Kyoto, Japan)로 420 nm에서 흡광도를 측정하였다. 표준 곡선은 rutin을 이용해 최종 농도 0, 0.2, 0.4, 0.6, 0.8, 1.0 mg/mL가 되도록 조제하였고, 검량 곡선에 의해 시료중의 총 flavonoid 함량을 구했다.
9. DPPH radical 소거능 측정
세발나물 에탄올 추출물의 DPPH(2,2-diphenyl–1-picrylhydrazyl) radical에 대한 소거능 측정방법은 Blois의 방법(Biois 1958)으로 측정하였다. 세발나물 에탄올 추출물 1 mL와 0.2 mM DPPH 1 mL을 취해서 test tube에 취하여 혼합하고 37℃, 30분 동안 반응 후 UV-spectrophotometer(UV-1601PC, Shimadzu, Kyoto, Japan)를 사용해 517 nm에서 흡광도를 측정하였다. 활성도 비교를 위해 양성대조군으로는 비타민 C (Sigma Co., St. Louis, MO, USA)와 합성 항산화제인 butylated hydroxyanisole(BHA) 및 butylated hydroxytoluene(BHT)(Sigma Co., St. Louis, MO, USA)을 이용해 동일한 방법으로 측정하였다. 세발나물 에탄올 추출물 DPPH radical 소거능은 (1-시료첨가구의 흡광도/무첨가구의 흡광도) × 100의 방식으로 계산하였다.
10. 항산화 지수 측정
항산화 지수(antioxidant index, AI) 측정 방법은 Joo 등의 방법(Joo & Kim 2002)에 의하여 Rancimat(Metrohm model 679, Herisan, Switzerland)로 측정했다. 세발나물 에탄올 추출물 중 포함되어있는 용매를 완벽히 제거 후 함량이 600 ppm이 되도록 soybean oil (Sigma Co., St. Louis, MO, USA)에 첨가하였다. 초음파(Ultrasonic processor VCX-750, Sonics & Materisl Inc., CT, USA)를 이용해 시료의 추출물과 유지의 혼합이 잘 되도록 하였다. Rancimat의 측정 조건은 세발나물 추출물 각 3.0 g을 반응 용기에 취한 후 증류수 70 mL를 측정 용기에 넣고 110℃에서 air flow rate 20 L/h로 하여 산화안정성 비교를 하였다. 측정치는 모두 3회 반복 실험하였고, 평균치로 표시하였다. 기존 상업용 항산화제 BHA 및 BHT(Sigma Co., St. Louis, MO, USA)와 천연 항산화제로는 비타민 C(Sigma Co., St. Louis, MO, USA)를 유지에 첨가하여 양성 대조군으로 하여 비교 실험하였다.
11. 통계처리
본 실험의 통계분석 방법은 SPSS 17.0 P/C package(Statistical Package for Social Science, SPSS Inc., Chicago, IL, USA)를 이용하여 통계 분석하였고 3회 반복 측정한 평균값 ± 표준오차를 표시하였고 통계의 유의성 검정은 Student’s t-test를 실시해 유의성 검정을 하였다.
Ⅲ. 결과 및 고찰
1. 일반성분
열풍건조 및 동결건조를 통해 준비된 세발나물 분말의 일반성분 함량은 Table 1에 나타내었다. 열풍 건조된 세발나물의 분말 일반성분 함량은 조단백질 3.24%, 수분 6.23%, 탄수화물 61.13%, 조회분 15.69%, 조지방 4.82% 이였다. 동결 건조된 세발나물 분말 일반성분의 함량은 조단백질 2.84%, 수분 3.95%, 탄수화물 38.53%, 조회분 25.30%, 조지방 3.81% 이였다. Lee & Jung(2012)의 연구에서 동결 건조된 세발나물 일반성분을 분석한 결과 조단백질 4.70%, 수분 5.54%, 탄수화물 30.56%, 조회분 22.37%, 조지방 36.83% 로 본 실험 결과값과 비교하여 조지방 함량은 상이한 결과값을 나타냈다. 이러한 결과는 시료의 품종, 채취지역, 생육환경, 수확시기 등에 의해 상이한 결과를 보이는 것으로 사료된다. 염생식물 중 함초와 나문재 일반성분의 함량을 조사한 결과(Park et al. 2007), 나문재 일반성분의 함량은 조단백질 17.76%, 수분 10.11%, 조회분 20.38%, 조지방 2.05% 함초 일반성분의 함량은 조단백질 12.30%, 수분 5.10%, 조회분 46.80%, 조지방 1.30%으로 세발나물이 함초와 나문재에 비해 조지방 함량이 높은 것으로 보였으나 조회분 함량은 낮거나 비슷한 것으로 나타나, 세발나물은 염생식물의 다른 품종과 비교 시 조지방 함량은 다소 높은 것으로 사료된다. Kim et al.(2014)의 연구결과 모시잎 열풍 및 동결 건조한 분말의 일반성분 측정 결과, 건조방법에 따라서 일반성분 함량은 크게 차이가 나타나지 않는다고 보고되었지만 본 연구 결과 탄수화물, 조단백질 함량을 제외한 조회분, 조지방 함량은 유의적인 차이를 보이고 있어 상반된 결과를 나타냈다. 저장 중 품질에 영향을 미치는 조회분 함량은 열풍건조 및 동결건조 시 각각 15.69%, 25.30%로 나타나 나물을 건조하여 저장할 경우 건조방법이 중요하다.
2. 유기산
열풍건조 및 동결건조된 세발나물 분말의 유기산 함량은 Table 2에 나타내었다. 유기산은 총 8종을 분석한 결과 lactic acid는 검출되지 않았고 7종의 유기산이 검출되었다. 열풍건조 및 동결건조 세발나물 2종 모두 oxalic aicd 함량이 가장 높았고, 열풍건조 세발나물의 유기산 함량의 순서는 citric acid, malic acid, acetic acid, formic acid, tartaric acid, succinic acid이였고, 동결건조 세발나물의 유기산 함량의 순서는 malic acid, citric acid, acetic acid, succinic acid, tartaric acid, formic acid이였다. Lee & Jung (2012)의 연구결과 blanching방법에 따른 세발나물 분말의 유기산 함량은 생 세발나물 유기산의 함량 순서는 oxalic acid, lactic acid, malic acid, acetic acid, citric acid이였고, 데친 세발나물은 oxalic acid, lactic acid, malic acid, acetic acid, citric acid 순으로 검출되어 본 실험과는 다른 결과를 보였다. 이러한 결과는 앞서 보고한 일반성분 분석 결과처럼 시료의 품종, 채취지역, 생육환경, 수확시기, 건조방법, 조리방법 등에 따라 유기산 함량의 차를 보이는 것으로 사료된다. 열풍건조 및 동결건조 세발나물 분말 유기산의 함량은 acetic acid의 함량은 건조방법과 상관없이 유의적 차이가 없었으나, citric acid, oxalic acid, tartaric acid, succinic acid, malic acid의 함량은 동결건조 시 유의하게 높았고, formic acid는 낮게 나타났다. 총 유기산 함량의 측정결과 열풍건조 세발나물은 870.74 mg/100 g, 동결건조 세발나물은 4,943.13 mg/100 g으로 동결건조 분말에서 유의하게 높게 나타났다. 동결건조 방법에 비하여 열풍건조 분말의 총 유기산 함량이 감소한 이유는 가열 처리 방법으로 인해 유기산은 휘발되거나 소실된 것으로 판단된다(Kim et al. 2012). 이러한 결과를 토대로 본 연구에서는 동결건조 방법에 의한 세발나물 건조법이 유기산 함량이 열풍건조 방법에 비해 높게 검출되어 동결건조 방법이 영양소 손실을 최소화하기 위해서 바람직하다고 생각된다.
3. 비타민
열풍건조 및 동결건조 방법으로 분말화한 세발나물의 비타민 A, C 및 E 함량은 Table 3에 나타내었다. 세발나물 분말의 비타민 A 함량은 열풍건조 및 동결건조 방법 모두 검출되지 않았고, 비타민 C 함량은 열풍건조 61.47 mg/100 g, 동결건조 129.81 mg/100 g 검출되었고, 비타민 E 함량은 열풍건조 1.30 mg/100 g, 동결건조 4.31 mg/100 g로 검출되었다. Lee & Jung (2012)의 연구 결과 동결건조된 생 세발나물의 비타민 C 함량은 99.97 mg/100 g, 비타민 E 함량은 2.95 mg/100 g으로 나타났고, Heo et al.(2009) 등이 보고한 생 세발나물 비타민 C 함량 분석 결과는 68.61 mg/100 g으로 나타냈다. 건조방법을 달리한 매생이 분말의 비타민 C 함량은 열풍건조 시료 11.69 mg/100 mL, 동결건조 12.43 mg/100 mL로 세발나물의 비타민C 함량(Son et al. 2011)이 더 높았다. 비타민 C와 비타민 E의 함량은 건조방법에 따라서 유의적 차이를 보였으며 열풍건조 방법에 비해 동결건조 방법은 비타민 손실이 상대적으로 적어 함량이 높게 나타났다. 열풍건조 시에 비타민 C 함량이 많이 손실되었고 그 이유는 비타민 C는 산소와 열에 민감하여 ascorbic acid oxidase에 의해 산화되기 쉽기 때문(Lin et al. 1998)이며, 동결건조 방법은 낮은 온도로 건조가 진행되기 때문에 비타민 C가 열풍건조 방법에 비해 잘 보존된 것으로 사료된다. 동결건조 방법이 세발나물의 비타민 C와 E의 함량이 높게 나타났으며, 따라서 본 연구에서는 열풍건조 방법에 비해 동결건조 방법이 비타민 유지율을 높이고 손실율을 줄일 수 있는 방법이라 생각된다.
4. 무기질
열풍건조 및 동결건조 방법으로 분말화된 세발나물의 무기질은 총 8가지를 분석하였다(Table 4). 세발나물의 K 함량은 열풍건조 2,601.00 mg/100 g, 동결건조 4,674.00 mg/100 g으로 무기질 중 함량이 가장 높게 나타났으며, 열풍 건조된 세발나물의 무기질 함량은 Na, Ca, Mg 순이였고, Fe, Zn, Mn, Cu은 미량 함유되어 있었다. 동결 건조된 세발나물의 무기질 함량은 Na, Mg, Ca 순으로 낮았고, Mn, Zn, Fe, Cu은 미량 함유되어 있었다. Hong(2011)이 연구한 동결 건조된 세발나물 무기질 함량은 Na 함량이 가장 높았다고 보고하였고, Lee & Jung(2012)이 연구한 생 세발나물의 무기질 함량은 Na 함량이 가장 높다고 보고하여 본 연구의 결과와 다른 경향을 보여주고 있다. Kim(2003)의 연구결과에서는 함초의 무기질 조성 및 함량은 K, Na, Ca, Mg, Fe 순으로 본 연구의 세발나물 무기질 조성과 유사한 결과를 보여주고 있다. Kim et al.(2010)의 연구 내용에서는 이러한 무기질 함량의 차이는 시료의 채취시기, 채취장소, 건조방법의 차이에 의한 것이라고 하였다. 세발나물 무기질의 총 무기질 함량은 열풍건조 5,340.56 mg/100 g, 동결건조 8,978.92 mg/100 g이였다. 이와 같은 결과 동결건조 방법이 열풍건조 방법보다 무기질 함량이 훨씬 높은 것으로 나타났다. K, Mg, Na, Mn 및 Zn의 함량은 동결 건조된 세발나물이 유의적으로 높은 함량을 보여주었고, Ca, Fe 및 Cu는 열풍건조된 세발나물이 유의적으로 높게 나타나 건조방법에 따라 각각 다른 차이를 보여주었다. 이와 같은 연구 결과 각각의 무기질 함량은 건조방법에 따라 다른 차를 보였으나 총 무기질 함량은 동결건조 시 더 높았다. 이와 같은 결과를 토대로 재료 본연의 영양성분을 최대로 유지해 주는 동결건조 방법이 무기질 함량의 보존을 유지하는데 효율적일 것으로 사료된다.
5. 총 polyphenol 함량
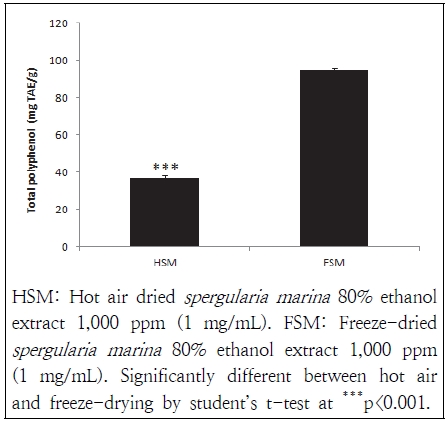
식물계에 2차 대사산물로 널리 분포된 phenol성 물질은 수산기로 치환된 방향족환을 지닌 식물성 물질로 단백질, 효소를 비롯한 기타 거대분자들과 잘 결합되는 성질을 통해 항노화, 항염증, 항산화, 항암 등의 다양한 생리활성능을 가지고 있는 것으로 알려졌다(Kim et al. 2000; Kim et al. 2007). 세발나물 에탄올 추출물의 건조방법에 따른 총 polyphenol의 함량은 Fig. 1과 같다. 열풍건조 및 동결건조 세발나물의 총 polyphenol의 함량은 각 36.98 mg TAE/g, 95.07 mg TAE/g 함량을 보여 건조방법에 따라서 유의적인 차이가 나타났다. Heo et al.(2009)의 연구결과 세발나물 총 polyphenol 함량은 메탄올 추출물 41.7 mg/L, 열수 추출물 25.1 mg/L, 에탄올 추출물 22.5 mg/L로 나타냈다. 세발나물과 같은 염생식물류의 총 polyphenol 화합물 함량은 함초의 잎과 줄기는 28.27 mg/g, 칠면초의 잎과 줄기는 15.51 mg/g으로 함유되었고, 특히 함초는 6월 성장기의 줄기와 잎에서 36 mg/g으로 함유량이 가장 높았다고 하였다(Kim et al. 2010). Choi et al.(2009)은 음건한 칠면초 분획 추출물 polyphenol의 함량은 ethyl acetate 21.33 mg/g, butanol 17.31 mg/g, methanol 2.33 mg/g 순서로 추출 용매에 따라서 함량의 차를 보인다고 보고하여 본 실험의 결과와 비교하였을 경우 세발나물 에탄올 추출물의 총 polyphenol 함량이 더 높게 나타났다. 건조방법에 따른 세발나물의 총 polyphenol의 함량은 열풍건조된 세발나물에 비하여 동결건조된 세발나물에서 더 높게 나타나 건조방법에 따라서 유의적인 차이를 보여주었다. 이러한 결과는 Chung et al.(2013)의 연구결과 잣솔잎 추출물은 열풍건조 방법에 의한 시료 보다 동결건조 방법의 시료에서 총 phenol 함량이 유의적으로 높게 측정된 결과와 유사한 경향을 나타내었다. 또한 Kim et al.(2006)의 연구결과 삼백초의 시료도 건조방법에 따른 비교 결과 가장 높은 총 phenol 함량은 동결건조된 시료라고 보고되었다. 일반적으로 수용성 및 불용성으로 구분되는 phenol성 물질은 열적 처리 또는 삼투압 시 일부분의 유용성분도 빠져나갈 수 있다고 Wink(1997)는 보고하였다. 본 실험의 열풍건조된 세발나물은 열처리에 의하여 일부분의 유용성분 유출에 의해 총 polyphenol 함량이 낮아진 것으로 사료된다. 본 연구결과 세발나물의 총 polyphenol 함량은 동결건조 방법이 열풍건조 방법에 비하여 더 높은 함량을 보여주고 있어 세발나물의 총 polyphenol 함량 분석은 동결건조 방법을 이용하는 것이 더 좋은 방법이라고 사료된다.
6. 총 flavonoid 함량
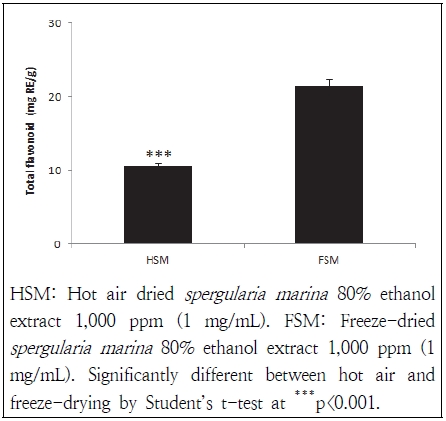
Flavonoid는 약 4,000여개 화합물로 구성된 관속식물 중에 존재하는 담황색, 노란색 등을 띄고 있는 항산화 물질로 식물 중에서는 대부분 당과 결합된 배당체(glycoside)의 형태로 존재하고 있다. flavonoid는 항균, 항산화 작용, 항알레르기, 모세혈관 강화 및 면역증강 작용 등에 효과가 있는 것으로 보고되고 있다(Middleton & Kandaswami 1994; Kawaguchi et al. 1997). 본 연구에서는 세발나물 에탄올 추출물의 건조방법별 총 flavonoid의 함량은 Fig. 2에 나타내었다. 열풍건조 및 동결건조 방법에 의한 세발나물 총 flavonoid의 함량은 각 10.53 mg RE/g, 21.53 mg RE/g 함유하고 있었고 건조방법에 따라서 유의한 차를 나타내었다. Heo et al.(2009)의 연구결과 세발나물의 총 flavonoid 함량은 메탄올 추출물 18.9 mg/L, 에탄올 추출물 12.2 mg/L, 열수 추출물 11.0 mg/L 순이 였다고 하여 본 연구의 결과와 유사한 경향을 나타내었다. 염생식물에 속하는 칠면초는 건물 기준으로 총 flavonoid 함량이 2.69 mg/g 함유되어 있었고(Lee et al. 2012), Lee et al.(2011)의 연구에서는 자연 건조한 칠면초 분획 추출물의 flavonoid 함량은 hexane 1.7 mg/g, chloroform 7.1 mg/g, ethyl actetate 10.9 mg/g, butanol 3.1 mg/g, water 4.9 mg/g으로 보고하여(Lee et al. 2011) 본 실험에서 세발나물 에탄올 추출물의 총 flavonoid 함량이 칠면초에 비해 더 높음을 알 수 있었다. 건조방법을 달리하여 세발나물의 총 flavonoid 함량을 측정할 결과 열풍건조 세발나물에 비해 동결건조 세발나물에서 유의적으로 높게 나타나 건조방법에 따른 쑥부쟁이와 씀바귀의 총 flavonoid 함량이 동결건조 처리군에서 높게 나타난 것과 유사한 결과를 보였다(Kim et al. 2009). 열풍건조 세발나물의 총 flavonoid 함량이 낮아진 이유는 열풍건조 시 열처리에 의한 유용성분의 용출에 기인한 것으로 생각된다(Wink 1997). 본 연구 결과 세발나물 총 flavonoid 함량은 동결건조 방법이 열풍건조방법에 비해 높은 함량을 보여 동결건조 방법이 영양소 손실을 최소화시킬 수 있는 방법이라 사료된다.
7. DPPH radical 소거능
DPPH radical은 진한 자색 화합물이며 항산화 활성을 보유한 물질과 반응해 수소 전자를 받아 환원되고 따라서 짙은 자색이 탈색되는 특징이 있어 비교적 짧은 시간 내에 항산화능 측정이 가능하여 다양한 천연 소재로부터 항산화 물질 검색에 많이 이용되는 방법이다(Que et al. 2006; Thongchai et al. 2009). 건조방법에 따른 세발나물 에탄올 추출물 농도별 DPPH radical 소거능 활성을 측정한 결과는 Table 5에 나타내었다. 열풍건조 및 동결건조 세발나물 추출물의 DPPH radical 소거능은 125 mg/L에서 4.35% 및 5.64%였고, 추출물 농도가 증가될수록 DPPH radical 소거능도 함께 증가하는 현상을 보여 1,000 mg/L에서는 17.65% 및 19.70%를 나타냈다. Heo et al.(2009)의 연구결과 세발나물 추출물의 용매에 따른 DPPH radical 소거활성은 1,000 mg/L 농도에서 열수, 에탄올 및 메탄올 추출물이 각각 12.2%, 13.2% 및 12.0%를 보였다. 따라서 본 연구의 세발나물 에탄올 추출물의 DPPH radical 소거능이 더 높게 나타난 것을 알 수 있었다. 열풍건조 및 동결건조 세발나물 추출물의 DPPH radical 소거 활성은 각각의 농도별 유의적인 차이는 보이지 않았지만 동결 건조된 세발나물 추출물이 상대적으로 높게 나타났다. 항산화 활성은 가열처리될 경우 열에 약한 항산화물질이 파괴되어 그 효능이 대체적으로 감소된다고 하였다(Kim et al. 2009; Chang & Kim 2011)의 연구결과 방아풀의 건조방법에 따른 농도별 전자 공여능의 순서는 동결건조, 데친 후 건조, 증제 후 건조, 전자파 건조한 순으로 높게나와 동결건조된 방아풀이 데침 및 증제 후 건조된 방아풀보다 높게 나타났다고 보고된 바 있다. 일반적으로 천연물질에 함유된 phenol 화합물과 flavonoid의 수산기는 radical에 수소를 공여함으로써 radical을 소거시키는 작용을 하는 것으로 알려지고 있다(Frankel 1993; Park et al. 2008). 본 연구에서는 세발나물의 DPPH radical 소거능은 건조방법과는 무관하게 유사한 결과를 보였지만 동결건조 시 다소 높게 나타난 이유는 총 polyphenol과 flavonoid 함량의 영향인 것으로 판단된다.
8. 항산화 지수
Rancimat의 항산화 지수는 유지를 고온가열 하면서 공기주입 시 유지가 산화되면서 생성되는 휘발성 산화물이 증류수 전기전도도를 증가시키는 차를 측정하여 유도 기간을 산출하여 유지 산패 정도를 측정하거나 항산화 물질 효율을 분석할 수 있는 원리이다(Yoon 2009). 세발나물의 에탄올 추출물에 지질산화 억제능을 살펴보기 위하여 Rancimat로 항산화 지수 측정 결과는 Table 6과 같다. 세발나물 에탄올 추출물의 항산화지수는 열풍건조 1.29, 동결건조 1.32로 비슷한 값을 보였고 항산화제인 비타민 C, BHT 및 BHA에 비해 유의적으로 낮았고, 시료가 첨가되지 않은 대조군보다는 유의적으로 높게 나타나 열풍건조 및 동결건조 세발나물의 soybean oil에 대한 산화 억제 효과가 있었다. Phenolic acid, flavonoid 등의 phenol 화합물은 식물체내에서 항산화 활성을 보이는 대표적 항산화 물질이다. 총 phenol 화합물은 항산화 활성과 서로 양의 상관관계가 있고 항산화 활성의 주된 성분으로는 phenol 화합물인 것으로 보고되었었다(Gheldof & Engeseth 2002). Kim et al.(2004)은 flavonoid 함량보다 총 polyphenol 함량이 많을수록 항산화 활성은 증가된다고 보고 하였으며 본 연구에서는 열풍건조 및 동결건조 세발나물 추출물에서도 flavonoid의 함량보다 polyphenol 함량이 더 높게 나타났다. 이러한 결과 건조방법에 따른 세발나물의 항산화 지수는 유의적인 차이를 보이지 않았지만 동결 건조된 시료에서 상대적으로 높게 나타난 것은 polyphenol 및 flavonoid 함량에 따라 유지 산화 억제 효과를 나타낸 것으로 보인다. 이러한 연구결과로 볼 때 동결건조 방식이 열풍건조 방식보다 세발나물의 항산화 효과를 높일 수 있는 방법이라 생각된다.
Ⅳ. 요약 및 결론
건조방법에 따른 세발나물 영양성분 분석 결과 조지방 함량은 열풍건조 세발나물이 유의적으로 높았고, 조회분 함량은 동결건조 세발나물이 유의적으로 높았다. 세발나물 유기산 함량은 동결건조 시료가 열풍건조 시료보다 oxalic acid, malic acid, citric acid, succinic acid 및 tartaric acid 함량은 유의하게 높았으며, formic acid 함량은 유의하게 낮았다. 비타민 A는 두 시료 모두 검출되지 않았고, 비타민 C와 비타민 E 함량은 동결건조 시료가 유의하게 높게 나타났다. 무기질 함량은 Na과 K이 두 시료 모두 높은 함량을 나타내었으며, 총 무기질의 함량은 동결건조 방법이 열풍건조 방법에 비하여 유의적으로 높게 나타났다. 총 polyphenol 함량은 열풍건조 및 동결건조 세발나물 각각 36.98 mg/g, 95.07 mg/g로 나타났고, 총 flavonoid 함량은 열풍건조 세발나물 10.53 mg/g, 동결건조 세발나물 21.53 mg/g으로 동결건조 세발나물의 총 polyphenol 및 총 flavonoid 함량이 열풍건조 세발나물에 비하여 유의하게 높았다. 열풍건조 및 동결건조 세발나물 추출물의 DPPH radical 소거능은 농도가 증가될수록 DPPH radical 소거능도 증가하였으나, 건조방법별 세발나물 추출물의 DPPH radical 소거능은 농도별 유의적인 차이는 보이지 않았지만 동결건조된 세발나물의 함량이 상대적으로 높았다. 열풍건조 및 동결건조 세발나물 추출물의 항산화지수도 비슷한 경향을 나타내었다 . 이상의 결과 저온으로 진행하는 동결건조 방법이 열풍건조 방법에 비하여 영양성분이 높게 나타났고, 항산화 효과 증대에도 최적의 방법이라 생각된다.
Acknowledgments
This research was supported by the 2019 research fund of Chosun University.
References
- AOAC(1997) Official methods of analysis. 16th ed. Association of Official Analytical Chemists(No. 934. 06), Arlington, VA, USA
-
Biois MS(1958) Antioxidant determinations by the use of a stable free radical. Nature 181, 1199-1203
[https://doi.org/10.1038/1811199a0]

- Chae SK, Kang GS, Ma SJ, Bang KW, Oh MW, Oh SH(2002) Standard food analysis. Paju: Jigu-moonwha sa, pp381-382
-
Chang Y, Kim J(2011) Effects of pretreatment and drying methods on the quality and physiological activities of garlic powders. J Korean Soc Food Sci Nutr 40(12), 1680-1687.
[https://doi.org/10.3746/jkfn.2011.40.12.1680]

-
Cho JY, Huang Z, Park SY, Park KH, Pai TK, Kim SY, Kim HR, Ham KS(2014) The effects of several halophytes on insulin resistance in Otsuka Long-Evans Tokushima Fatty rats. Korean J Food Sci Technol 46(1), 100-107.
[https://doi.org/10.9721/KJFST.2014.46.1.100]

- Cho JY, Yang SY, Yu SO, Kim BW, Jang HG, Chon SU, Park YJ, Heo BG(2005) The actual distributing states of the fresh wild vegetables at five-day traditional markets in Jeonnam district. Korean J Hort Sci Technol 23(4), 396-401
-
Choi JI, Kim YJ, Kim JH, Song BS, Yoon YH, Byun MW, Kwon JH, Chun SS, Lee JW(2009) Antioxidant activities of the extract fractions from Suaeda Japonica. J Korean Soc Food Sci Nutr 38(2), 131-135.
[https://doi.org/10.3746/jkfn.2009.38.2.131]

-
Chung HS, Kim IH, Kim SH, Lee JH(2013) Antioxidant properties of Pinus koraiensis needle powder extracts as influenced by drying methods. Food Eng Prog 17(4), 396-400.
[https://doi.org/10.13050/foodengprog.2013.17.4.396]

- Folin O, Denis W(1912) On phosphotungastic phosphomolybdic compounds as color regents. J Biol Chem 12, 239-249
-
Frankel EN, Kanner J, German JB, Parks E, Kinsella JE(1993) Inhibition of oxidation of human low-density lipoprotein by phenolic substances in red wine. Lancet 341(8843), 454-457.
[https://doi.org/10.1016/0140-6736(93)90206-V]

-
Gheldof N, Engeseth NJ(2002) Antioxidants capacity of honeys from various flora sources based on the determination of oxygen radical absorbance capacity and inhibition of in vitro lipoprotein oxidation in human serum samples. J Agric Food Chem 50(10), 3050-3055.
[https://doi.org/10.1021/jf0114637]

- Heo BG, Park YJ, Park YS, Im MH, Oh KT, Cho JY(2009) Distribution status, physicochemical composition, and physiological activity of Spergularia marina cultivated in the western region in Jeon-Ra-Nam-Do. Korean J Community Living Sci 20(2), 181-191
- Hong GJ(2011) Bread development and usage plan of added halophyte Suaeda glauca and Spergularia marina. Doctoral thesis, Kyonggi University, Suwon, pp31-32
-
Jeong JH, Kim S, Lee JH, Choi WY, Lee KB, Cho KM(2014) Germination and growth response of Spergularia marina Griseb by salt concentration. Korean J Crop Sci 59(2), 139-143.
[https://doi.org/10.7740/kjcs.2014.59.2.139]

- Joo KJ, Kim JJ(2002) Oxidative stability and flavor compounds of sesame oils blended with vegetable oils. Korean J Food Sci Technol 34(6), 499-502
-
Jung BM, Park JA, Bae SJ(2008) Growth inhibitory and quinone reductase induction activities of Salicornia herbacea L. fraction on human cancer cell lines in vitro. J Korean Soc Food Sci Nutr 37(2), 148-153.
[https://doi.org/10.3746/jkfn.2008.37.2.148]

- Jung GT, Ju IO, Choi JS, Hong JS(2000) The antioxidative, antimicrobial and nitrite scavenging effects of Schizandra chinensis RUPRECHT(Omija) seed. Korean J Food Sci Technol 32(4), 928-935
-
Kawaguchi K, Mizuno T, Aida K, Uchino K(1997) Hesperidin as an inhibitor of lipases from porcine pancreas and Pseudomonas. Biosci Biotecnol Biochem 61(1), 102-104.
[https://doi.org/10.1271/bbb.61.102]

-
Kim AR, Lee HJ, Jung HO, Lee JJ(2014) Physicochemical composition of ramie leaf according to drying methods. J Korean Soc Food Sci Nutr 43(1), 118-127.
[https://doi.org/10.3746/jkfn.2014.43.1.118]

- Kim DH, Lim DW, Bai S, Chun SB(1997) Fermentation characteristics of whole soybeans meju model system inoculated with 4 Bacillus strain. Korean J Food Sci Technol 29(5), 1006-1015
-
Kim DS, Lee SM, Joo N(2016a) Quality characteristics and optimization of rice cookies prepared by substituting salt with Spergularia marina L. Griseb. Korean J Food Cook Sci 32(3), 279-289.
[https://doi.org/10.9724/kfcs.2016.32.3.279]

-
Kim DS, Shin JH, Joo NM(2016b) Quality characteristics and optimization of rice muffins prepared by substituting salt with Spergularia marina L. Griseb using response surface methodology. Korean J Food Nutr 29(2), 186-199.
[https://doi.org/10.9799/ksfan.2016.29.2.186]

- Kim EY, Baik IH, Kim JH, Kim SR, Rhyu MR(2004) Screening of the antioxidant activity of some medicinal plants. Korean J Food Sci Technol 36(2), 333-338
- Kim HJ, Jun BS, Kim SK, Cha YS(2000) Polyphenolic compound content and antioxidative activities by extracts from seed, sprout and flower of safflower (Carthamus tinctiorius L.). J Korean Soc Food Sci Nutr 29(6), 1127-1132
- Kim JH, Song JY, Lee JM, Oh SH, Lee HJ, Choi HJ(2010) A study on physiochemical property of Salicornia herbaciea & Suaeda japonica. J Food Hyg Safety 25(2), 170-179
-
Kim JY, Lee JA, Park SY(2007) Antibacterial activities of Oenothera laciniata extracts. J Korean Soc Food Sci Nutr 36(3), 255-261.
[https://doi.org/10.3746/jkfn.2007.36.3.255]

-
Kim MH, Jang HL, Yoon KY(2012) Changes in physicochemical properties of Haetsun vegetables by blanching. J Korean Soc Food Sci Nutr 41(5), 647-654.
[https://doi.org/10.3746/jkfn.2012.41.5.647]

- Kim MJ, Kim IJ, Nam SY, Lee CH, Yun T, Song BH(2006) Effects of drying methods on content of active components, antioxidant activity, and color values of Saururus chinensis bail. Korean J Medicinal Crop Sci 14(1), 8-13
- Kim MS(2013) Isolation and structural elucidation of antioxidants from Spergularia marina Griseb. Master’s thesis, Chonnam National University, pp1-4
- Kim YH(2003) A study on the antioxidant activity of glasswort(Salicornia herbacea L.). Master thesis, Dongshin University, pp32-33
- Kim YM, Choi MS, Bae JH, Yu SO, Cho JY, Heo BG(2009) Physiological activity of bang-a, aster and lettuce greens by the different drying methods. J Bio- Environ Control 18(1), 60-66
- Kong HM(2015) Physicochemical composition and antioxidant activity of Spergularia marina Griseb and quality characteristics of cookies added with Spergularia marina Griseb. Master’s thesis, Chosun University, pp1-33
- Korea Food and Drug Association(2005) Food standards codex, Korean Foods Industry Association, pp367-368, pp383-385
- Lee BM, Shim SI, Lee SK, Kang BH(1999) Physiological response on saline tolerance between halophytes and glycophytes. Korean J Environ Agr 18(1), 61-65
-
Lee HJ, Kim YA, Ahn JW, Lee BJ, Moon SG, Seo YW(2004) Screening of peroxynitrite and DPPH radical scavenging activities from salt marsh plants. Korean J Biotechnol Bioeng 19(1), 57-61
[https://doi.org/10.4217/OPR.2004.26.1.059]

-
Lee JJ, Jung HO(2012) Changes in physicochemical properties of Spergularia marina Griseb by blanching. Korean J Food Preserv 19(6), 866-872.
[https://doi.org/10.11002/kjfp.2012.19.6.866]

-
Lee JJ, Kim MN, Kim SW, Kim YJ, Kim JH, Yang YM, Seo YK, Ju JH(2017) Changes in antioxidant and cancer cell growth inhibitory activities of Spergularia marina Griseb extract according to different cooking methods. Korean J Food Cook Sci 33(6), 673-681.
[https://doi.org/10.9724/kfcs.2017.33.6.673]

-
Lee KS, Gim JC, Son SM, Lee KY(2011) Antioxidative effect of Suaeda japonica ethanol extract and solvent partitioned fractions. J Korean Soc Food Sci Nutr 40(6), 804-808.
[https://doi.org/10.3746/jkfn.2011.40.6.804]

-
Lee KI, Kim SM(2009) Antioxidative and antimicrobial activities of Eriobotrya japonica Lindl. leaf extracts. J Korean Soc Food Sci Nutr 38(3), 276-273.
[https://doi.org/10.3746/jkfn.2009.38.3.267]

- Lee KS, Kim AJ, Lee KY(2012) Analysis of chemical composition and antioxidant activity of Suaeda japonica. J East Asian Soc Diet Life 22(4), 521-526
-
Lin TM, Durance TD, Scaman CH(1998) Characterization of vacuum microwave, air and freeze dried carrot slices. Food Res Int 31(2), 111-117.
[https://doi.org/10.1016/S0963-9969(98)00070-2]

- Lee WY, Lee SW, Lee BS, Cha WS, Park JH, Oh SL, Cho YJ, Kim JK, Hong JH(2004) Diffusion of salt and drying characteristics of beef jerky. Korean J Food Preserv 11(4), 508-515
-
Lokhande VH, Suprasanna P(2012) Prospects of halophytes in understanding and managing abiotic stress tolerance. In: Environmental adaptations and stress tolerance of plants in the era of climate change. Parvaiz A, Prasad, MNV.(eds.) New York: Springer, pp29-56
[https://doi.org/10.1007/978-1-4614-0815-4_2]

- Middleton E Jr, Kandaswami C(1994) Potential health promoting properties of citrus flavonoids. Food Tech 48(11), 115-119
-
Munna R, Termaat A(1986) Whole-plant response to salinity. Aus J Plant Physiol 13(1), 143-160
[https://doi.org/10.1071/PP9860143]

- Park NH(1995) General outline and status of application for freeze-drying. Korean J Air-Cond Refrig Eng 24(3), 338-345
- Park SN, Jeon SM, Kim SY, Ahn JY(2007) Antioxidative properties of extract/fractions of Suaeda asparagoides and Salicornia herbacea extracts(I). J Soc Cosmet Scientists Korea 33(3), 145-152
-
Park YH, Lee JJ, Son HK, Kim BH, Byun J, Ha JH(2020) Antiobesity effects of extract from Spergularia marina Griseb in adipocytes and high-fat diet-induced obese rats. Nutr 12(2), 336.
[https://doi.org/10.3390/nu12020336]

- Park YK, Choi SH, Kim SH, Jang YS, Han JY, Chung HG(2008) Functional composition and antioxidant activity from the fruits of Rubus coreanus according to cultivars. Mokchae Konghak 36(1), 102-109.
-
Que F, Mao L, Zhu C, Xie G(2006) Antioxidant properties of Chinese yellow wine, its concentrate and volatiles. LWT-Food Sci Technol 39(2), 111-117.
[https://doi.org/10.1016/j.lwt.2005.01.001]

-
Rizzolo A, Formi E, Polesello A(1984) HPLC assay of ascorbic acid in fresh and processed fruit and vegetables. Food Chem 14(3), 189-199.
[https://doi.org/10.1016/0308-8146(84)90058-X]

- Shim HK, Noh TH, Choi MY, Lee HJ, Lee DK, Paik CH, Kim HM(2013) Sclerotinia rot of Spergularia marina caused by Sclerotinia sclerotinia and environmental condition for disease development. J Agriculture Life Sci 44(2), 46-49
-
Son HK, Kong HM, Cha SS, Choi YJ, Lee JJ(2015) Quality characteristics of cookies added with Spergularia marina Griseb powder. Korean J Food Preserv 22(2), 211-217.
[https://doi.org/10.11002/kjfp.2015.22.2.211]

-
Son SM, Kwon HO, Lee JH(2011) Physicochemical composition of Capsosiphon fulvescens according to drying methods. J Korean Soc Food Sci Nutr 40(11), 1582-1588.
[https://doi.org/10.3746/jkfn.2011.40.11.1582]

-
Thongchai W, Liawruangrath B, Liawruangrath S(2009) Flow injection analysis of total curcuminoids in turmeric and antioxidant capacity using 2,2' diphenyl-1-picrylhydrazyl assay. Food Chem 112(2), 494-499.
[https://doi.org/10.1016/j.foodchem.2008.05.083]

-
Wink M(1997) Compartmentation of secondary metabolites and xenobiotics in plant vacuoles. Adv Botan Res 25, 141-169.
[https://doi.org/10.1016/S0065-2296(08)60151-2]

- Yang HS(1999) A syntaxonomical study on the vegetation of ruined salt field in Chonnam province. Korean J Ecol 22(5), 265-270
-
Yoon SY, Choi JS, Lee SY, Kim KBWR, Song EJ, Kim SJ, Lee SJ, Lee CJ, Kim TW, Ahn DH(2009) Effect of Morus alba root bark, Ecklonia stolonifera, and Curcuma aromatica extracts on shelf-life and quality of castella. J Korean Soc Food Sci Nutr 38(10), 1444-1451.
[https://doi.org/10.3746/jkfn.2009.38.10.1444]