추출방법에 따른 개다래 열매의 항산화 활성 및 암세포 증식억제 효과 비교
조선대학교 영양교육대학원 대학원생1)조선대학교 식품영양학과 부교수
1)Associate Professor, Dept. Food and Nutrition, Chosun University, Gwangju, Korea
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The aim of this study was to evaluate the antioxidant activities and cytotoxicities of Actinidia polygama fruit extracts (AP) obtained using two extraction methods on cancer cells. AP yield was greater for an 80% ethanol extract than for a water extract (38.76% vs. 37.50%). Total polyphenolic and total flavonoid contents in AP obtained by ethanol extraction (AP-EE) were greater than those obtained by water extraction (AP-WE). Free radical scavenging activity and reducing power were greater for AP-EE than AP-WE. Mean antioxidant activities of AP-EE and AP-WE (1.0 mg/mL) as determined by the FRAP method were 28.57 and 27.50 μM, respectively. Furthermore, both AP-EE and AP-WE AP at 0.1 mg/mL inhibited the proliferation of MCF-7 and HeLa cancer cell lines for 48 hours. The study shows AP-EE and AP-WE have potential use as antioxidant and anticancer agents.
Keywords:
Actinidia polygama (A. polygama), antioxidant activity, anti-proliferation effect, cancer cellsI. 서론
개다래(Actinidia polygama)는 측막태좌목(parietales)으로 쌍떡잎식물 중 하나로, 다래나무(미후리)과(Actinidiaceae)에 속하고 깊은 산속 나무 밑이나 계곡에서 자생한다. 우리나라 전 지역 각처에서 자라며 중국과 일본 등에 분포하는 낙엽 활엽 덩굴식물이다(Ryu 2003). 말다래나무 라고도 하며 길이 약 5 m로 줄기 속이 희며 잔가지에는 어릴 때 연한 갈색 털이 나며 가시 같은 억센 털이 드물게 나기도 한다. 잎은 넓은 달걀 모양 또는 타원형으로 끝은 뾰족하다. 잎 앞면의 상반부가 흰색으로 변하기도 하고 잎맥 위에는 갈색 털과 잔 톱니가 있다. 6월에서 7월경 가지 윗부분인 잎겨드랑이에 흰색 꽃이 지름 1.5 cm로 3개에서 10개 정도 달린다. 꽃받침과 꽃잎은 각각 5개씩이고 향기가 있다. 열매는 장과로서 긴 타원형으로 9월에서 10월경 누렇게 익어가며 아래로 늘어지며, 혓바닥을 쏘는 듯한 맛이 나고 달지 않다. 개다래나무의 과실에는 단백질, 유기산, 비타민 A, 비타민C, 비타민 P, 탄닌, 자당, 전분, 점액질 등의 성분이 함유되어 있고(Yu et al. 2010), 거풍이나 통기의 효능을 가지고 있어 산통, 요통, 안면신경마비, 중풍 등에 효과가 있다고 알려져 있다. 또한 혈중 요산치를 낮춰주는 활성이 있어 고요산혈증 질환에도 효과가 있음이 보고된 바 있다(Kang 2003).
활성산소종(reactive oxygen species, ROS)는 정상적인 세포 기능을 유지하는 데 필요한 생리 조건에서 낮은 수준으로 생성되며, 신체의 내인성 항산화 방어 시스템의 유해한 영향으로부터 보호하는 역할을 한다(Sánchez 2016). 하지만 ROS 수준이 방어 메커니즘을 초과하면 핵산 손상, 단백질 산화 및 지질 과산화를 유발하여 세포의 정상적인 기능에 영향을 미칠 수 있다. 식물 중에 포함된 여러 생리활성물질들은 여러 항산화물질을 포함하고 있으며 ROS와 같은 산화 작용으로부터 생체를 보호하거나 예방하는 역할을 하는 것으로 알려져 있다(Valko et al. 2004). 일반적으로 사용되는 합성 항산화제인 butyl-hydroxyanisole(BHA)와 butylated hydroxytoluene(BHT)는 과량 섭취할 경우 간, 위장점막, 폐, 신장, 순환계 질환 등에 다소 심각한 독성작용을 일으킨다고 알려져 있다(Williams et al. 1999). 따라서 인체에 무해하고 부작용이 적으며 항산화력이 우수한 여러 가지 천연 항산화제에 대한 연구가 지속적으로 필요한 실정이라 할 수 있다(Branen 1975).
본 연구에서는 개다래 열매의 항산화활성을 알아보기 위해 추출방법을 달리하여 조사하고자 한다. 또한 암세포주를 이용하여 개다래 열매 추출물이 암세포 억제능에 미치는 영향을 알아보고자 하였다.
Ⅱ. 연구방법
1. 실험재료
개다래 열매는 충청북도 제천시에서 채취하여 자연건조 시킨 후 분말화한 제품을 국산 약재 전문 사이트인 자연초(주)로부터 2020년 3월 구입 하였으며 분석 시까지 시료를 -70℃에서 보관하여 사용하였다.
2. 시료추출
개다래 열매 분말 시료 일정량에 20배 부피의 80% 에탄올 및 증류수를 플라스크에 붓고 환류냉각관이 부착된 65℃의 heating mantle(Mtops ms-265, Seoul, Korea)에서 3회에 걸쳐 3시간씩 반복 가열 추출하였다. 이후 얻어진 각각의 추출액을 모아 whatman filter paper(Whatman No.2)로 여과한 후 80% 에탄올 여과액을 rotary vacuum evaporator(EYELA VACUUM NVC-1100, Tokyo, Japan)를 이용하여 40℃ 수욕상에서 감압ㆍ농축하였으며 80% 에탄올을 증발시킨 농축액을 동결건조 후 –70℃ 냉동고에 보관하였다가 분석 시 사용하였다.
3. 총 플라보노이드 및 총 폴리페놀 함량
Davis법을 변형한 Chae et al.(2002)의 방법에 따라 총 플라보노이드 함량을 측정하였다. 개다래 열매 에탄올 추출물과 증류수 추출물 0.5 mL와 diethylene glycol(Sigma, St. Louis, MO, USA) 0.5 mL를 혼합한 후 1N NaOH 10 µL을 첨가하여 37℃ heating block에서 1시간 동안 반응시키고, 이후 분광광도계(Bio-rad, Hercules, CA, USA)를 이용하여 96 well plate에 200 µL씩 분주한 후 420 nm에서 흡광도를 측정하였다. 이때 총 플라보노이드 함량은 표준물질 rutin(Sigma, St. Louis, MO, USA)을 이용하여 적용한 표준검량곡선으로부터 산출하였다. 총 폴리페놀 함량은 Folin-Denis의 방법(1912)을 응용하여 측정하였다. 각각의 개다래 열매 에탄올 추출물과 증류수 추출물에 0.5 mL의 Folin reagent (Sigma, St. Louis, MO, USA)를 혼합하여 실온에서 3분간 반응시킨 다음 0.8 mL의 10% Na2CO3용액을 넣고 40분간 암실에서 반응시켰다. 분광광도계(Bio-rad, Hercules, CA, USA)를 이용하여 96 well plate에 200 µL씩 분주한 후 760 nm에서 흡광도를 측정하였다. 이때 총 폴리페놀 함량은 tannic acid(Sigma, St. Louis, MO, USA)를 표준물질로 이용하여 적용한 표준검량곡선으로부터 산출하였다.
4. DPPH 라디칼 소거 활성
Blois의 방법(1958)을 이용하여 개다래 열매의 에탄올 추출물과 증류수 추출물의 2,2-diphenyl-1-picryhydrazyl(DPPH) 라디칼 소거능을 다음과 같이 측정하였다. 0.2 mM DPPH 시약(Sigma, St. Louis, MO, USA) 900 µL를 각각의 농도별로 조제한 시료100 µL에 가한 후 잘 혼합하여 37℃ heating block에 30분간 반응시켰다. 이후 분광광도계(Bio-rad, Hercules, CA, USA)를 이용하여 517 nm에서 흡광도를 측정하였다.
5. ABTS+ 라디칼 소거능 측정
Re의 방법(1999)을 변형하여 개다래 열매의 에탄올 추출물과 증류수 추출물의 ABTS+ 라디칼 소거능을 다음과 같이 측정하였다. 7 mM ABTS (Sigma, St. Louis, MO, USA)와 2.4 mM potassium per-sulfate를 1:1의 비율로 혼합한 후 라디칼 생성을 유도하기 위해 암실에서 24시간 동안 반응시켰다. 반응이 끝난 ABTS+ 시약을 메탄올로 희석하여 734 nm에서 측정한 흡광도 값이 0.70 ± 0.02가 되도록 희석하였다. 900 µL의 희석한 ABTS+ 용액에 각각의 농도별로 조제한 시료 100 µL을 첨가한 후 37℃ heating block에 30분간 반응시킨 다음 분광광도계(Bio-rad, Hercules, CA, USA)를 이용하여 734 nm에서 흡광도를 측정하였다.
6. Ferric reducing antioxidant power(FRAP) 활성
Benzie & Strain(1996)의 방법을 변형하여 FRAP assay를 다음과 같이 측정하였다. FRAP reagent는 300 mM sodium acetate buffer (pH 3.6)(Sigma-Aldrich, Louis, MO, USA) 10mL, 10 mM 2,4,6-tris(2-pyridyl)-s-triazine (TPTZ) (Sigma-Aldrich, Louis, MO, USA) 1mL, 20 mM ferric chloride(Sigma-Aldrich, Louis, MO, USA) 1mL를 혼합하여 사용하였다. 추출법을 달리한 각각의 시료 10 μL와 증류수 90 μL를 FRAP reagent 200 μL와 혼합하여 30분 동안 암실에서 반응시킨 후 분광광도계(Bio-rad, Hercules, CA, USA)를 이용하여 593 nm에서 흡광도를 측정하였다. 이때 표준물질로 iron sulfate hexahydrate (Sigma-Aldrich, Louis, MO, USA)를 이용하여 표준검량곡선을 적용하였으며 추출물 1 mg에 들어있는 iron sulfate hexahydrate의 μM 함량으로 나타내었다.
7. Reducing power 측정
Oyaizu(1986)의 방법을 변형하여 다음과 같이 측정하였다. 농도별로 조제한 개다래 열매의 에탄올 추출물 및 증류수 추출물 200 μL에 0.2 M phosphate buffer(pH 6.6)와 1% potassium ferricyanide 각각 200 μL씩 첨가한 후 50℃에서 20분 동안 방치시키고 그 후 200 μL의 10% trichloroacetic acid(TCA)를 첨가하였다. 원심분리기를 이용하여 분리된 상층액과 0.1% ferric chloride를 100 μL 첨가한 후 실온에서 10분 동안 반응시킨 후 700 nm에서 흡광도를 측정하였다.
8. 세포배양
MCF-7(인체유방암세포주)과 HeLa(인체자궁암세포주)는 한국세포주은행(Seoul, Korea)에서 분양받았으며 1% penicillin/streptomycin과 10% fetal bovine serum(FBS; Gibco-BRL, Grand Island, NY, USA)을 포함한 RPMI 1640 배지(Gibco-BRL Co.)를 사용하여 37℃, 5% CO2 조건에서 배양하였다.
9. MTS assay
MCF-7과 HeLa 세포를 이용한 암세포 증식 억제에 관한 실험은 CellTiter 96 ® AQueous One Solution Cell Proliferation Assay(MTS; Promega, CA, USA)를 이용하여 측정하였다. 각각의 배양된 세포에 0.025, 0.05, 0.1, 0.2, 0.4, 0.8 mg/mL의 농도로 희석한 개다래 열매의 에탄올 추출물 및 증류수 추출물을 첨가하여 48시간 처리한 후, MTS 용액을 첨가하고 UV-spectrophotometer (Bio-rad, Hercules, CA, USA)를 이용하여 490 nm에서 흡광도를 측정하였다.
10. 통계처리
모든 실험에 있어서 3회씩 독립적 반복을 통해 결과를 얻었으며, GraphPad Prism 6 program (GraphPad Software, Inc., La Jolla, CA, USA)을 이용하여 각 실험군 간의 유의성 검증을 실시하였고 평균(mean)과 표준편차(SD)로 나타내었다. p<0.05 수준에서 Student’s t-test와 분산분석(one-way ANOVA)을 실시하여 각 시료 간의 통계적 유의성을 검증하였다.
Ⅲ. 결과 및 고찰
1. 총 플라보노이드 및 총 폴리페놀 함량
개다래 열매의 에탄올 추출물과 증류수 추출물의 추출수율은 각각 38.76%와 37.50%로 나타났다. 플라보노이드는 여러 식물에 존재하는 대표적인 항산화성 물질이며, 지질 과산화물과 반응성 산소종의 생성을 억제하고 다양한 생리활성을 나타내는 것으로 알려져 있다(Heim et al. 2002). 본 연구에서 개다래 열매의 총 플라보노이드 함량을 측정한 결과, 개다래 열매의 에탄올 추출물은 12.54 mg RE/g이었으며 증류수 추출물은 11.31 mg RE/g으로 두 군간의 유의적인 차이를 나타내었다(Table 1). 하나 이상의 벤젠링과 한 개 이상의 수산기를 구성하는 폴리페놀류는 식이 내 항산화 작용과 항염증 작용 등을 하는 것으로 알려져 있다(Bors et al. 2002). 개다래 열매의 에탄올 추출물과 증류수 추출물의 총 폴리페놀 함량은 각각 168.98 mg TAE/g과 152.96 mg TAE/g으로 두 군간의 유의적인 차이를 나타냈다. Kwak & Lee(2014)의 연구결과에 따르면 전라북도 진안군에서 채취한 다래나무과에 속하는 다래순 건나물의 에탄올 추출액의 총 폴리페놀 및 플라보노이드 함량이 각각 32.99 mg tannic acid/g dry wt와 29.32 mg rutin/g dry wt인 것으로 보고되어 본 연구와 다소 차이를 보였다.
2. DPPH 라디칼 소거능
산화환원반응으로부터 전자의 활동을 조사할 수 있는 방법으로 DPPH를 이용한 전자공여능 측정이 널리 사용되고 있다(Hu et al. 2004). 개다래 열매의 에탄올 추출물과 증류수 추출물을 이용하여 DPPH 라디칼 소거능을 측정한 결과는 Table 2와 같다. 개다래 열매의 에탄올 추출물을 이용한 DPPH 라디칼 소거능을 측정한 결과, 16.21%(0.125 mg/mL), 20.38%(0.25 mg/mL), 43.03%(0.5 mg/mL), 74.82%(1 mg/mL)로 나타났으며, 50% 라디칼 소거능의 값인 IC50는 0.64 mg/mL 이었다. 개다래 열매 증류수 추출물을 이용한 DPPH 라디칼 소거능은 7.97% (0.125 mg/mL), 16.72%(0.25 mg/mL), 31.98%(0.5 mg/mL), 58.58%(1 mg/mL)를 나타내었으며, 50% 라디칼 소거능의 값인 IC50는 0.84 mg/mL 으로 나타나, 개다래 열매 에탄올 추출물의 DPPH 라디칼 소거능이 개다래 열매 증류수 추출물에 비해 뛰어남을 확인하였다. Oh et al.(2011)의 연구결과에 따르면 제주산 참다래 추출물의 DPPH radical 소거활성을 측정한 결과, 0.5 mg/mL 완숙과 참다래 추출물에서 품종별로 43.94~76.96%의 결과를 얻어 본 논문과 다소 차이를 보였다.
3. ABTS+ 라디칼 소거능
ABTS 라디칼 소거능의 측정방법으로는 ABTS 용액과 potassium persulfate의 반응에 의해 생성된 ABTS 양이온이 추출물의 항산화력에 의해 제거되는 것을 이용한 것이다. 본 연구 결과, 개다래 열매의 에탄올 추출물을 이용한 ABTS+ 라디칼 소거능은 0.125, 0.25, 0.5, 1 mg/mL 농도에서 각각 35.61, 63.68, 94.08, 96.74%를 나타내었고, 50%의 라디칼 소거능의 값인 IC50은 0.22 mg/mL를 나타냈다. 개다래 열매 증류수 추출물을 이용한 ABTS+ 라디칼 소거능은 0.125, 0.25, 0.5, 1 mg/mL 농도에서 28.23, 52.88, 89.25, 94.35%를 나타내었으며, 50%의 라디칼 소거능의 값인 IC50을 구한 결과, 개다래 열매 물 추출물은 0.26 mg/mL를 나타냈다. 따라서 개다래 열매 증류수 추출물에 비해 에탄올 추출물의 ABTS+ 라디칼 소거능이 우수함을 확인하였다.
4. Reducing power 분석
Reducing power 환원력은 시료가 Fe3+에 수소를 공여하여 라디칼을 안정화시킴으로써 Fe2+로 환원되는 것을 이용한 방법으로 널리 사용된다(Hwang & Thi 2014). 개다래 열매의 에탄올 추출물과 증류수 추출물의 reducing power 측정 결과는 Table 4와 같다. 개다래 열매의 에탄올 추출물을 이용한 환원력은 0.125, 0.25, 0.5, 1, 2 mg/mL 농도에서 각각 0.05, 0.10, 0.22 0.43, 0.67을 나타내었다. 개다래 열매 증류수 추출물의 환원력은 0.125, 0.25, 0.5, 1, 2 mg/mL 농도에서 각각 0.04, 0.05, 0.24, 0.34, 0.51을 나타내었다. 개다래 열매의 에탄올 추출물과 증류수 추출물의 환원력은 농도 의존적으로 증가하였으며, IC50 값은 각각 1.42와 1.81로 개다래 열매의 증류수 추출물에 비해 에탄올 추출물이 더 뛰어난 것을 알 수 있었다. Jeong(2007)의 연구 결과에 따르면 다래나무과에 속하는 한국산 골드키위 열수추출물을 이용한 환원력을 분석한 결과 1.5 mg/mL를 첨가하였을 때 0.27 의 환원력을 나타내었으며 본 실험의 개다래 열매의 에탄올 추출물과 증류수 추출물의 환원력과 비교하였을 때 다소 차이를 나타내었다.
5. FRAP 분석
FRAP은 항산화물질에 의해 ferric 2,4,6-tripyridyl-striazine[Fe(III)-TPIZ]를 ferrous 2,4,6-tripyridyls-triazine[Fe(II)-TPIZ] 혼합물로 환원되는 원리로 고안된 방법으로 항산화 측정에 널리 이용되고 있다(Benzie & Strain 1996). 개다래 열매의 에탄올 추출물과 증류수 추출물의 FRAP 활성은 Table 5에 나타내었다. 개다래 열매 추출물(1.0 mg/mL)의 FRAP 활성을 측정한 결과, 개다래 열매의 에탄올 추출물은 28.57 μM, 개다래 열매 증류수 추출물은 27.50 μM으로 개다래 열매의 에탄올 추출물의 FRAP 활성이 물 추출물의 FRAP 활성보다 유의적으로 더 높음을 알 수 있었다.
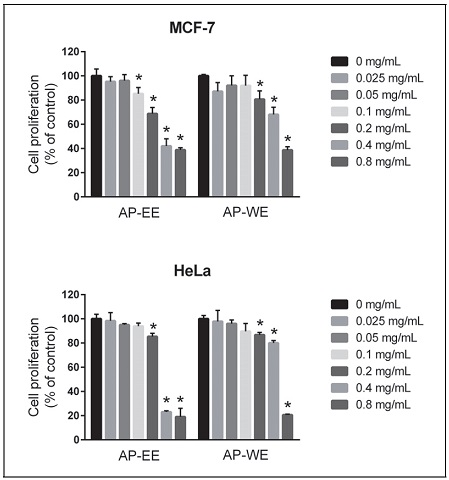
6. 개다래 열매 추출물이 암세포의 성장에 미치는 영향
추출 용매에 따른 개다래 열매 추출물이 암세포의 증식억제에 미치는 효과를 확인하기 위해 유방암세포주인 MCF-7과 자궁암세포주인 HeLa를 이용하여 48 시간동안 진행하였다. MCF-7 세포주에 개다래 열매 추출물을 48 시간동안 처리한 결과 개다래 열매 에탄올 추출물은 0.1, 0.2, 0.4. 0.8 mg/mL 농도에서, 개다래 열매 증류수 추출물은 0.2, 0.4. 0.8 mg/mL 농도에서 대조군에 비해 유의적으로 세포 생존율이 감소하는 것을 확인하였다(Fig. 1). 또한 HeLa 세포주에 개다래 열매추출물을 48 시간동안 처리한 결과 개다래 열매 에탄올과 증류수 추출물은 모두 0.2, 0.4. 0.8 mg/mL 농도에서 대조군에 비해 유의적으로 세포 생존율이 감소하는 것을 확인하였다(Fig. 1).
Ⅳ. 요약 및 결론
본 연구는 개다래 열매의 에탄올 추출물과 증류수 추출물을 이용하여 총 플라보노이드 및 총 폴리페놀 함량, DPPH, ABTS+ assay, reducing power 및 FRAP 분석을 이용한 free radical 소거능을 측정하고, 인체 유래 암세포인 MCF-7와 HeLa 세포주를 이용하여 개다래 열매의 에탄올 추출물과 증류수 추출물 처리에 의해 유발되는 세포의 증식 억제에 미치는 영향에 관하여 연구하였다. 본 실험 결과, 개다래 열매 에탄올 추출물의 총 플라보노이드 함량 및 총 폴리페놀 함량은 각각 12.54 mg RE/g, 168.98 mg TAE/g이었으며 개다래 열매 증류수 추출물의 총 플라보노이드 함량 및 총 폴리페놀 함량은 각각 11.31 mg RE/g, 152.96 mg TAE/g로 개다래 열매 에탄올 추출물에서 유의적으로 높은 수치를 나타내었다. 개다래 열매 에탄올 추출물의 DPPH 와 ABTS+ assay를 이용한 IC50 값은 각각 0.64 mg/mL와 0.22 mg/mL이었으며, 개다래 열매 증류수 추출물의 경우는 각각 0.84 mg/mL와 0.26 mg/mL으로 개다래 증류수 추출물보다 에탄올 추출물이 보다 우수한 항산화 효과를 확인하였다. Reducing power와 FRAP 활성을 분석한 결과, 개다래 열매의 증류수 추출물보다 에탄올 추출물이 보다 우수함을 나타내었다. 개다래 열매 에탄올 및 증류수 추출물을 이용하여 MCF-7와 HeLa 암세포의 증식에 미치는 영향을 분석한 결과, 0.1 mg/mL 농도 이상의 개다래 열매 에탄올 추출물과 증류수 추출물에서 대조군에 비해 유의적으로 암세포의 증식을 억제하는 효과를 나타내었다. 위와 같은 결과를 통하여 개다래 열매 에탄올 추출물이 증류수 추출물에 비해 비해 우수한 항산화활성을 가지고 있으며, 에탄올 추출물과 증류수 추출물 모두에서 암세포 증식 억제효과를 가지고 있는 것으로 나타났다. 따라서 개다래 열매를 이용한 에탄올 추출법이 증류수 추출법이 비해 보다 높은 항산화 효과를 기대할 수 있을 것으로 여겨지며 이를 이용한 식품 소재 연구에 활용될 것을 기대한다.
References
-
Benzie IFF, Strain JJ(1996) The ferric reducing ability of plasma (FRAP) as a measure of “antioxdant power”: the FRAP assay. Anal Biochem 239(1), 70-76.
[https://doi.org/10.1006/abio.1996.0292]

-
Blois MS(1958) Antioxidant determination by the use of a stable free radical. Nat 181, 1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Bors W, Michel C(2002) Chemistry of the antioxidant effect of polyphenols. Ann N Y Acad Sci 957, 57-69.
[https://doi.org/10.1111/j.1749-6632.2002.tb02905.x]

-
Branen AL(1975) Toxicology and biochemistry of butylated hydroxyanisole and butylated hydroxytoluene. J Am Oil Chem Soc 52(2), 59-63.
[https://doi.org/10.1007/BF02901825]

- Chae SK, Kang GS, Ma SJ, Bang KW, Oh MW, Oh SH(2002) Standard food analysis. Paju: Jigu-MoonwhaSa, pp381-382
-
Folin O, Denis W(1912) On phosphotungastic-phosphomolybdic compounds as color regents. J Biol Chem 12(2), 239-249
[https://doi.org/10.1016/S0021-9258(18)88697-5]

-
Hwang ES, Thi ND(2014) Effects of extraction and processing methods on antioxidant compound contents and radical scavenging activities of laver (Porphyra tenera). Prev Nutr Food Sci 19(1), 40-48.
[https://doi.org/10.3746/pnf.2014.19.1.040]

-
Heim KE, Tagliaferro AR Tagliaferro, Bobilya DJ(2002) Flavonoid antioxidants: chemistry, metabolism and structure-activity relationships. J Nutr Biochem 13(10), 572-584.
[https://doi.org/10.1016/S0955-2863(02)00208-5]

-
Hu F, Lu R, Huang B, Liang M(2004) Free radical scavenging activity of extracts prepared from fresh leaves of selected Chinese medicinal plants. Fitoterapia 75(1), 14-23.
[https://doi.org/10.1016/j.fitote.2003.07.003]

-
Jeong CH, Lee WJ, Bae SH, Choi SG(2007) Chemical components and antioxidative activity of Korean gold kiwifruit. J Korean Soc Food Sci Nutr 36(7), 859-865
[https://doi.org/10.3746/jkfn.2007.36.7.859]

- Kang HJ(2003) Anti-inflammatory, analgesic, and hypouricemic activities of Actinidia polygama. Master’s Thesis, Kyung Hee University
-
Kwak CS, Lee JH(2014) In vitro antioxidant and anti-inflammatory effects of ethanol extracts from sprout of evening primrose (Oenothera laciniata) and gooseberry (Actinidia arguta). J Korean Soc Food Sci Nutr 43(2), 207-215.
[https://doi.org/10.3746/jkfn.2014.43.2.207]

-
Oh HJ, Jeon SB, Kang HY, Yang YJ, Kim SC, Lim SB(2011) Chemical composition and antioxidative activity of kiwifruit in different cultivars and maturity. J Korean Soc Food Sci Nutr 40(3), 343-349.
[https://doi.org/10.3746/jkfn.2011.40.3.343]

-
Oyaizu M(1986) Studies on products of browning reaction: antioxidative activities of products of browning reaction prepared from glucosamine. Jpn J Nutr 44, 307-315
[https://doi.org/10.5264/eiyogakuzashi.44.307]

-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C(1999) Antioxidant activity applying an improved ABTS radial cation decolorization assay. Free Radic Biol Med 26(9-10), 1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

- Ryu JB(2003) Classification of honey plants in Korea. Korean J Apicult 18, 5-22
-
Sánchez C(2016) Reactive oxygen species and antioxidant properties from mushrooms. Synth Syst Biotechnol 2(1), 13-22.
[https://doi.org/10.1016/j.synbio.2016.12.001]

-
Valko M, Izakovic M, Mazur M, Rhodes CJ, Telser J(2004) Role of oxygen radicals in DNA damage and cancer incidence. Mol Cell Biochem 266(1-2), 37-56.
[https://doi.org/10.1023/B:MCBI.0000049134.69131.89]

-
Williams GM, Iatropoulos MJ, Whysner J(1999) Safety assessment of butylated hydroxyanisole and butylated hydroxytoluene as antioxidant food additives. Food Chem Toxicol 37(9-10), 1027-1038.
[https://doi.org/10.1016/S0278-6915(99)00085-X]

- Yu MH, Chae IG, Choi JH, Im HG, Choi HD, Yang SA, Lee JH, Lee IS(2010) Effects of supercritical fluid marc extracts from Actinidia polygama Max. on inflammation and atherosclerosis. Korean J Food Sci Technol 42(4), 475-480