3T3-L1 세포에서 김치유산균 Weissella koreensis DB1 추출물의 지방분화 억제효과
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Weissella koreensis (W. koreensis) DB1 with high-ornithine-producing capacity was isolated from kimchi and shows the anti-adipogenic activity via its production of ornithine. This study was carried out the effects of W. koreensis DB1 cell extracts on the inhibition of adipogenesis in 3T3-L1 cells. MTT results showed that 0-0.75 μg/mL W. koreensis DB1 cell extracts had no significant effect on cell vability. The cell extracts of W. koreensis DB1 at non-cytotoxic concentrations significantly suppressed the differentiated 3T3-L1 cells by decreasing triglyceride level and intracellular lipid accumulation compared to that associated with the untreated control group. The major transcriptional factors involved in adipocyte differentiation, such as peroxisome proliferator-activated receptorγ (PPARγ), CCAAT/enhancer-binding proteinα (C/EBPα), and sterol regulatory element-binding transcription factor-1c (SREBP-1c), were down-regulated by the cell extracts of W. koreensis DB1 treatments compared with the untreated control group. Furthermore, the expressions of lipogenesis-related enzymes including acetyl-CoA carboxylase (ACC) and fatty acid synthase (FAS) genes were also decreased by the cell extracts of W. koreensis DB1 treatment. Accordingly, these results indicate that the cell extracts of W. koreensis DB1 treatment inhibited the adipogenesis and lipogenesis of 3T3-L1 cells, suggesting a protective role in adipocyte differentiation.
Keywords:
Weissella koreensis DB1, adipogenesis, 3T3-L1 cells, lipid accumulationⅠ. 서론
비만은 체지방조직의 증가뿐만 아니라 지방세포의 비대 증상에 의하여 체내에 지방이 과잉 축적되어 생긴 질병으로 비만의 원인은 에너지 섭취와 소비의 불균형, 유전체 이상, 내분비 장애, 불규칙한 생활습관 등 여러 원인이 제시되고 있다(Spiegelman & Flier 2001). 특히 비만은 지질대사 및 탄수화물대사 사이에 불균형을 초래하여 제 2형 당뇨병, 지방간, 고혈압, 고지혈증, 동맥경화, 관절염과 같은 퇴행성 만성질환 등 각종 대사성 질환, 심혈관계 질환 및 암 유발과 직접적인 상관관계가 있다고 보고되었다(Leung et al. 2003; Haslam & James 2005). 이와같이 대사성 질환을 유발하는 주요 요인인 비만은 식이 조절 요법, 에너지 소비증가, 지방세포의 증식과 분화 억제, 지방세포 내 지방축적 억제 및 축적된 지방분해를 통해서 예방이 가능하다(Wang & Jones 2004).
세포 수준에서 살펴본 비만은 지방전구세포의 분화과정 중 지방세포의 수와 크기가 증가가 원인이며, 분화과정에는 여러 가지 전사인자, 단백질 및 효소 등이 관여한다. 지방전구세포가 과다하게 분화하거나 분화된 지방세포가 과다하게 증식하게 되면 지방세포의 수가 많아지고, 지방 축적량이 증가되어 지방세포의 크기가 커지면서 비만으로 이어진다(Roncari et al. 1981; Gesta et al. 2007). 이와 관련하여 최근에는 비만 연구 모델로 마우스의 섬유모세포 유래된 3T3-L1 지방전구세포를 이용한 연구가 다양하게 진행되고 있다(Park et al. 2011; Moon et al. 2012; Park et al. 2013; Pi et al. 2014: Park et al. 2018; Lee et al. 2021a,b). 지방전구세포의 분화 및 지방세포의 지방축적을 억제하는 물질을 이용한 비만 치료 혹은 예방의 가능성이 있는 비만치료제 개발을 위한 연구가 수행되고 있으나, 비만치료제는 복부팽만, 위장장애, 변비, 구갈, 혈압상승 등과 같이 여러 부작용을 일으키므로 이를 극복하기 위하여 효과적으로 체중을 조절하면서 동시에 부작용이 적은 물질들을 찾아내는 연구가 활발히 진행되고 있다(George & Louis 2000).
대한민국의 대표적인 식품인 김치는 젖산 발효식품으로 발효과정에 다양한 미생물들이 관여하는 것으로 알려져 있다. 김치 발효에 주된 역할을 하는 유산균으로는 Lactobacillus 속, Leuconostoc 속, Pediococcus 속, Weissella 속 등이 오래전부터 알려져 왔다(Choi et al. 2002; Lee 2007; Yu et al. 2009; Rhee et al. 2011). 유산균의 건강 증진과 관련된 다양한 효과 중 항비만효과와 지질대사 개선효과에 관한 연구는 Lactobacillus plantarum KY1032(Park et al. 2011), Lactobacillus plantarum Q180(Chu et al. 2019; Park et al. 2018), Lactobacillus brevis OPK-3(Park et al. 2014), Lactobacillus johnsonni 3121 및 Lactobacillus rhamnosus 8(Lee et al. 2021a) 등으로 대부분 Lactobacillus 속 유산균을 중심으로 이루어졌다. 최근 미생물 동정 기술의 발달로 인하여 Weissella 속 유산균들이 새롭게 분리·동정되었으며(Lee et al. 2002; Mun & Chang 2020; Mun et al. 2020), 이들 유산균은 항산화효과(Yu et al. 2018), 항암효과(Kwak et al. 2014), 항비만효과(Moon et al. 2012; Park et al. 2012; Pi et al. 2014) 및 면역조절효과(Park et al. 2017; Yu et al. 2019)가 있는 것으로 보고되었다. 또한 김치로부터 분리한 ornithine 고생성능을 가진 Weissella 속 균주의 분리, 동정 및 특성에 관한 연구도 수행된 바 있다(Yu et al. 2009; Kang et al 2015; Hwang & Lee 2018; Moon et al. 2019; Mun & Chang 2020; Mun et al. 2020). 간질환 치료제(Sikorska et al. 2010; Goh et al. 2018)로 알려진 의료용 아미노산인 L-ornithine은 비필수 아미노산이며, 요소회로의 주된 구성성분으로 citrulline과 arginine의 전구물질이다. L-ornithine은 포도주스, 와인, 치즈, 김치, 재첩, 담수성 쌍각류 조개 등의 식품에도 함유되어 있는 것으로 알려져 있다(Arena et al. 1999; Liu et al. 2003; Uchisawa et al. 2004; Yu et al. 2009). L-ornithine은 지질대사 개선으로 육체 피로도를 저하시키며(Sugino et al. 2008), 면역력을 증가시키고(Kawai et al. 2000), 피부 개선효과(Shi et al. 2002), 스트레스 저하 및 수면 질을 개선하는 것(Miyaka et al. 2014)으로 알려졌다. 특히 L-ornithine은 뇌하수체를 자극하여 성장호르몬을 분비시켜 근육의 합성을 증가시키고, 기초대사를 촉진시켜 비만을 예방하는 식이보충제로 미국과 유럽을 중심으로 이용되고 있다(Evain-Brion et al. 1982; Elam 1988; Jeevanandam et al. 1996; Demura et al. 2010). 김치로부터 분리한 ornithine 생성능 유산균주인 W. koreenisis 521(Pi et al. 2014)과 W. koreenisis OK1-6(Moon et al. 2012)은 3T3-L1 세포에 처치하였을 경우 지방축적을 억제하는 것으로 보고되었다. 또한 ornithine-고생성 균주인 W. koreenisis OK1-6로 발효한 김치(Park et al. 2012)와 본 연구에서 사용한 W. koreensis DB1으로 발효한 미강(Park et al. 2021)도 실험동믈 연구에서 항비만효과가 있는 것으로 나타났다.
본 연구는 김치로부터 분리된 ornithine 생성능 유산균인 Weissells koreensis DB1(W. koreensis DB1)을 3T3-L1세포에 전처치하여 지방세포 분화 억제효과 및 지방분화와 관련된 유전자들의 조절에 미치는 영향을 알아보고자 실시하였다.
Ⅱ. 연구방법
1. 균주 제조
본 연구에 사용한 발효 균주는 선행 연구(Mun et al. 2020)를 통해 김치로부터 분리된 ornithine 생성능 유산균인 W. koreensis DB1을 분양받아 실험에 사용하였다. W. koreensis DB1은 deMan Rogosa and Sharpe (MSR; Difico, Sparks, MD, USA) 액체배지에 접종하여 30℃에서 24시간 동안 배양하였다. MSR (Difico) 액체배지에서 배양된 유산균 배양액은 4℃, 10,000x g로 20분간 원심분리하여 균체를 얻은 다음 phosphated-buffered saline(PBS)으로 세척하였다. W. koreensis DB1의 세포 추출물을 위해 균주는 1010 colony forming units/mL 농도로 PBS로 suspension하여 sonication한 다음 다시 윈심분리하였다. W. koreensis DB1 세포 추출물은 멸균된 여과지(pore size, 0.45 μm)에서 여과시킨 후 동결건조한 다음 추후 분석을 위해 –20℃에 보관하였다.
2. 3T3-L1 세포배양, 분화유도 및 시료처리
3T3-L1(mouse embryonic fibroblast-adipose like cell line) 세포는 마우스 preadipocytes로 American Type Culture Collection(ATCC, Rockville, MD, USA)에서 구입하였다. 10% fetal bovine serum(FBS), 100 unit/mL penicillin, 100 ng/mL streptomycin이 포함된 Dulbecco’s modified Eagle’s medium(DMEM, Corning, Manassas, VA, USA)을 사용하여 37℃, 5% CO2 조건에서 배양을 실시하였다. 배양된 세포는 6.0×103 cell/mL이 되도록 6 well plate에 분주하여 배양하였으며, 세포가 융합되었을 때 5 μg/ml insulin, 0.25 μM dexamethazone 및 0.5 mM 3-isobutyl-1-methylxanthine의 분화유도물질이 함유된 DMEM으로 배양하여 48시간 분화를 유도하였다. 그 후 10% FBS와 5 μg/mL insulin만이 함유된 DMEM과 W. koreensis DB1 세포 추출물을 2일 간격으로 교체하면서 분화를 유도하였으며, 6일 동안 분화를 유도한 후 세포 조직과 배양액을 각각 모아 실험에 사용하였다. 지방세포 분화를 유도하는 동안 각 배양액에 W. koreensis DB1 세포 추출물을 0.25, 0.5, 0.75, 1.0 μg/mL의 농도로 처리하였다.
3. 세포독성 측정
W. koreensis DB1 세포 추출물이 3T3-L1 세포 생존율에 미치는 영향은 3-(4,5-dimethyl thiazol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT) 분석을 통해 측정하였다(Mosmann 1983). 3T3-L1 preadipocytes는 1×104 cells/well의 농도로 96 well plate에 100 μL 씩 분주한 후 37℃, 5% CO2 조건에서 배양하여 일정 농도로 희석(0-1.0 μg/mL)된 W. koreensis DB1 세포 추출물을 첨가한 후 다시 24시간 배양하였다. 배양 완료 후 5 μg/mL 농도의 MTT 시약을 100 μL/well 씩 분주한 다음 37℃, 5% CO2 조건에서 4시간 배양하였다. 배지를 제거하고 dimethyl sulfoxide 100 μL/well를 가하여 생성된 formazan을 녹인 후 Microplate reader(Model 680, Bio-Rad Laboratories Inc., Hercules, CA, USA)를 이용하여 540 ㎚에서 흡광도를 측정하였다. 세포독성 정도는 시료를 처리하지 않은 대조군(CON)과 시료 처리군의 비율로 계산하였다.
4. Oil Red O staining
3T3-L1 지방전구세포의 지방세포로의 분화능은 즉 세포내 지질 염색은 Oil Red O staining으로 확인하였다. 분화 완료된 6-well plate의 배지를 제거한 후, 배양된 세포를 PBS로 2회 세척하고, 10% formalin을 500 μL/well으로 10분간 고정한 다음 다시 PBS로 세척 후 Oil red O working solution을 처리하여 실온에서 1시간 염색하였다. 염색 후 염색액을 제거하고 다시 PBS로 세척하여 세포 내 지방구 생성 정도를 현미경(Olympus, Tokyo, Japan)으로 관찰하였다. 정량분석을 위해 염색된 지방구는 40% isopropyl alcohol로 용출시켜 Microplate spectrophotometer(Epoch, Biotek instruments, Winooski, VT, USA)를 이용하여 520 nm에서 흡광도에서 지방 함량을 측정하였다.
5. 중성지방 함량 분석
W. koreensis DB1 세포 추출물이 3T3-L1 세포에서 중성지방 함량에 미치는 영향을 확인하기 위해 TG 측정은 Green & Kehinde(1974)의 방법을 이용하였다. 분화 유도된 3T3-L1 세포는 PBS로 3회 세척하고, scraper로 회수한 후, 원심분리하였다. 원심분리 후 상층액을 제거하고 pellet에 trypsin-EDTA buffer(lysis buffer) 첨가한 다음 4℃, 12,000 rpm에서 3분 정도 원심분리하여 상층액을 제거하여 남은 pellet은 중성지방 추출 용액인 homogenizing buffer(154 mM KCl, 50 mM Tris, 1 mM EDTA)를 이용하여 세포 내 중성지방을 추출하였다. 중성지방 함량은 TG determination kit(Wako, Osaka, Japan)를 사용하여 Microplate reader(Model 680, Bio-Rad Laboratories, Inc. Hercules, CA, USA)로 600 nm에서 분석하였다. 단백질 농도는 The bicinchoninic acid(BCA) 방법에 의해 측정하였다(Walker 1994).
6. Quantitative real-time polymerase chain reaction(qRT-PCR)
지방세포 분화가 완료된 세포를 PBS로 세척하여 harvest한 후 TRIzol reagent(Ambion, Auatin, TX, USA)을 이용하여 total RNA를 추출하였다. 각 실험군 당 추출된 RNA는 cDNA reverse transcription kit(Applied Biosystems, Foster city, CA, USA)를 이용하여 cDNA를 합성하였다. Table 1과 같이 SREBP-1c, PPARγ, C/EBPα, FAS 및 ACC primer를 이용하여 real-time PCR을 수행하였으며, 대조군 유전자로는 β-actin을 사용하였다. Real-time PCR(Bio-Rad CFX-96, Hercules, CA, USA) 기기를 이용하여 real-time PCR kit mixture와 10 pmol/μL forward primer, reverse primer, 그리고 합성된 cDNA를 혼합해 반응하였다. 반응액은 95℃에 15분간 pre-incubation을 거친 후, 95℃에서 30초간 denaturation 단계, 50℃ 30초간 annealing 단계, 72℃에서 30초간 extension의 조건을 설정하여 45 cycle을 반복 수행하였다. 마지막 cycle후 얻어진 결과는 Bio-Rad CFX Maestro 1.1을 이용하여 분석하였다. 유전자의 발현량은 분화유도 배지(differentiation media) 만을 처리한 대조군(Control)을 1.0으로 간주하여 상대적인 값을 계산하였다.
7. 통계처리
본 실험에서 얻어진 통계분석 결과는 SPSS(Statistical Package for Social Science)를 이용해서 통계 분석하였다. 실험결과는 실험군당 평균±표준오차로 표시하였고, 그룹간 평균차에 대한 통계적 유의성을 검정하기 위해 일원배치 분산분석(one-way analysis of variance)을 실시한 후 p<0.05 수준에서 Tukey’s test를 이용한 사후 검정(Post-Hoc test)을 실시하였다.
Ⅲ. 결과 및 고찰
1. 3T3-L1 지방전구세포의 생존에 미치는 영향
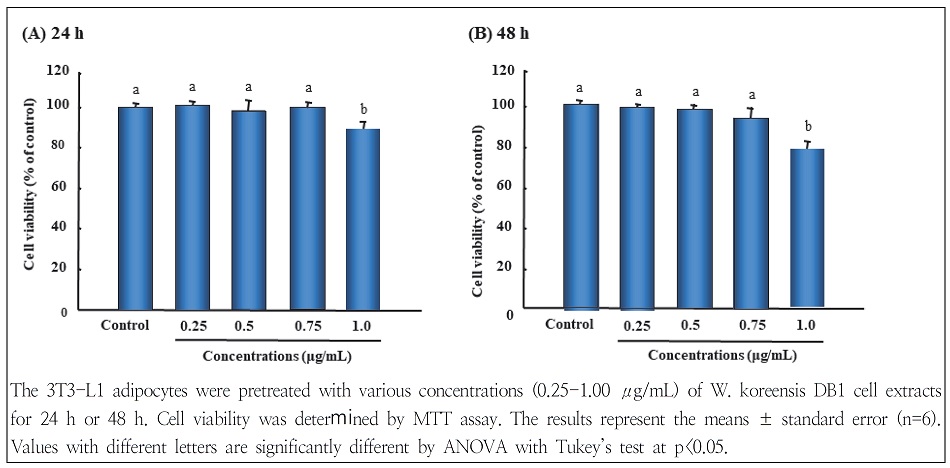
W. koreensis DB1 세포 추출물의 3T3-L1 세포 분화 억제능 평가를 위한 농도를 결정하기 위하여 먼저 W. koreensis DB1 세포 추출물의 3T3-L1 preadipocytes의 세포 생존율을 MTT 분석 방법으로 측정하였다. 3T3-L1 지방전구세포를 96 well plate에 1×104/well 세포수로 분주하여 배양한 후 W. koreensis DB1 세포 추출물을 각각 농도별(0, 0.25, 0.50, 0.75, 1.00 μg/mL)로 24시간 혹은 48시간 동안 처리하여 실험을 진행하였다. 그 결과, Fig 1에서와 같이 W. koreensis DB1 세포 추출물은 0.75 μg/mL 처리 농도까지 24시간 혹은 48시간 모두 세포독성이 나타나지 않았다. 따라서 W. koreensis DB1 세포 추출물의 농도는 3T3-L1 adipocytes의 성장에 영향을 미치지 않으면서 세포독성을 나타내지 않은 0.75 μg/mL 이하의 농도 0.25, 0.5, 0.75 μg/mL 범위에서 3T3-L1 세포에 처리하여 지방세포 분화에 미치는 영향을 측정하였다.
2. 3T3-L1 지방세포 분화에 미치는 영향
세포질에 축적된 지방구(lipid droplet)는 전지방세포(preadipocytes)에서 지방세포(adipocytes)로 분화(adipogenesis)됨을 나타내는 지표이며, 이때 지방구를 염색한 Oil Red O에 비례하여 증가하게 된다(Ramirez-Zacarias et al. 1992). 즉 Oil Red O 염색은 지방세포 내 축적된 중성지방을 붉은색으로 염색하여 세포의 붉은색 정도로 분화 정도를 시각적으로 알수 있게 하는 염색 시약으로 중성지질과 콜레스테롤만을 염색한다고 보고되었다(Choi et al. 2013). 지방구는 주로 중성지방으로 구성되어 있으며(Lee et al 2012), 중성지방은 지방세포에 과도하게 생성되어 저장되면 비만의 원인으로 작용한다.
지방세포로의 분화를 유도시킨 후 분화가 유도되는 동안 세포에 3T3-L1 지방전구세포에 독성이 없었던 W. koreensis DB1 세포 추출물 농도인 0.00, 0.25, 0.50, 0.75 μg/mL로 처리하고 Oil Red O 시약을 이용하여 염색하였다. Oil Red O를 통해 염색된 지방구는 1차적으로 현미경 관찰을 통해 확인한 결과, 분화처리군(대조군, CON)은 세포질 내 지방구의 형성이 활발하게 유도된 것이 확인되었다(Fig. 2A). 반면 W. koreensis DB1 세포 추출물 처리하였을 경우 붉은색으로 염색된 지방구가 농도 의존적으로 감소된 것을 확인할 수 있었다.또한 지방구의 염색액을 isopropyl alcohol 용액으로 추출한 다음 520 nm에서 흡광도를 측정하여 정량한 결과에서도 유의하게 지방축적이 억제되었음을 확인하였다(Fig. 2B). 이상의 결과 W. koreensis DB1 세포 추출물은 농도 의존적으로 3T3-L1 지방전구세포에서 지방세포로의 분화를 억제한다는 것을 확인할 수 있었다.
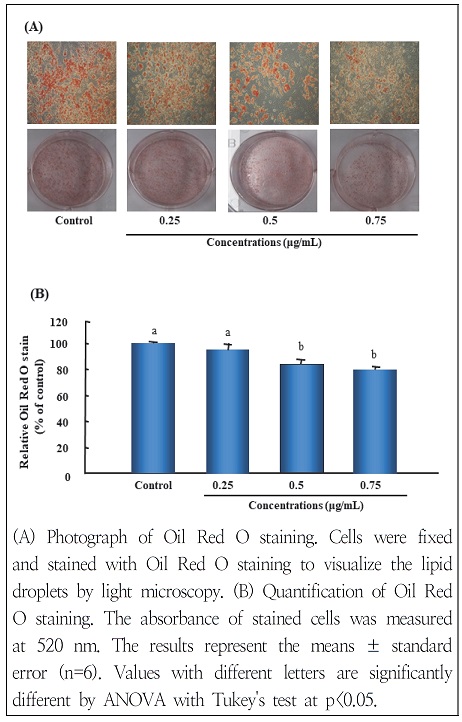
Effects of W. koreensis DB1 cell extracts on lipid droplets accumulation in differentiated 3T3-L1 cells.
유산균이 생성하는 지방산은 butyric acid와 conjugated linoleic acid, 아미노산으로는 γ-aminobutric acid, ornithine 및 citrulline 등이 있다고 보고되었다(Cho et al. 2007; Lee et al. 2007; Mahkonen et al. 2008; Yu et al. 2009; Moon et al. 2012; Park et al. 2014). 이들 중 항비만효과가 있는 것으로 알려져 있는 물질은 지방산의 경우는 conjugated linoleic acid(Lee et al.2007), 아미노산은 L-ornithine(Moon et al. 2012; Park et al. 2014)과 L-citrulline(Kudo et al. 2017)이다. 본 연구에 사용한 균주인 W. koreensis DB1의 ornithine 생성량은 6,581.64 mg/L이였다(Mun et al. 2020). 김치로부터 분리한 ornithine 생성능 유산균인 W. koreensis OK1-6(Moon et al. 2012), W. koreensis 521(Pi et al. 2014) 및 Lactobacillus brevis OPK-3(Park et al. 2014)도 3T3-L1 세포의 지방축적을 억제함을 확인하였다.
3. 3T3-L1 세포 중성지방 함량에 미치는 영향
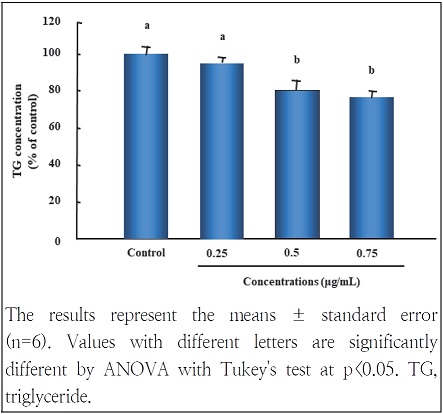
W. koreensis DB1 세포 추출물 처리가 3T3-L1 세포 내 중성지방의 함량에 미치는 영향을 조사한 결과는 Fig. 3과 같다. 그 결과 대조군이 유의하게 증가한 것을 확인할 수 있었는데, 이러한 결과는 분화배지가 세포 내에 중성지방의 축적을 촉진한다는 것을 의미한다. 분화배지에 의해서 축적된 중성지방의 함량은 W. koreensis DB1 세포 추출물을 처리하였을 때 처리 농도가 증가할수록 농도 의존적으로 감소하였다. 이들 결과는 지방구 생성을 알아본 Oil Red O 염색 결과(Fig. 2)와 일치하며, 이러한 결과는 koreensis DB1 세포 추출물이 지질축적 억제를 나타내는 것으로 사료된다. 이와 유사한 선행연구 중 김치로부터 분리한 ornithine 생성능을 갖는 유산균인 Lactobacillus brevis OPK-3도 중성지방 함량을 저하시켰다(Park et al. 2014).
4. 지방생성과정에 관여하는 유전자의 mRNA 발현에 미치는 영향
지방세포 분화과정에서 W. koreensis DB1 세포 추출물이 3T3-L1 지방세포 분화 관련 인자들의 발현에 미치는 영향을 알아보기 위해 지방형성과정에 관여하는 주요 전사조절인자인 peroxisome proliferator-activated receptorγ(PPARγ), CCAAT/enhancer-binding proteinα(C/EBPα), sterol regulatory element-binding transcription factor-1c(SREBP-1c)을 비롯하여 지방합성 관련 유전자인 fatty acid synthetase(FAS) 및 acetyl CoA carboxylase(ACC)의 mRNA 발현 수준을 비교 분석하였다. 비만 분화배지에서 배양한 3T3-L1 세포의 PPARγ, C/EBPα 및 SREBP-1c 발현은 현저하게 증가되었으나, W. koreensis DB1 세포 추출물의 처리는 분화유도 과정에서 PPARγ, C/EBPα 및 SREBP-1c의 발현을 농도 의존적으로 감소시켰다(Fig. 4). 또한 지방 합성관련 유전자인 FAS와 ACC의 mRNA 발현 수준도 이와 유사한 경향을 보였다(Fig. 5). 이러한 결과는 세포 내 지방구 형성(Fig. 2) 및 중성지방 함량 저하효과(Fig. 3)와 일치하였다. Ornithine 생성능이 있는 김치 유산균인 W. koreensis OK1-6의 spent culture medium extract과 cytoplasmic fraction도 지방세포 분화 관련 인자인 PPARγ, C/EBPα 및 SREBP-1 발현을 저하하였고(Moon et al. 2012), Lactobacillus brevis OPK-3도 PPARγ 및 C/EBPα 유전자 발현을 억제하는 것으로 나타나(Park et al. 2014) 본 연구와 유사한 결과를 보였다.
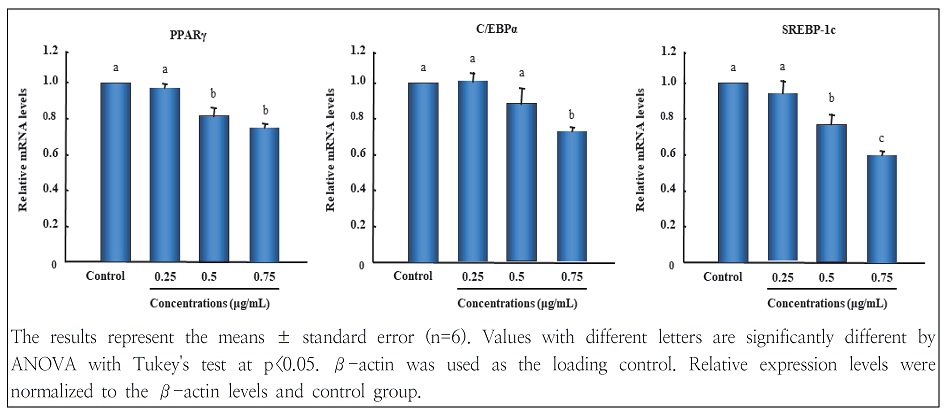
Inhibitory effects of W. koreensis DB1 cell extracts on adipogenic key transcription factors in differentiated 3T3-L1 cells.
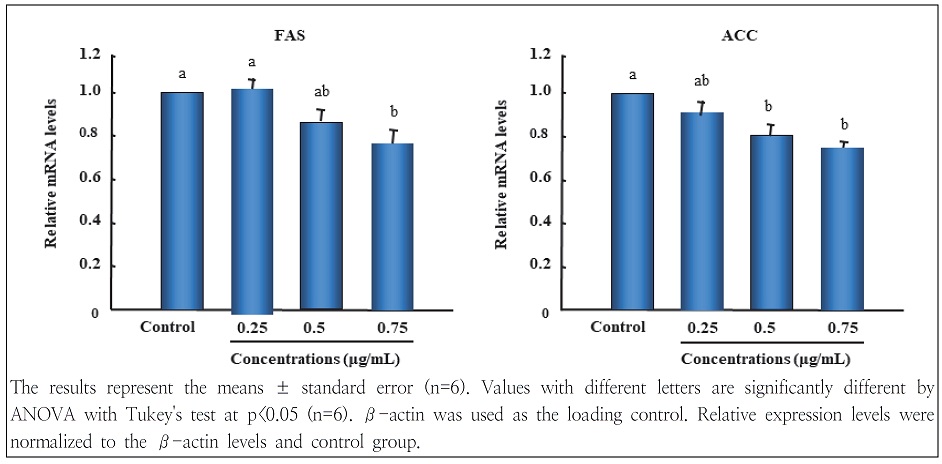
Effects of W. koreensis DB1 cell extracts on lipogenesis-related enzyme expressions in differentiated 3T3-L1 cells.
Adipogensis는 지방전구세포(preadipocytes)에서 지방세포로 분화되는 과정으로, 지방세포 분화과정에는 여러 종류의 adipogenic factor들이 관여하여 지방세포 특이적 유전자들의 발현이 유도된다고 알려져 있다(Cowherd et al. 1999; Rosen et al. 2000; White & Stephens, 2010). 지방세포 분화 초기에는 C/EBPβ 및 C/EBPδ 발현이 증가하고, 중·후기 과정에는 SREBP-1c 전사인자와 FAS, ACC, stearoyl-CoA desaturase 1 효소 등의 활성으로 인해 지방산 생합성이 일어나며(Cignarelli et al. 2019), 분화 후기에는 C/EBPα 및 PPARγ 발현이 촉진된다고 한다(Tang & Lane 2012). PPARγ는 지방세포의 분화 유도 과정의 전사 조절인자로 지방대사 관련 유전자의 발현을 증가시키고, 지방산의 합성, 이동, 저장 및 에너지 소비와 관련된 유전자의 전사를 매개하며, 이와 관련된 adipogenic marker로는 FAS, aP2, lipoprotein lipase 등이 있으며, C/EBPα는 PPARγ와 서로 상호작용하면서 지방전구세포의 분화 후기 과정을 촉진한다(Darlington et al. 1998; Linhart et al. 2001). SREBP-1c는 지방산이나 콜레스테롤 합성에 필수 전사인자이고(Ferré & Foufelle 2007), 지방세포에서 PPARγ와 C/EBPα의 발현을 유도하여 지방생성을 촉진시키며, 지방산 생성에 관여하는 효소인 FAS와 ACC 등의 발현을 조절한다(Fajas et al. 1999). 지방을 생성하는 효소인 FAS는 중성지방을 합성하고 세포질에 저장하는 역할을 한다고 알려져 있다(Claycombe et al. 1998; Sul & Wang 1998). 간과 백색지방 조직에서 주로 발현되는 것으로 알려진 ACC는 지방산의 합성과 분해 조절인자로 체내 acetyl-CoA가 malonyl-CoA로의 carboxylation을 촉진하여 생체내에서 지방산 합성 속도를 조절해 주는 rate-limiting 효소 중의 하나이며, carnitine palmitoyl transferase-1의 발현을 저해하여 β-oxidation을 억제하는 것으로 알려져 있다(Harwood 2004; Payne et al. 2010). 성숙한 지방세포의 분화 후기 단계에 발현되는 단백질로 알려진 aP2는 지방산 합성, 이동, 저장 및 에너지 소비에 관여한다(Haunerland & Spener 2004). 따라서 이들 유전자들은 adipogenesis 과정 동안 3T3-L1 지방전구세포의 분화를 유도하고 지질축적에 관여하는 것을 알 수 있다.
이상의 결과를 종합하면 W. koreensis DB1 세포 추출물은 3T3-L1 지방전구세포에서 adipogenic transcription factor인 PPARγ, C/EBPα 및 SREBP-1c의 발현 억제와 adipogenic target 유전자인 FAS와 ACC 발현을 억제함으로서 지방구 생성을 감소시켜 지방세포로의 분화를 억제시키는 것으로 추측된다.
Ⅳ. 요약 및 결론
본 연구는 3T3-L1 세포를 이용하여 김치로부터 분리한 ornithine 고생성능 유산균인 W. koreensis DB1 세포 추출물의 지방분화 억제효과를 살펴보고자 실시하였다. 세포 기반 MTT 분석을 통하여 W. koreensis DB1 세포 추출물의 세포독성을 확인한 결과, 0.75 ug/mL 농도까지 세포의 생존에 영향이 없는 것으로 확인되었다. 따라서 W. koreensis DB1 세포 추출물의 지방분화 억제 활성을 평가하기 위한 처리 농도는 0.25, 0.50, 0.75 μg/mL로 설정하였다. Oil red O 염색법과 중성지방 함량 측정을 통하여 지방축적 억제효과를 살펴보았고, 이들 기전을 알아보기 위하여 지방생성의 주요 핵심 역할을 수행하는 transcription factor 및 지질대사 관련 주요 효소의 유전자 발현을 비교 분석하였다. W. koreensis DB1 세포 추출물은 3T3-L1 전구지방세포에서 분화유도 물질(IBMX, DEXA, Insulin)과 함께 처리했을 때 Oil red O 염색과 중성지방 함량의 분석을 통하여 농도 의존적으로 지방구 수의 감소와 더불어 지질 축적이 억제되었음을 확인하였다. 또한 이들은 지방세포의 증식 및 분화되는 과정에서 발현되는 adipogenic transcription factor 및 관련 유전자의 mRNA 발현도 유의적으로 감소시키는 것을 확인하였다. 이상의 결과로 김치로 분리한 ornithine 생성능 유산균인 W. koreensis DB1 세포 추출물은 지방세포 분화를 억제하는 것으로 보여지며, 항비만 식품 소재로의 개발이 가능할 것으로 생각된다.
Acknowledgments
This research was supported by Korea Institute of Planning and Evaluation for Technology in Food, Agriculture, Forestry and Fisheries (IPET) through the Agricultural Microbiome R&D Program, and funded by the Ministry of Agriculture, Food and Rural Affairs (MAFRA) (918005-4).
References
-
Arena ME, Saguir FM, Manca de Nadra MC(1999) Arginine, citrulline and ornithine metabolism by lactic acid bacteria from wine. Int J Food Microbiol 52(3), 155-161.
[https://doi.org/10.1016/S0168-1605(99)00133-6]

- Cho YR, Chang JY, Chang HC(2007) Production of gamma-aminobutyric acid (GABA) by Lactobacillus buchneri isolated from kimchi and its neuroprotective effect on neuronal cells J Microbiol Biotechnol 17(1), 104-109
-
Choi HJ, Cheugh CI, Kim SB, Lee JC, Lee DW, Choi SW, Park JM, Byun YR(2002) Weissella kimchii sp. nov., anovel lactic acid bacterium from kimchi. Int J Syst Evol Microbiol. 52(Pt 2), 507-511.
[https://doi.org/10.1099/00207713-52-2-507]

-
Choi JH, Park YH, Lee IS, Lee SP, Yu MH(2013) Antioxidant activity and inhibitory effect of Aster scaber thunb. extract on adipocyte differentiation in 3T3-L1 cells. Korean J Food Sci Technol 45(3), 356-363.
[https://doi.org/10.9721/KJFST.2013.45.3.356]

- Chu J, Joung H, Kim BK, Choi IS, Park TS(2019) Inhibitory effects of Lactobacillus plantarum Q180 on lipid accumulation in HepG2 cells. Korean J Food Nutr 32(6), 738-744.
-
Cignarelli A, Genchi VA, Perrini S, Natalicchio A, Laviola L, Giorgino F(2019) Insulin and insulin receptors in adipose tissue development. Int J Mol Sci 20(3), 759.
[https://doi.org/10.3390/ijms20030759]

-
Claycombe KJ, Jones BH, Standridge MK, Guo Y, Chun Jt, Taylor JW, Moustaïd-Moussa N(1998) Insulin increases fatty acid synthase gene transcription in human adipocytes. Am J Physiol 274(5), R1253-R1259.
[https://doi.org/10.1152/ajpregu.1998.274.5.R1253]

-
Cowherd RM, Lyle RE, McGehee Jr RE(1999) Molecular regulation of adipocyte differentiation. Semin Cell Dev Biol 10(1), 3-10.
[https://doi.org/10.1006/scdb.1998.0276]

-
Darlington GJ, Ross SE, MacDougald OA(1998) The role of C/EBP genes in adipocyte differentiation. J Biol Chem (46), 30057-30060.
[https://doi.org/10.1074/jbc.273.46.30057]

-
Demura S, Yamada T, yamaji S, Komatsu M, Morishita K(2010) The effect of L-ornithine hydrochloride ingestion on performance during incremental exhaustive ergometer bicycle exercise and ammonia metabolism during and after exercise. Eur J Clin Nutr 64(10), 1166-1171.
[https://doi.org/10.1038/ejcn.2010.149]

- Elam RP(1988) Morphological changes in adult males from resistance exercise and amino acid supplementation. J Sports Med Phy Fitness 28(1), 35-39
-
Evain-Brion D, Donnadieu M, Roger M, Job JC(1982) Simultaneous study of somatotropic and corticotropic pituitary secretions during ornithine infusion test. Clinical Endocrinol 17(2), 119-122.
[https://doi.org/10.1111/j.1365-2265.1982.tb01571.x]

-
Fajas L, Schoonjans K, Gelman L, Kim JB, Najib J, Martin G, Fruchart JC, Briggs M, Spiegelman BM, Auwerx J(1999) Regulation of peroxisome proliferator-activated receptor gamma expression by adipocyte differentiation and determination factor 1/sterol regulatory element binding protein 1: implications for adipocyte differentiation and metabolism. Mol Cell Biol 19(8), 5495-5503.
[https://doi.org/10.1128/MCB.19.8.5495]

-
Ferré P, Foufelle F(2007) SREBP-1c transcription factor and lipid homeostasis: clinical perspective. Horm Res 68(2), 72-82.
[https://doi.org/10.1159/000100426]

-
George AB, Louis AT(2000) Medicinal strategies in the treatment of obesity. Nature 404(6778), 672-677.
[https://doi.org/10.1038/35007544]

-
Gesta S, Tseng YH, Kahn CR(2007) Developmental origin of fat: tracking obesity to its source. Cell 131(2), 242−256.
[https://doi.org/10.1016/j.cell.2007.10.004]

-
Goh ET, Stokes CS, Sidhu SS, Vilstrup H, Gluud LL, Morgan MY(2018) L-ornithine L-aspartate for prevention and treatment of hepatic encephalopathy in people with cirrhosis. Cochrane Database Syst Rev 5(5), CD012410.
[https://doi.org/10.1002/14651858.CD012410.pub2]

-
Green H, Kehinde O(1974) Sublines of mouse 3T3 cells that accumulate lipid. Cell 1(3), 113-116.
[https://doi.org/10.1016/0092-8674(74)90126-3]

- Harwood Jr HJ(2004) Acetyl-CoA carboxylase inhibition for the treatment of metabolic syndrome. Curr Opin Investig Drugs 5(3), 283-289
-
Haslam DW, James WP(2005) Obesity. Lancet 366(9492), 1197-1209.
[https://doi.org/10.1016/S0140-6736(05)67483-1]

-
Haunerland NH, Spener F(2004) Fatty acid-binding proteins - insights from genetic manipulations. Prog Lipid Res 43(4), 328-49.
[https://doi.org/10.1016/j.plipres.2004.05.001]

-
Hwang H, Lee JH(2018) Characterization of arginine catabolism by lactic acid bacteria isolated from kimchi. Molecules 23(11), 3049.
[https://doi.org/10.3390/molecules23113049]

-
Jeevanandam M, Holaday NI, Petersen SR(1996) Ornithine-α-ketoglutarate (OKG) supplementation is more effective than its component salts in traumatized rats. J Nutr 126(9), 2141-2150.
[https://doi.org/10.1093/jn/126.9.2141]

-
Kang BK, Cho MS, Ahn TY, Lee ES, Park DS(2015) The influence of red pepper powder on the density of Weissella koreensis during kimchi fermentation. Sci Rep 5, 15445.
[https://doi.org/10.1038/srep15445]

-
Kwak SH, Cho YM, Noh GM, Om AS(2014) Cancer preventive potential of kimchi lactic acid bacteria (Weissella cibaria, Lactobacillus plantarum). J Cancer Prev 19(4), 253-258.
[https://doi.org/10.15430/JCP.2014.19.4.253]

-
Kawai Y, Takasuka N, Inoue K, Akagawa K, Nishijima M(2000) Ornithine-containing lipids stimulate CD14-dependent TNF-α production from murine macrophage-like J774.1 and RAW 264.7 cells. FEMS Immunol Med Microbiol 28(3), 197-203.
[https://doi.org/10.1111/j.1574-695X.2000.tb01477.x]

-
Kudo M, Yoshitomi H, Momoo M, Suguro S, Yamagishi Y, Gao M(2017) Evaluation of the effects and mechanism of L-citrulline on anti-obesity by appetite suppression in obese/diabetic KK-Ay mice and high-fat diet fed SD rats. Biol Pharm Bull 40(4), 524-530.
[https://doi.org/10.1248/bpb.b16-01002]

-
Lee CS, Park MH, Kim SH(2021a) Selection and characterization of probiotic bacteria exhibiting antiadipogenic potential in 3T3-L1 preadipocytes. Probiotics Antimicrob Proteins 2021, 1-15.
[https://doi.org/10.1007/s12602-021-09793-5]

-
Lee JA, Ahn EK, Hong SS, Oh JS(2012) Anti-obesity effect of ethyl acetate extracts from Agrimonia pilosa ledeb. in 3T3-L1 preadipocytes. J Korean Soc Food Sci Nutr 41(2), 161-167.
[https://doi.org/10.3746/jkfn.2012.41.2.161]

- Lee JH(2007) Kimchi lactic acid bacteria. e-Bioindustry News Vol. 20, No. 1
-
Lee JS, Hyun IK, Yoon JW, Seo HJ, Kang SS(2021b) Bioconversion products of whey by lactic acid bacteria exert anti-adipogenic effect. Food Sci Anim Resour 41(1), 145-152.
[https://doi.org/10.5851/kosfa.2020.e78]

-
Lee JS, Lee KC, Ahn JS, Mheen TI, Pyun YR, Park YH(2002) Weissella koreensis sp. Nov., isolated from kimchi. Int J Syst Evol Microbiol. 52(Pt 4), 1257-1261.
[https://doi.org/10.1099/00207713-52-4-1257]

-
Lee K, Paek K, Lee HY, Park JH, Lee Y(2007) Antiobesity effect of trans-10, cis-12- conjugated linoleic acid-producing Lactobacillus plantarum PL62 on diet-induced obese mice. J Appl Microbiol 103(4), 1140-1146.
[https://doi.org/10.1111/j.1365-2672.2007.03336.x]

-
Liu SQ, Holland R, Crow VL(2003) The potential of dairy lactic acid bacteria to metabolise amino acids via non-transaminating reactions and endogenous transamination. Int J Food Microbiol 86(3), 257-269.
[https://doi.org/10.1016/S0168-1605(03)00040-0]

-
Linhart HG, Ishimura-Oka K, DeMayo F, Kibe T, Repka D, Poindexter B, Bick RJ, Darlington GJ(2001) C/EBPα is required for differentiation of white, but not brown, adipose tissue. Proc Natl Acad Sci USA 98(22), 12532-12537.
[https://doi.org/10.1073/pnas.211416898]

-
Leung WY, Thomas GN, Chan JC, Tomlinson B(2003) Weight management and current options in pharmacotherapy: Orlistat and sibutramine. Clin Ther 25(1), 58-80.
[https://doi.org/10.1016/S0149-2918(03)90009-9]

-
Mahkonen A, Putaala H, Mustonen H, Rautonen N, Puolakkainen P(2008) Lactobacillus acidophilus 74-2 and butyrate induce cyclooxygenase (COX)-1 expression in gastric cancer cells. Immunopharmacol Immunotoxicol 30(3), 503-518.
[https://doi.org/10.1080/08923970802135229]

-
Miyaka M, Kirisako T, Kokubo T, Miura Y, Morishita K, Okamura H, Tsuda A(2014) Randomised controlled trial of the effects of L-ornithine on stress markers and sleep quality in healthy workers. Nutr J 13, 53.
[https://doi.org/10.1186/1475-2891-13-53]

-
Mosmann T(1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods 65(1-2), 55-63.
[https://doi.org/10.1016/0022-1759(83)90303-4]

-
Moon SH, Mun SY, Chang HC(2019) Characterization of fermented rice-bran using the lactic acid bacteria Weissella koreensis DB1 derived from kimchi. Korean J Community Living Sci 30(4), 543~551.
[https://doi.org/10.7856/kjcls.2019.30.4.543]

-
Moon YJ, Soh JR, Yu JJ, Sohn HS, Cha YS, Oh SH(2012) Intracellular lipid accumulation inhibitory effect of Weissella koreensis OK1-6 isolated from kimchi on differentiating adipocyte. J Appl Microbiol 113(3), 652-858.
[https://doi.org/10.1111/j.1365-2672.2012.05348.x]

-
Mun SY, Chang HC(2020) Characterization of Weissella koreensis SK isolated from kimchi fermented at low temperature (around 0°C) based on complete genome sequence and corresponding phenotype. Microorganisms 8(8), 1147.
[https://doi.org/10.3390/microorganisms8081147]

-
Mun SY, Moon SH, Chang HC(2020) Characterization of high-ornithine-producing Weissella koreensis DB1 isolated from kimchi and its application in rice bran fermentation as a starter culture. Foods 9(11), 1545.
[https://doi.org/10.3390/foods9111545]

-
Park DY, Ahn YT, Huh CS, Jeon SM, Choi MS(2011) The inhibitory effect of Lactobacillus plantarum KY1032 cell extract on the adipogenesis of 3T3-L1 cells. J Med Food 14(6), 670-675.
[https://doi.org/10.1089/jmf.2010.1355]

-
Park HE, Kang KW, Kim BS, Lee SM, Lee WK(2017) Immunomodulatory potential of Weissella cibaria in aged C57BL/6J mice. J Microbiol Biotechnol 27(12), 2094–2103.
[https://doi.org/10.4014/jmb.1708.08016]

-
Park JA, Tirupathi Pichiah PB, Yu JJ, Oh SH, Daily 3rd JW, Cha YS(2012) Anti-obesity effect of kimchi fermented with Weissella koreensis OK1-6 as starter in high-fat diet-induced obese C57BL/6J mice. J Appl Microbiol 113(6), 1507-1516.
[https://doi.org/10.1111/jam.12017]

-
Park JE, Oh SH, Cha YS(2013) Lactobacillus plantarum LG42 isolated from gajami sik-hae inhibits adipogenesis in 3T3-L1 adipocyte. BioMed Res Int 2013, Article ID 460927
[https://doi.org/10.1155/2013/460927]

-
Park JE, Oh SH, Cha YS(2014) Lactobacillus brevis OPK‐3 isolated from kimchi inhibits adipogenesis and exerts anti-inflammation in 3T3‐L1 adipocyte. J Sci Food Agric 94(912), 2514-2520.
[https://doi.org/10.1002/jsfa.6588]

-
Park S, Chang HC, Lee JJ(2021) Rice bran fermented with kimchi-derived lactic acid bacteria prevents metabolic complications in mice on a high-fat and –cholesterol diet. Foods 10(7), 1501.
[https://doi.org/10.3390/foods10071501]

- Park SY, Kim S, Lim SD(2018) The inhibitory effect of L. plantarum Q180 on adipocyte differentiation in 3T3-L1 and reduction of adipocyte size in mice fed high-fat diet. Korean J Food Sci Anim Resour 38(1), 99–109.
-
Payne VA, Au WS, Lowe CE, Rahman SM, Friedman JE, O'Rahilly S, Rochford JJ(2010) C/EBP transcription factors regulate SREBP1c gene expression during adipogenesis. Biochem J 425(1), 215-223.
[https://doi.org/10.1042/BJ20091112]

- Pi KB, Lee K, Kim Y, Lee EJ(2014) The inhibitory effect of Weissella koreensis 521 isolated from kimchi on 3T3-L1 adipocyte differentiation. Int J Med Health Biomed Pharm Eng 8(1), 7-10.
-
Ramírez-Zacarías JL, Castro-Muñozledo C, Kuri-Harcuch W(1922) Quantitation of adipose conversion and triglycerides by staining intracytoplasmic lipids with oil red O. Histochemistry 97(6), 493–497.
[https://doi.org/10.1007/BF00316069]

-
Rhee S, Lee JE, Lee CH(2011) Importance of lactic acid bacteria in Asian fermented foods. Microb Cell Fact 10(Suppl 1), S5
[https://doi.org/10.1186/1475-2859-10-S1-S5]

-
Roncari DA, Lau DC, Kindler S(1981) Exaggerated replication in culture of adipocyte precursors from massively obese persons. Metabolism 30(5), 425-427.
[https://doi.org/10.1016/0026-0495(81)90174-8]

- Rosen ED, Walkey CJ, Puigserver P, Spiegelman BM(2000) Transcriptional regulation of adipogenesis. Genes & Dev 14(11), 1293-2000.
-
Shi HP, Fishel RS, Efron DT, Williams JZ, Fishel MH, Barbul A(2002) Effect of supplemental ornithine on wound healing. J Surgical Res 106(2), 299-302.
[https://doi.org/10.1006/jsre.2002.6471]

- Sikorska H, Cianciara J, Wiercińska-Drapało A(2010) Physiological functions of L-ornithine and L-aspartate in the body and the efficacy of administration of L-ornithine-L-aspartate in conditions of relative deficiency. Pol Merkur Lekarski 28(168), 490-495
-
Spiegelman BM, Flier JS(2001) Obesity and the regulation of energy balance. Cell 104(4), 531-543.
[https://doi.org/10.1016/S0092-8674(01)00240-9]

-
Sugino T, Shirai T, Kajimoto Y, Kajimoto O(2008). L-ornithine supplementation attenuates physical fatigue in healthy volunteers by modulating lipid and amino acid metabolism. Nutr Res 28(11), 738-743.
[https://doi.org/10.1016/j.nutres.2008.08.008]

-
Sul HS, Wang D(1998) Nutritional and hormonal regulation of enzymes in fat synthesis: studies of fatty acid synthase and mitochondrial glycerol-3-phosphate acyltransferase gene transcription. Ann Rev Nutr 18, 331-351.
[https://doi.org/10.1146/annurev.nutr.18.1.331]

-
Tang QQ, Lane MD(2012) Adipogenesis: from stem cell to adipocyte. Annu Rev Biochem 81, 715-736.
[https://doi.org/10.1146/annurev-biochem-052110-115718]

-
Uchisawa H, Sato A, Ichita J, Matsue H, Ono T(2004) Influence of low-temperature processing of the brackish water bivalve, Corbicula japonica, on the ornithine content of its extract. Biosci Biotechnol Biochem 68(6), 1228-1234.
[https://doi.org/10.1271/bbb.68.1228]

-
Walker JM(1994) The bicinchoninic acid (BCA) assay for protein quantitation. Methods Mol Biol 32, 5-8.
[https://doi.org/10.1385/0-89603-268-X:5]

-
Wang YW, Jones PJ(2004) Conjugated linoleic acid and obesity control: efficacy and mechanisms. Int J Obes Relat Metab Disord 28(8), 941-955.
[https://doi.org/10.1038/sj.ijo.0802641]

-
White UA, Stephens JM(2010) Transcriptional factors that promote formation of white adipose tissue. Mol Cell Endocrinol 318(1-2), 10-14.
[https://doi.org/10.1016/j.mce.2009.08.023]

- Yu JJ, Park HJ, Kim SG, Oh SH(2009) Isolation, identification, and characterization of Weissella strains with high ornithine producing capacity from kimchi. Korean J Microbiol 45(4), 339-345
-
Yu HS, Lee NK, Chol AJ, Choe JS, Bae CH, Paik HD(2018) Antagonistic and antioxidant effect of probiotic Weissella cibaria JW15. Food Sci Biotechnol 28(3), 851-855.
[https://doi.org/10.1007/s10068-018-0519-6]

-
Yu HS, Lee NK, Chol AJ, Choe JS, Bae CH, Paik HD(2019) Anti-inflammatory potential of probiotic strain Weissella cibaria JW15 isolated from kimchi through regulation of NF-κB and MAPKs pathways in LPS-induced RAW 264.7 cells. J Microbiol Biotechnol 29(7), 1022-1032.
[https://doi.org/10.4014/jmb.1903.03014]