추출 방법에 따른 갈색거저리 유충 가수분해물의 이화학적 성분 및 항산화 활성 비교
 ; An-Na Kim1)
; An-Na Kim1) ; Younggi Choi1)
; Younggi Choi1) ; Nayeon Kim1)
; Nayeon Kim1) ; Myoung-Su Jeong2)
; Myoung-Su Jeong2) ; Chulmin Kim†, 1)
; Chulmin Kim†, 1)
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
The mealworm (Tenebrio molitor) is now considered to be an alternative source of protein. An enzymatical digestion process may be necessary to increase the biological absorption, distribution, and metabolism of Tenebrio molitor and to maximize its biological functional activities. In this study, we acquired enzymatically hydrolyzed defatted Tenebrio molitors using water extract (WE), pressure (P), and high pressure (HP) processes. The nutritional content was significantly altered by applying pressure to the Tenebrio molitors. The crude ash and carbohydrate content decreased, but moisture content increased with the application of pressure. By increasing pressure, crude protein content increased, however crude fat content decreased progressively. The free amino acid content gradually decreased with increasing pressure. The total free amino acid content of the WE, P, and HP was 332.00, 251.82, and 222.10 mg/mL, respectively. The hydrolyzed H or HP exhibited higher antioxidative activities than WE. H showed the highest antioxidative activities (i.e. total phenolic compounds and 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) radical scavenging activities compared to WE or HP. Interestingly, HP displayed the highest level of other antioxidative activities, such as superoxide dismutase (SOD) and catalase enzyme activities. The variation in antioxidative activities by hydrolyzation methods may be due to the molecular size of the hydrolyzed proteins. All the extractions were sized under 500 Dalton and 65.42% of the HP was sized in this range and 25.98% of P was sized 500~1000 Dalton compared to WP or HP. Therefore, our logical postulation is that the lower than 500 Dalton fraction may display SOD and/or catalase enzymatic activities in HP and the 500~1000 Dalton fraction may enhance phenolic components and ABTS radical scavenging activities in H.
Keywords:
Tenebrio molitor, hydrolyzate, physicochemical characteristics, antioxidative activity, edible insectsⅠ. 서론
대체식품은 동물성 단백질을 대체 할 수 있는 식품으로 그 종류는 크게 식물성 단백질 기반식품, 곤충단백질 기반식품, 그리고 배양육 단백질 기반식품으로 나뉘어진다 (Kim et al. 2021). 최근 육류 중심의 소비패턴으로 변화함에 따라 단백질 소비량이 증가하고 있는 상황에서 미래의 식품시장수요를 충족시킬 수 있는 대체식품 산업이 필요한 시기가 되었다 (Kim et al. 2021). 기존 동물성 단백질을 대체하려는 사회적 관심과 더불어 대체식품시장의 증가가 빠르게 이루어지고 있다(Kim et al. 2021). 식물성기반의 대체단백질은 이미 상용화 되어있으나 필수아미노산 함량 등이 동물성단백질에 비해 상대적으로 낮은편이며, 배양육의 경우 아직까지 상용화단계 이르지 못하고 있다. 반면에 식용곤충은 지속가능한 성장에 기여하는 대체 식품자원으로서 그 산업적 가치가 증가하고 있고 유럽 북미지역같이 곤충에 대한 섭식문화가 일반적이지 않은 국가에서도 시장이 산업적으로 성장하고 있다(Wade & Hoelle 2020). 식품으로서의 식용곤충의 가치는 중요한 단백질 공급원으로서 쇠고기, 돼지고기, 닭고기 등 동물성 단백질의 대체 자원으로 이용될 수 있다. 또한, 식용곤충은 기존 단백질 공급원인 돼지, 닭 등에 비해 사육 요구공간 및 시설요구도가 낮아 육류사육에 비해 사육효율이 좋은 편이며, 사육 시 방출되는 암모니아 가스와 온실가스의 양이 현저히 적어 탄소중립 시대에 환경오염을 최소화할 수 있는 친환경적 단백질 공급원으로 기대되고 있다(Park & Kim 2018; Yoo et al. 2011). 최근 국내에서도 식용곤충을 소재화 하기 위해 많은 연구가 진행되고 있으며, 2021년 갈색거저리 유충, 장수풍뎅이 유충, 흰점박이꽃무지 유충, 누에, 메뚜기, 쌍별귀뚜라미, 백강잠, 아메리카왕거저리 및 수벌번데기 등 9종의 식용곤충이 식품원료로서 식약처로부터 인정을 받아 관련 연구가 증가하고 있다(Kim et al. 2021).
갈색거저리(Tenebrio molitor, mealworm)는 딱정벌레목 거저리과 곤충으로서 현재 한국을 비롯하여 전 세계적으로 분포되어 있다. 갈색거저리는 강한 적응력과 짧은 생육기간, 사육기술의 편의성으로 식품소재화 및 산업화에 용이하다. 현재까지 알려진 갈색거저리 유충의 영양성분은 수분이 약 4%내외 이고 조단백질이 53~55% 내외, 조지방 28~34% 내외로 단백질 함량이 매우 높은 고단백질 소재이다(Chung et al. 2013; Yoo et al. 2013). 단백질의 기능성은 보통 생리활성 펩티드에 기인하는데, 생리활성 펩티드는 보통 저분자로 구성되어 있고 아미노산의 조성이나 서열에 따라 다양한 활성을 가진다. 따라서 갈색거저리 유충은 생리활성 펩티드에 의한 연구가 많이 진행되고 있으며 추가적으로 생체이용률을 높이기 위한 단백질 가수분해 조건 확립에 대한 연구도 많이 진행되고 있다(Yu et al. 2017). 현재까지 알려진 갈색거저리 유충 및 그의 가수분해물에 대한 기능성으로는 항산화효과가 있으며(Yu et al. 2017), 항산화효과와 연관되어 모발성장 촉진효과(Baek et al. 2017), 항균효과(Chung et al. 1995), 등이 보고되어 있다. 또한 갈색거저리의 hexane fraction은 항치매효과(Youn et al. 2014)를 가져오는 것으로 보고되어 있다.
산화적 스트레스는 세포 시스템과 활성산소종(reactive oxygen species, ROS) 사이의 전자적 뷸균형 상태를 의미한다(Schieber & Chandel. 2014). 세포 내 산화환원의 균형이 무너지면 DNA, RNA 및 단백질에서 superoxide anions, hydroxyl radicals 및 과산화수소가 생성되며, 생성된 산화물질은 일중항산소(singlet oxygen)를 발생시켜 세포독성을 유발한다. 또한, 세포 내 산화적 스트레스가 누적되면 세포의 신호전달 체계를 변화시키고 DNA 손상을 유발할 수 있다(Nita & Grzybowski 2016). 포유류를 비롯한 동물 시스템 내의 산화 스트레스는 생물학적인 전자 시스템의 불균형을 초래하여 결국 암, 파킨슨병이나 알츠하이머 같은 신경계장애, 그리고 동맥경화나 심근경색등의 심혈관계의 질병을 초래할 수 있다(Gupta et al. 2014). 항산화 물질의 섭취는 또한 노화를 지연시키고 생물체 내의 대사 및 신경계 질환을 예방할 수 있다. 일반적으로 항산화 물질은 자유 반응성 라디칼 (free reactive radicals)을 포함하고 있어 세포내 산화반응을 감소시킨다(Xu et al. 2017). 이러한 항산화 기능을 가지는 급원 영양소에는 비타민C, 폴리페놀, 기능성 단백질 및 플라보노이드 등이 해당한다(Xu et al. 2017; Yu et al. 2017). 본 연구에서는 갈색거저리 유충을 가압처리 또는 초고압 처리 등 전처리 방법 별로 가수분해하여 그 이화학적 특성을 분석하고 그 기능성을 평가하고자 하였다.
Ⅱ. 연구방법
1. 실험재료
본 실험에서 사용한 갈색거저리 유충 시료는 2021년 4월에 농업법인회사 담빛마루에서 생산 판매된 것으로 마이크로웨이브 및 열풍으로 건조된 것으로 수분함량 5% 이하인 것을 구입하여 사용하였다. 이후 각 시료에 대하여 탈지 작업을 실시하였다. 시료의 탈지는 산업용 착유기(DB-600, Dongbang Machinery Co, DaeGu, Korea)를 이용하였으며, 압력 600 kgf/cm2의 조건으로 20분씩 2번 처리하였다. 그 후 착유된 기름을 제거한 잔사를 이용하여 분말을 제조하였으며 분말의 제조는 커터밀(HR-2172; Philips, Amsterdam, Netherlands)을 이용하여 80 Mesh 의 입도의 분말을 제조하였다. 제조된 분말은 -20℃ 동결고에 저장하여 두고 실험에 사용하였다.
단백질 가수분해 분해효소는 Alcalase®, Flavourzyme®, Protamax® (Novozymes, Bagsværd, Denmark)를 이용하였다.
2. 초고압 처리 공정
초고압처리는 탈지된 갈색거저리유충 분말 500 g 을 비닐팩에 넣고 진공포장하여 공기가 들어가지 않도록 잘 밀봉한 후, 초고압 추출장치(55L HPP plant, Uhde 055-60, thyssenkrupp, Duisburg, Germany)를 이용하여 500 Mpa의 압력으로 5분간 처리하였다.
3. 가수분해물 제조
초고압 처리 또는 미처리된 갈색거저리 유충 분말을 멸균 증류수에 용해하여 10%(w/v)의 기질용액으로 제조하였다. 기질 대비 단백질 가수분해 효소(alcalase, flavourzyme, protamax)를 각각 1%(w/w)또는 3%(w/w)가 되도록 첨가하여 55℃, 100 rpm 에서 10시간 동안 가수분해 하였고, 90℃에서 30분간 가열하여 효소를 불활성화하였다. 방랭한 후 가수분해물을 4,000 ×g에서 10분 동안 원심분리 하여 상등액을 분리하여 상등액을 취했으며, 얻어진 상등액을 다시 No. 1 및 3 filter paper(whatman, Maidstone, UK)로 여과한 여액을 취해 최종적인 단백 가수분해물을 얻었다. 단백가수분해물은 동결 건조한 후 -20℃에 보관하면서 추후 실험에 사용하였다.
4. 단백질 가수분해도 측정
가수분해도 측정은 Trichloroacetic acid(TCA) precipitation과 Bradford assay를 이용하였다. 20% TCA 500 μL와 가수 분해물 500 μL를 더해 4℃에서 30분간 반응시킨 후 원심분리(2560 xg, 4℃, 15min)하여 얻은 상층액의 단백질 농도를 Bradford 방법으로 측정하여 TCA 가용성 단백질 농도를 측정하였다. 총 단백질 농도를 Bradford assay를 이용하여 가수 분해물 10 μL와 Bradford dye regent 200 μL를 더해 실온에서 8분간 반응 시킨 후 595 nm에서 흡광도를 측정하였다. 가수분해도 산출은 아래의 식과 같이 계산하였다.
5. 일반성분 특성분석
열수추출한 시료 및 가압증숙 또는 초고압 처리 후 가수분해 된 갈색거저리 유충 분말시료의 수분, 조회분, 조단백질, 조지방 등 일반성분 측정은 각각 상압가열 건조법, 킬달분석법, soxhlet 추출법, 직접회화법으로 측정하였으며, AOAC (1995)의 방법 932.06, 925.09, 923.03 등에 따라 실험하였다. 탄수화물의 함량은 전체 중 수분, 조단백, 조지방, 회분의 함량을 뺀 비율로 구하였다.
6. GPC(Gel permeation chromatography) 분석
열수추출한 시료 및 가압증숙 또는 초고압 처리 후 가수분해 된 갈색거저리 유충 분말시료의 단백질 크기분포를 분석하기 위하여 GPC(e2695, Waters, MILFORD, MA, USA)를 실시하였다. 가수분해물에 대한 GPC 분석은 동결건조된 상등액을 용매(증류수)를 사용하여 용해한 후 Table 1의 분석조건에 따라 수행하였으며 분자량 확인을 위한 표준품은 Polystyrene을 이용하였다. 수용성 GPC는 각각 분자량 106, 430, 1,030, 1,400, 4,290, 6,690, 12,600, 20,600의 polystyrene을 표준품으로 이용하였다. polystyrene 표준품을 이용하여 retention time에 따른 log(molecular weight) 그래프를 그린 뒤, 이를 표준곡선으로 활용하였다.
7. 유리아미노산 분석
열수추출한 시료 및 가압증숙 또는 초고압 처리 후 가수분해 된 갈색거저리 유충 분말시료를 각각 0.20 g씩에 증류수 5 mL씩을 가하고 상온에서 20분간 초음파 처리한 다음 여과 후 여과액 1 mL에 7% 5-sulfosalicylic acid 수용액 1 mL를 가하고 2시간 동안 유지하여 단백질을 침전시킨 다음 원심분리 (4,500 rpm, 10분)하였다. 상등액은 검량분석 범위내로 희석한 다음 membrane filter(0.45 um)로 여과한 후 아미노산 자동분석기로 분석하였다.
아미노산 분석기는 Sykam GmbH사 (Gewerbering, Eresing, Germany)의 S7130 amino acid reagent organizer, S5200 sample injector와 S2100 solvent delivery system을 사용하였으며, column은 cation separation column LCA K06/NA (4.6 × 250 mm)을 사용하였다. 이동상의 유속은 0.45 mL/min, ninhydrin은 0.4 mL/min으로 하였다.
8. Total polyphenol(Folin-Ciocalteau Micro Method)
총 페놀함량의 측정은 Folin-Denis법(Ainsworth et al. 2007)을 변형하여 실험하였다. 96 well plate에 시료와 Folin-Ciocalteu's phenol 시약을 넣고 혼합하였다. 실온에서 3분 동안 반응시킨 후, 포화 sodium carbonate 용액을 넣고 20분 동안 반응시킨 뒤, 반응용액을 760 nm에서 흡광도를 측정하였다. 총 페놀 함량은 시료 1 ml 에 해당하는 gallic acid의 용량(μg)으로 표시하였다.
9. Trolox Equivalent Antioxidant Capacity (ABTS)
ABTS assay 방법은 Re et al.(1999)의 방법을 변형하여 실험하였다. ABTS 용액은 7.4 mM ABTS와 2.45 mM K2S2O8을 포함하는 ABTS 용액에 시료를 혼합하여 실온에서 6분간 반응시킨 후, 734 nm에서 흡광도를 측정하였다. 항산화능은 표준품인 Trolox를 사용하였고. 해당 표준품을 이용하여 표준곡선을 작성하고, ABTS 라디칼 소거활성은 mM Trolox equavalent /µL로 나타내었다.
10. Superoxide dismutase(SOD) 활성 측정
SOD 활성은 sample 내의 SOD 활성을 water soluble tetrazolium salt (WST)을 이용하여 측정하였으며 측정용 kit(DG-SOD400, Dogenbio, Seoul, Korea)를 이용하였다.
Dilution Solution에 희석된 샘플 20 μL와 WST Solution 200 μL, Xanthine oxidase 20 μL을 넣은 혼합액을 만들어 37℃에서 30분 동안 반응시킨 후, microplate reader(Infinite M Nano, TECAN, Männedorf, Swiss)를 이용하여 450 nm에서 흡광도를 측정하였다. SOD 활성은 샘플을 넣지 않은 BNK1과 Xanthine oxidase을 넣지 않은 BNK3을 각각 계산하여 각 계산값을 뺀 값을 나눈 값으로 활성을 측정하였다. 계산식은 아래와 같다.
11. Catalase 활성 측정
Catalase 활성은 H2O2의 가수분해 정도를 측정한 catalase 측정용 kit(DG-CAT400, Dogenbio, Korea)를 이용하였다. 각각의 시료를 catalase assay buffer로 희석하여 원심분리 한 후 상층액을 시료로 이용하였다. Catalase 활성은 각각의 well에 시료 25 μL와 40 μM H2O2 25 μL를 넣고 25℃에서 30분 동안 배양한 후 working solution을 첨가하여 측정하였다. 10 mM Oxi-Probe (MW=257) 50 μL, HRP (Horseradish peroxidase) solution 20 μL를 첨가한 5 ml 의 working soluion을 제조한 후 해당 용액을 50 μL를 넣고 빛이 차단된 37℃에서 30분 동안 배양하고 microplate reader(Infinite M Nano, TECAN, Männedorf, Swiss)를 이용하여 560 nm에서 H2O2 분해에 따른 흡광도를 측정하였다.
12. 통계처리
실험 결과의 통계처리는 SPSS program(statistical package for social sciences; ver. 25, IBM Corporation, New York, NY, USA)을 이용하여 분석하였고 모든 실험은 3회 진행되었으며 평균 ± 표준편차(mean ± SD)로 나타내었다. 각 군 간의 평균값에 대한 유의성은 신뢰수준(p<0.05)에서 one-way ANOVA test를 실시하고 유의한 차이를 검증한 후 사후분석으로 Tukey’s multiple range test를 사용하여 검증하였다.
Ⅲ. 결과 및 고찰
1. 일반성분 분석
열수추출(WE), 가압증숙 후 가수분해(P), 초고압 처리 후 가수분해한(HP) 갈색거저리 유충의 일반성분은 Table2 와 같다. 열수 추출한 갈색거저리 유충의 일반성분 함량은 수분 2.38%, 조회분 12.88%, 조단백질 56.53%, 조지방 7.28%, 탄수화물 20.93%로 나타났고, 가압증숙 후 효소처리 한 갈색거저리 유충 가수분해물의 일반성분 함량은 수분 3.27%, 조회분 7.19%, 조단백질 67.03%, 조지방 4.72%, 탄수화물 17.78%로 나타났다. 그리고 초고압 처리 후 효소처리 한 가수분해물의 일반성분 함량은 수분 2.99%, 조회분 9.97%, 조단백질 68.74%, 조지방 0.28%, 탄수화물 18.01%로 나타났다. 이는 기존 갈색거저리 유충의 단백가수분해물에 대한 일반성분 연구가 없으므로 중요한 참고자료가 될 것으로 판단된다.
2. 단백질 가수분해도 및 GPC(Gel permeation chromatography) 분석
열수추출, 가압증숙 후 효소처리, 초고압 처리 후 효소처리 한 갈색거저리 유충의 단백질 가수분해도는 Table 3과 같다. 가압증숙 처리 후 효소처리한 경우 가수분해도는 열수추출군의 8.5% 보다 22.5% 늘어난 31.0%로 나타났으며 초고압처리 후 가수분해한 경우는 19.4% 증가된 27.9%로 나타나 가압증숙 조건에서 초고압 처리군 대비 가수분해도가 3.1% 높은 것으로 나타났다. GPC분석을 이용한 분자량 분포는 Fig. 1 및 Table 4 와 같다. GPC 결과에서 나타난 것처럼 열수추출물의 분자량 분포 패턴과 가수분해 처리군의 분포 패턴은 확연하게 차이가 나타났으며, Table 4의 결과와 같이 가수분해된 펩티드의 분자량 분포를 확인한 결과, 10,000 Da 이상의 고분자 군은 열수추출물에서 12.52% 로 나타났으며 가압증숙 후 가수분해물과 초고압 처리 후 가수분해물에서 각각 3.08%, 1.21%로 나타나 가수분해에 의해 저분자화가 됨을 확인하였다. 또한 5,000~10,000 Da 사이의 화합물은 가부분해 군에서 완전히 분해되어 정량한계 미만으로 측정되었다. 가수분해 군에서 가압증숙 조건과 초고압 조건의 경우 초고압 조건에서 500 Da 이하의 저분자 화합물이 65.42%로 가압증숙 효소분해군의 44.36% 보다 약 1.5배 증가한 것으로 나타났다. 이를 통해 초고압 처리는 가수분해시 가수분해도에 영향을 주는 것 보다 펩티드의 저분자화와 관련이 있음을 확인하였다.
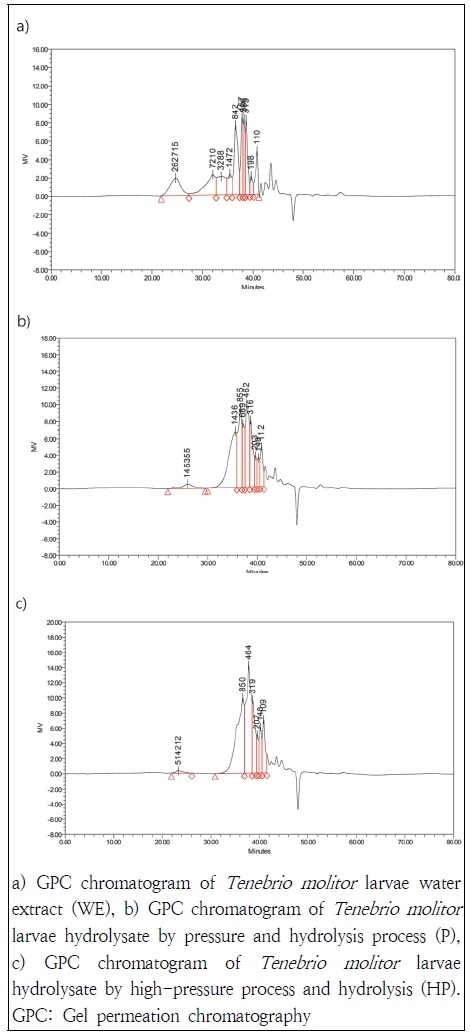
Representative GPC chromatogram of Tenebrio molitor larvae extracts with various extraction methods.
3. 유리아미노산 분석
열수추출, 가압증숙 후 효소처리, 초고압 처리 후 효소처리 한 갈색거저리 유충의 유리아미노산을 분석결과는 Table 5와 같다. 유리 아미노산 총 함량은 열수추출군에서 332.00 mg/mL 가압증숙 후 가수분해군에서 251.82 mg/mL, 초고압처리 후 가수분해군에서 222.10 mg/mL로 나타났다. 전체 아미노산중 가장 높은 함량을 나타낸 것은 proline 으로 열수추출군에서 113.32 mg/mL, 가압증숙 후 가수분해군에서 66.01 mg/mL, 초고압처리군에서 50.65 mg/mL로 확인되었다. 가수분해를 통해 유의적으로 함량이 증가한 아미노산은 tryptophane, isoleucine, leucine 이며 유의적으로 감소한 아미노산은 glutamic acid 와 arginine 으로 확인되었다. 초고압 처리에 의해 유의적으로 함량이 변화한 아미노산은 lysine, arginine 및 serine으로 확인되었다. 이와 같은 결과를 통해 가수분해를 통해 갈색거저리 유충 단백 가수분해물의 유리아미노산 함량패턴이 변화 하는 것을 확인 할 수 있었으며 초고압 처리에 의해 아미노산 함량이 변하는 것을 확인하였다.
4. 총 polyphenol 함량 분석
갈색거저리 유충 탈지분말의 추출 및 가수분해 조건에 따라 각 시료의 총 polyphenol 함량 측정 결과는 Table 6과 같다. 가압조건 및 가수분해에 따른 시료의 총 polyphenol 함량은 대조군인 열수추출이 759.87 ± 19.59 μg GAE/mL 이고 가압증숙 후 효소처리한 군에서는 1742.08 ± 42.32 μg GAE/mL, 초고압 처리 후 가수분해한 조건에서는 1027.54 ± 13.56 μg GAE/mL이었다. 상기 결과에서와 같이 가압 또는 초고압 처리 후 효소처리한 군에서 대조군에 비해 유의적인 증가를 보였으며 가압처리 가수분해 조건이 초고압 처리한 조건보다 약 69% 수준으로 증가하는 것으로 나타났다. 이와같이 초고압 처리보다 가압증숙 조건에서 페놀화합물이 더 많이 추출되는 것으로 확인되었다. 이는 다른 초고압 처리된 추출물에 대한 연구 결과(Choi & Lee 2014; Park et al. 2014)와는 다른 경향을 보였다. 따라서 추후 가압증숙 조건과 초고압 처리 조건에 대한 세부적인 연구가 필요할 것으로 판단된다.
5. ABTS 전자 공여능 분석
추출물에서 자유라디칼을 환원 또는 상쇄시킬 수 있는 능력이 높으면 강한 항산화 활성을 기대할 수 있으며, 이는 인체 내에서 자유라디칼에 의해 노화되는 현상을 억제하는 척도로 측정이 가능하다 (Park et al. 2005). 2,2'-azino-bis-3-ethylbenzothiazoline-6- sulphonic acid(ABTS)는 시료의 전자공여능을 측정하여 항산화 활성을 측정하는 방법으로서 hydrogen donating antioxidant와 chain breaking antioxidant 모두를 측정할 수 있다.
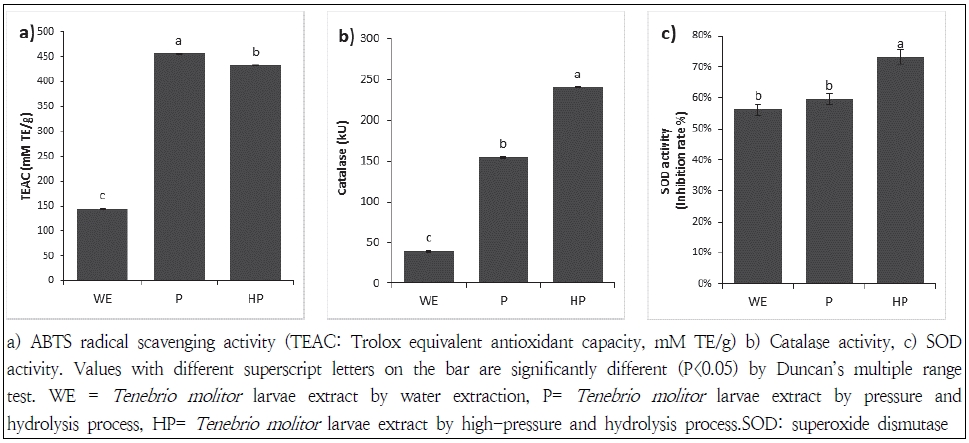
추출 공정에 따른 갈색거저리 유충 가수분해물의 ABTS free radical 소거활성을 측정한 결과를 Figure. 2에 나타내었다. 같은 농도에서 가압처리 및 초고압 처리 후 가수분해한 경우 열수 추출물과 유의적인 차이를 보였다. TEAC(Trolox equivalent antioxidant capacity, mM TE/g)로 환산하여 측정한 결과 갈색거저리 유충 가수분해물의 ABTS radical 소거활성은 열수 추출물, 가압증숙 가수분해물, 초고압 가수분해물이 각각 145.1, 455.7, 433.0 mM TE/g 으로 가압증숙 가수분해 추출물이 가장 높은 자유라디칼 소거력을 보였으며, 가장 낮은 열수 추출물에 비해 약 3.1배 활성이 증진된 것을 확인할 수 있었다. 이는 총 polyphenol 함량과 유사한 경향을 보여주었다.
6. Catalase 활성 분석
신체 내에서 산화적 스트레스로 인하여 생성된 활성산소종(reactive oxygen species, ROS)을 제거하기 위한 반응으로 항산화 효소인 SOD(superoxide dismutase), CAT(catalase), GPx(glutathione peroxidase) 등이 있다. Catalase는 대표적인 항산화 효소로 생존하는 대부분의 동, 식물에 존재하며, 일반적으로 호기성 물질대사에서 생성되는 독성물질인 H2O2나 ROS의 분해 작용에 관여하는 것으로 알려져 있다(Iwase et al. 2013).
SOD와 CAT는 서로 상호작용으로 ROS를 제거하는데 SOD가 먼저 ROS를 H2O2로 전환시키고 CAT에 의해 물과 산소로 분해시킨다(Paglia & Valentine 1967). 갈색거저리 유충 가수분해물의 catalase 활성은 Fig. 2에서 보는 바와 같이 초고압 처리 후 가수분해 조건에서 catalase 240.8 kU 과 동일한 활성이 나타나 가장 높은 수치를 나타냈다. 상대적으로 가압증숙 조건에서는 154.5 kU, 열수추출에서는 40.0 kU로 열수추출과 초고압처리 가수분해물은 약 6배의 활성차이를 보였다.
7. SOD 유사 활성 분석
SOD는 생체에 유해한 superoxide anion radical과 반응하여 hydrogen peroxide와 산소로 전환시키는 효소로서 세포독성을 완화하는 역할을 하며, 생체 내 활성산소종에 대한 방어기작을 가지는 대표적인 항산화 효소로 알려져 있다(Ighodaro & Akinloyeb 2018). 갈색거저리 유충 가수분해물의 SOD 유사활성은 Fig. 2에서 보는 바와 같이 초고압 처리 후 가수분해 조건에서 73%로 가장 높았으며 열수추출 조건에서 56%로 가장 낮았다. 특히 본 연구에서는 초고압 처리된 가수분해물의 경우 갈색거저리의 SOD 유사활성은 이전 연구(Gim et al. 2018) 의 46.7% 보다 약 1.5배 정도 높은 것으로 나타났다. 따라서, 지속적으로 최적화된 추출방법을 개발하여 효소적 항산화 활성을 비교 평가하는 연구가 필요하다.
Ⅳ. 요약 및 결론
본 연구는 갈색거저리 유충 단백질 분말을 다양한 방법으로 추출하여 그 이화학적인 특성을 분석하고 항산화 활성을 확인하였다. 단백질을 가수분해할 경우 펩티드의 저분자화가 진행되는데 가수분해 전 단백질 상태에서의 초고압 처리를 통하여 가수분해 후 펩티드 분포와 유리 아미노산 함량 분포가 변하는 것을 확인하였다. 또한 가수분해 후 시료에 존재하는 총 polyphenol 함량이 증가하는 것을 확인하였으며 이와 유사한 경향으로 ABTS 전자공여능 시험에서 항산화능이 유의적으로 증가하는 것을 확인하였다. 그러나 효소적 항산화 평가인 CAT 및 SOD 활성에서는 총 polyphenol 함량의 경향과 무관하게 초고압 처리군에서 증가하는 것을 확인하였다. 이는 GPC 분석에서 500 Da 이하 펩티드의 함량이 초고압 처리에서 증가하는 패턴을 보이는 것으로 볼때 효소적 항산화 활성은 저분자화된 펩티드 성분에 기인한다고 추론할 수 있을 것이다. 갈색거저리 단백 가수분해물의 연구와 관련하여 대두단백 가수분해물과의 특성을 비교한 연구(Yu et al. 2021), 단백가수분해물의 제조법과 항산화 활성에 관한 연구(Yu et al. 2017), 항산화 활성 및 췌장효소 억제활성에 대한 연구(Hierro et al. 2020) 등이 확인되었다. 그러나, 본 연구와 같이 다양한 가수분해 전처리 방법에 의해 가수분해물의 특성에 대한 연구는 이루어지지 않았고 이에 따른 항산화 평가도 이루어지지 않았다. 본 연구를 통해 가수분해 전처리 방법에 따라 펩티드 분자량 분포가 변하는 것을 확인하였으며 이와 연관되어 항산화 활성에 영향을 주는 것을 확인하였다. 그러나, 항산화 활성의 원인 물질을 규명하는 것과 저분자화된 펩티드들의 다른 생리활성에 대한 연구는 본 연구에서 확인하지 못하였으므로 추후 연구가 필요하다. 결론적으로 갈색거저리 유충에서 초고압 처리는 가수분해 펩티드 저분자화와 효소적 항산화 활성에 영향을 줄 수 있음을 확인하였다.
Acknowledgments
This work was supported by a grant of the Agricultural Technology Commercialization Support Project through the Rural Development Administration, Republic of Korea(Project number PJ01638101).
References
-
Ainsworth EA, Gillespie KM(2007) Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin–Ciocalteu reagent. Nat Protoc 2(4), 875-877.
[https://doi.org/10.1038/nprot.2007.102]

-
Baek M, Seo M, Kim MA, Yun EY, Hwang JS(2017) The antioxidant activities and hair-growth promotion effects of Tenebrio molitor Larvae extracts (TMEs). J Life Sci 27(11), 1269–1275.
[https://doi.org/10.5352/JLS.2017.27.11.1269]

-
Choi WY, Lee HY(2014) Enhancement of antioxidant activities of curcuma longa leaves by ultra high pressure extraction. Korean J Med Crop Sci 22(2), 121−126.
[https://doi.org/10.7783/KJMCS.2014.22.2.121]

-
Chung MY, Kwon EY, Hwang JS, Goo TW, Yun EY(2013) Pre-treatment conditions on the powder of Tenebrio molitor for using as a novel food ingredient. J Seric Entomol Sci 51(1), 9-14.
[https://doi.org/10.7852/jses.2013.51.1.9]

- Chung SJ, Lee YH, Chung JH, Lee BR, Han DM(1995) Antifungal effect and activity spectrum of crude antifungal proteins from hemolymph of larvae of Tenebrio molitor in Korea. Korean J Mycol 23(3), 232-237
-
Gim DW, Park JK, Kim HJ, Cho IK, Cho JY, Huh CK(2018) Physicochemical properties and antioxidant activities of Streptococcus thermophilus KCCM 3782 strain fermented Cordyceps militaris grown on Tenebrio molitor. Korean J Food Preserv 25(1), 136–144.
[https://doi.org/10.11002/kjfp.2018.25.1.136]

-
Gupta RK, Patel AK, Shah N, Choudhary AK, Jha UK, Yadav UC, Gupta PK, Pakuwal U(2014) Oxidative stress and antioxidants in disease and cancer: a review. Asian Pac J Cancer Prev 15(11), 4405–4409.
[https://doi.org/10.7314/APJCP.2014.15.11.4405]

-
Hierro JN, Gutierrez DA, Otero P, Reglero Martin GD(2020) Characterization, antioxidant activity, and inhibitory effect on pancreatic lipase of extracts from the edible insects Acheta domesticus and Tenebrio molitor. Food Chem 309, 125742.
[https://doi.org/10.1016/j.foodchem.2019.125742]

-
Ighodaro OM, Akinloyeb OA(2018) First line defence antioxidants-superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GPX): Their fundamental role in the entire antioxidant defence grid. Alexandria J Med 54(4), 287-293.
[https://doi.org/10.1016/j.ajme.2017.09.001]

-
Iwase T, Tajima A, Sugimoto S, Okuda KI, Hironaka I, Kamata Y, Takada K, Mizunoe Y(2013) A simple assay for measuring catalase activity: a visual approach. Sci Rep 3(1), 1-4.
[https://doi.org/10.1038/srep03081]

- Kim TK, Yong HI, Lee JH, Cha JY, Kang MC, Jung S, Choi YS(2021) Development of new technology for functional materials for edible insects as alternative food. Korean Soc Food Sci Anim Resour 10(1), 31-43
-
Nita M, Grzybowski A(2016) The role of the reactive oxygen species and oxidative stress in the pathomechanism of the age-related ocular diseases and other pathologies of the anterior and posterior eye segments in adults. Oxidative Med Cell Longev 2016 1–23.
[https://doi.org/10.1155/2016/3164734]

-
Paglia DE, Valentine WN(1967) Studies on the quantitative and qualitative characterization of erythrocyte glutathione peroxidase. J Lab Clin Med 70(1), 158-169.
[https://doi.org/10.5555/uri:pii:0022214367900765]

- Park KE, Jang MS, Lim CW, Kim YK, Seo Y, Park HY(2005) Antioxidant activity on ethanol extract from bolied-water of Hizikia fusiformis. J Korean Soc Appl Biol Chem 48(4), 435-439
-
Park KH, Kim GY(2018) Quality and characteristics of manufacturing Sunsik with edible insect (Mealworm). Culin Sci Hos Res 24(1), 13-23.
[https://doi.org/10.20878/cshr.2018.24.1.002]

-
Park SJ, Choi YB, Ko JR, Gha YA, Lee HY(2014) Quality caracteristics of Citrus fruit by cyclic low pressure dying and high hydrostatic pressure extraction. Culin Sci Hos Res 20(3), 13-21.
[https://doi.org/10.20878/cshr.2014.20.3.002002002]

-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Evans CR(1999) Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med 26(9-10), 1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Schieber M, Chandel NS(2014) ROS function in redox signaling and oxidative stress. Curr Biol 24(10), R453–R462.
[https://doi.org/10.1016/j.cub.2014.03.034]

-
Wade M, Hoelle J(2020) A review of edible insect industrialization: scales of production and implications for sustainability. Environ Res Lett 15(2020), 123013.
[https://doi.org/10.1088/1748-9326/aba1c1]

-
Xu DP, Li Y, Meng X, Zhou T, Zhou Y, Zheng J, Zhang JJ, Li HB(2017) Natural antioxidants in foods and medicinal plants: extraction, assessment and resources. Int J Mol Sci 18(1), 96.
[https://doi.org/10.3390/ijms18010096]

-
Yoo J, Hwang JS, Goo TW, Yun EY(2013) Comparative analysis of nutritional and harmful components in Korean and Chinese mealworms (Tenebrio molitor). J Korean Soc Food Sci Nutr 42(2), 249-254.
[https://doi.org/10.3746/jkfn.2013.42.2.249]

- Yoo OS, Choi YC, Song HS(2011) Breed and utilization of mealworm (Tenebrio molitor). Suwon: National Institute of Agricultural Science, pp14-168
-
Youn K, Yun EY, Lee J, Kim JY, Hwang JS, Jeong WS, Jun M (2014) Oleic acid and linoleic acid from Tenebrio molitor larvae inhibit BACE1 activity in vitro: molecular docking studies. J Med Food 17, 284-289.
[https://doi.org/10.1089/jmf.2013.2968]

-
Yu MH, Lee HS, Cho HR, Lee SO(2017) Enzymatic preparation and antioxidant activities of protein hydrolysates from Tenebrio molitor Larvae (Mealworm). J Korean Soc Food Sci Nutr 46(4), 435–441.
[https://doi.org/10.3746/jkfn.2017.46.4.435]

- Yu X, Oh E, Kim Y(2021) A comparative study on the functional properties of mealworm (Tenebrio molitor) larvae and soybean protein isolates and hydrolysates. Int Food Res J 28(4), 816-826