토마토 추출물의 라디칼 소거 및 항염증 활성


This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study compares the antioxidant and anti-inflammatory capacities of acetone extracts obtained from commercially available tomatoes (gangwon chal, wansuk, cherry, daechu cherry, plum, and campari). Campari and cherry tomatoes had the highest levels of 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical, 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) radical, and hydroxyl radical scavenging activities, as well as cupric reducing antioxidant capacity (CUPRAC), followed sequentially by gangwon chal, daechu cherry, plum and wansuk varieties. Highest peroxynitrite scavenging activity, oxygen radical absorbance capacity (ORAC), and total phenolic contents were obtained in campari tomatoes, followed by cherry, gangwon chal, daechu cherry, plum and wansuk varieties. Lycopene contents were highest in cherry tomato, followed by daechu cherry and campari, and were lowest in the gangwon chal, plum and wansuk varieties. Maximum inhibition of the lipopolysaccharide-induced nitric oxide production in RAW 264.7 cells was observed in campari tomatoes, followed by cherry, daechu cherry, gangwon chal, plum and wansuk varieties. Antioxidant activities, including hydroxyl radical and peroxynitrite scavenging, ORAC, and CUPRAC, showed a high correlation with the total phenolic or lycopene contents. Anti-inflammatory capacity was highly correlated with antioxidant activities, total phenolic, and lycopene contents. Taken together, findings of the current study demonstrate that campari and cherry tomatoes have the most potent antioxidant and anti-inflammatory effects, which are closely related to the lycopene as well as polyphenolic contents.
Keywords:
tomatoes, lycopene, radical scavenging, antioxidant, anti-inflammationⅠ. 서론
생체내에서 미토콘드리아에 의해 소비되는 산소의 1∼5%는 히드록실 라디칼, 슈퍼옥시드 음이온, 퍼옥실 라디칼, 과산화수소 등의 반응산소종과 산화질소, 퍼옥시니트리트 등의 반응질소종으로 전환된다(Ames et al. 1993). 반응종 또는 유리 라디칼의 과다 생성으로 인한 산화-항산화의 심각한 불균형은 지질, DNA, 단백질 등과 같은 거대 생체분자들에 생물학적 손상을 유발시키며, 이러한 산화스트레스는 동맥경화증, 암, 뇌졸증, 천식, 노화, 당뇨, 관절염 등 많은 퇴행성 질병들과 연관이 있다(Lee et al. 2004). 최근에는 폴리페놀과 카로티노이드 등과 같이 항산화 활성이 높은 파이토케미칼을 함유한 채소나 과일의 섭취가 산화스트레스에 의해 유발되는 만성질환의 위험을 줄인다는 연구결과가 많이 보고되고 있다(Zhang et al. 2015). 플라보노이드, 페놀산 및 탄닌으로 구성된 폴리페놀은 식물계에 널리 퍼져있는 파이토케미칼로써 방향족 링 구조와 1개 또는 그 이상의 히드록실 치환기로 구성되어 있으며, 항산화, 항염증, 항알러지, 항미생물 그리고 항바이러스 효능을 나타낸다고 알려져 있다(Pandey & Rizvi 2009). 카로티노이드는 식물, 조류, 진균 그리고 세균들에 의해 생성되는 지용성의 붉은색 및 노란색 계통의 색소로써, 일중항 산소, 히드록실 라디칼, 슈퍼옥시드 음이온을 포함한 자유 라디칼들을 소거하는 능력 때문에 산화스트레스와 염증에 대한 중요한 방어 역할을 담당하는 항산화 물질이다(Krinsky 1989).
토마토(Solanum lycopersicum)는 가지과에 속하는 과채류이며, 비타민, 무기물, 아미노산, 항산화 물질 등 다양한 영양소들을 포함하고 있다(Pinela et al. 2012). 토마토 섭취는 염증, 암, 관상동맥 심장질환, 고혈압, 당뇨, 비만 등을 감소시킨다는 역학연구 결과들이 보고되고 있고(Agarwal & Rao 2000), 이러한 토마토의 만성 질환의 감소 효과들은 항산화 물질들에 기인되며, 토마토의 항산화 활성은 수용성 페놀화합물과 비타민 C 등의 친수성 항산화물질(83%)과 카로티노이드, 비타민 E, 지용성 페놀화합물 등의 지용성 항산화물질(17%)로 분류된다(Kotikova et al. 2011). 토마토의 항산화 활성은 품종, 숙성도, 토양, 기후 조건 및 수확후 상태에 의해 영향을 받는다고 보고된 바 있다(Kotikova et al. 2011; Kubota et al. 2012). 토마토는 붉은색, 오렌지색 또는 노란색을 띠고 있으며, 이러한 색깔은 리코펜, 베타-카로틴 및 루테인 등의 카로티노이드 성분의 차이에 기인하는 것으로, 그 중에서 토마토의 붉은색을 나타내는 항산화 물질은 리코펜으로 알려져 있다(George et al. 2011; Li et al. 2013). 붉은색 계통의 토마토는 노란색 계통의 토마토에 비해 2,2-diphenyl-1-picrylhydrazyl(DPPH) 소거활성과 산소라디칼 흡수 효능이 높았으며, 과산화수소에 의해 유도된 세포사 억제효과가 높았다(Li et al. 2013). 리코펜은 산화스트레스를 감소시킴으로써 만성질환 위험을 감소시키고, 중성지방과 LDL 콜레스테롤 수준을 감소시키며, 산화에 대한 LDL 저항과 HDL 콜레스테롤 수준을 증가시켰다(Clinton 1998; Shen et al. 2007; Silaste et al. 2007). 방울토마토는 일반(regular) 토마토에 비해 DPPH 라디칼과 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid(ABTS) 라디칼 소거활성 및 철이온 환원력이 높았으며, 리코펜 함량도 높게 나타났다(Bhandari et al. 2016). 토마토의 DPPH 라디칼과 ABTS 라디칼 소거활성 등의 항산화 활성과 리코펜 함량 또는 총페놀 함량 간의 상관관계는 높게 나타났으나(Li et al. 2013; Bhandari et al. 2016; Stinco et al. 2016), Szabo et al.(2019)은 토마토의 DPPH 라디칼 소거활성과 총페놀 함량 간의 상관관계는 관찰되지 않았다고 보고한 바 있다.
이와 같이, 토마토의 유효성분, 항암, 심혈관질환 감소, 항염증, 항산화 활성 등에 관해 보고되고 있으나, 국내에서 생산되는 토마토 품종간 히드록실 라디칼, 퍼옥실 라디칼, 퍼옥시니트리트 등 다양한 라디칼에 대한 소거활성과 항염증 효과의 비교에 관한 연구는 거의 수행된 바가 없다. 따라서 본 연구에서는 시중에 유통되고 있는 토마토들의 라디칼 소거활성, 환원력, 총페놀과 총플라보노이드 함량, 리코펜과 베타-카로틴 함량 및 염증 억제효과를 비교ㆍ조사하였으며, 항산화 활성, 항염증 효능, 페놀화합물 함량 및 리코펜 함량 간의 상관관계를 조사하였다.
II. 연구방법
1. 재료 및 시약
시중에 유통되고 있는 6종의 토마토(학명; 품종명)-강원찰토마토(Solanum lycopersicum L.; Dongyu250), 완숙토마토(Solanum lycopersicum L.; Torry), 방울토마토(Solanum lycopersicum var. cerasiforme; TY Dalkomi), 대추방울토마토(Solanum lycopersicum var. cerasiforme; TY Nonari), 플럼토마토(Solanum lycopersicum L.; Roma) 및 캄파리토마토(Solanum lycopersicum L.; Campari)를 구입하여 본 연구에 사용하였다. 우태아혈청은 Lonza(Walkersville, MD, USA)로부터 구입하여 사용하였고, 그 외 실험에 사용된 시약들은 분석급으로 Sigma-Aldrich Co.(St. Louis, MO, USA)로부터 구입하였다.
2. 시료의 추출
꼭지를 제거하고 깨끗이 세척한 토마토 시료들을 블렌더(Axlerim Z HC-BL5000, Happycall, Gimhae, Gyeongsangnam-do, Korea)를 사용하여 분쇄한 후, 50℃로 예열된 오븐(Eyela NDO-400, Rikakikai Co., Tokyo, Japan)에서 48시간 건조하였다. 건조된 시료 1 g에 7 mL의 80% 아세톤 용액을 첨가하고 10분간 혼합한 후, 초음파 분쇄기(Sonic Dismenbrator Model 100, Fisher Scientific, Pittsburgh, PA, USA)를 사용하여 25W에서 10분간 분쇄하였다. 초음파 분쇄된 혼합물은 10,000×g에서 10분간 원심분리하여 상등액을 수거하고, 분석 시까지 –20℃에서 보관하였다.
3. 분석
추출물의 DPPH 라디칼 소거활성은 Scherer & Godoy(2009)의 방법을 변형하여 측정하였다. DPPH 용액(0.12 mM) 195 μL과 추출물 또는 80% 아세톤 5 μL을 혼합하고, 517 nm에서 60분 동안 분광광도계(Epoch, BioTek, Winooski, VT, USA)를 사용하여 흡광도를 측정하였다. DPPH 라디칼 소거활성은 다음 식으로 계산하였다: DPPH 라디칼 소거활성(억제 %)=[1-(추출물의 흡광도/추출물 무첨가군의 흡광도)]×100. 또한, 양성 대조군으로 α-토코페롤 저장(stock) 용액(10 mg/mL DMSO)을 80% 아세톤으로 농도별 희석한 후 사용하여 추출물의 DPPH 라디칼 소거활성과 비교하였다.
추출물의 ABTS 라디칼 소거활성은 Trolox equivalent antioxidant capacity(TEAC) 방법을 수정한 Erel(2004)의 방법을 변형하여 측정하였다. 추출물 또는 80% 아세톤 5 μL과 0.4 M 아세트산 완충용액(pH 5.8) 200 μL을 혼합한 후, 10 mM ABTS 용액과 5 mM 과산화수소 용액으로 구성된 0.03 M 아세트산 완충용액(pH 3.6) 20 μL을 첨가하여 혼합하고 5분간 방치한 후 660 nm에서 흡광도를 측정하였다. Trolox를 표준시약으로 사용하여 표준곡선을 작성하였고, ABTS 라디칼 소거활성은 nmol Trolox 등가물(TE)/mL로 표기하였다. 또한, 양성 대조군으로 α-토코페롤 저장용액(10 mg/mL DMSO)을 80% 아세톤으로 농도별 희석한 후 사용하여 추출물의 ABTS 라디칼 소거활성과 비교하였다.
추출물의 히드록실 라디칼 소거활성은 Moore et al.(2006)의 방법을 변형하여 측정하였다. 추출물 또는 80% 아세톤 20 μL과 75.2 nM 플루오레세인 용액을 혼합하고, 265.3 mM 과산화수소 20 μL을 첨가한 뒤 잘 혼합하였다. 6.86 mM 염화제이철 용액 20 μL을 첨가한 후, 형광광도계(GEMINI XS, Molecular Devices, Sunnyvale, CA, USA)를 사용하여 37℃에서 3시간 동안 여기(excitation)파장 485 nm와 방출(emission)파장 535 nm에서 형광도를 측정하였다. 표준시약으로 사용한 Trolox와 추출물의 곡선면적(area under the curve)을 각각 측정하였으며, 히드록실 라디칼 소거활성은 표준시약 농도와 곡선면적 간의 회귀곡선을 이용하여 nmol TE/mL로 표기하였다. 또한, 양성 대조군으로 아스코르브산 저장용액(0.5 mg/mL 증류수)을 80% 아세톤으로 농도별 희석한 후 사용하여 추출물의 히드록실 라디칼 소거활성과 비교하였다.
추출물의 퍼옥시니트리트 소거활성은 Kooy et al.(1997)의 방법을 변형하여 측정하였다. 추출물 또는 80% 아세톤 10 μL과 0.1 mM 디에틸렌트리아민펜타아세트산 용액(pH 7.4) 100 μL을 혼합하고, 40 uM 이염화플루오레신 용액 50 μL과 5 uM 5-아미노-3-(4-모르폴리닐)-1,2,3-옥사디아조늄 염화물 용액 40 μL을 각각 첨가한 후, 37℃에서 30분 동안 여기파장 488 nm와 방출파장 525 nm에서 형광도를 측정하였다. 퍼옥시니트리트 소거활성은 다음 식으로 계산하였다: 퍼옥시니트리트 소거활성(억제 %)=[1-(추출물의 형광도/추출물 무첨가군의 형광도)]×100. 또한, 양성 대조군으로 시스테인 저장용액(2 mg/mL 증류수)을 80% 아세톤으로 농도별 희석한 후 사용하여 추출물의 퍼옥시니트리트 소거활성과 비교하였다.
추출물의 ORAC는 Huang et al.(2002)의 방법에 따라 측정하였다. 추출물 또는 80% 아세톤 20 μL와 76.5 nM 플루오레세인 용액 160 μL을 혼합하고, 37℃에서 10분 동안 가열하였다. 191.25 mM 2,2’-azobis (2-methylpropionamidine) dihydrochloride(AAPH) 용액 20 μL을 첨가한 후, 37℃에서 60분 동안 여기파장 485 nm와 방출파장 530 nm에서 형광도를 측정하였다. 표준시약으로 사용한 Trolox와 추출물의 곡선면적을 각각 측정하였으며, ORAC는 표준시약 농도와 곡선면적 간의 회귀곡선을 이용하여 nmol TE/mL로 표기하였다. 또한, 양성 대조군으로 아스코르브산 저장용액(0.5 mg/mL 증류수)을 80% 아세톤으로 농도별 희석한 후 사용하여 추출물의 ORAC와 비교하였다.
추출물의 CUPRAC는 Apak et al.(2004)의 방법을 변형하여 측정하였다. 추출물 또는 80% 아세톤 4 μL과 10 mM 염화제일구리 용액 50 μL, 7.5 mM 네오쿠프로인 용액 50 μL 및 1 M 초산암모늄 용액(pH 7.0) 50 μL을 혼합하고, 총 반응액이 200 μL이 되도록 증류수를 첨가한 후, 450 nm에서 흡광도를 측정하였다. Trolox를 표준시약으로 사용하여 표준곡선을 작성하였고, CUPRAC는 nmol TE/mL로 표기하였다. 또한, 양성 대조군으로 α-토코페롤 저장용액(10 mg/mL DMSO)을 80% 아세톤으로 농도별 희석한 후 사용하여 추출물의 CUPRAC와 비교하였다.
추출물의 총페놀 함량은 Singleton et al.(1999)의 방법을 변형하여 측정하였다. 추출물 또는 80% 아세톤 10 μL와 증류수 40 μL을 혼합하고 2 N 폴린-시오칼토 시약 10 μL를 첨가한 후, 실온에서 6분 방치하였다. 혼합용액에 15% 탄산나트륨 용액 48 μL과 증류수 132 μL을 첨가하고 실온에서 90분간 방치한 뒤, 760 nm에서 흡광도를 측정하였다. 갈산을 표준시약으로 사용하여 표준곡선을 작성하였고, 총페놀 함량은 mg 갈산 등가물(GAE)/g 건조중량으로 표기하였다.
추출물의 총플라보노이드 함량은 Liu et al.(2002)의 방법을 변형하여 측정하였다. 추출물 또는 80% 아세톤 20 μL과 증류수 100 μL을 혼합하고 5% 아질산나트륨 용액 6 μL을 첨가한 후, 실온에서 6분간 방치하였다. 혼합용액에 10% 염화알루미늄 용액 12 μL을 첨가하고 실온에서 5분간 방치한 뒤, 1 N 수산화나트륨 용액 40 μL과 혼합한 후 510 nm에서 흡광도를 측정하였다. 카테킨을 표준시약으로 사용하여 표준곡선을 작성하였고, 총플라보노이드 함량은 mg 카테킨 등가물(CE)/g 건조중량으로 표기하였다.
추출물의 리코펜과 베타-카로틴 함량은 Barros et al.(2007)의 방법에 따라 측정하였다. 건조된 시료에 아세톤:헥산(4:6) 용액을 첨가하고 15분간 교반 혼합한 후, 10,000×g에서 10분간 원심분리하여 상등액을 수거하고, 453, 505 및 663 nm 파장에서 흡광도를 측정하였다. 리코펜과 베타-카로틴 함량은 다음 식으로 각각 계산하였다: 리코펜 함량(mg/100 mL)=-0.0458×A663+0.372×A505-0.0806×A453; 베타-카로틴 함량(mg/100 mL)=0.216×A663-0.304×A505+0.452×A453. 리코펜과 베타-카로틴 함량은 mg/g 건조중량으로 표기하였다.
10% 우태아혈청과 1% 페니실린/스트렙토마이신이 포함된 DMEM 배지를 사용하여 RAW 264.7 세포(KCLB No. 40071, 한국세포주은행)를 37℃, 5% 이산화탄소 배양기(Heraeus BB15, Thermo Scientific, Waltham, MA, USA)에서 배양하였다. 배양된 세포를 24-well 플레이트에 well 당 1×105 세포수가 되도록 분주하고, 24시간 배양한 후, 추출물이 포함된 배지로 교체하고 2시간 전처리하였다. 염증을 유발하기 위해, 1 μg/mL 농도의 지질다당류(lipopolysaccharide, LPS)가 포함된 배지로 교체하고 24시간 배양하였다.
산화질소 농도는 Stuehr & Nathan(1989)의 방법을 변형하여 측정하였다. 배양한 후, 상등액 50 μL을 1% 술프아닐아미드 용액 50 μL 및 0.1% 나프틸에틸렌디아민 이수화염화물 용액 50 μL과 혼합하고 실온에서 10분간 방치한 후, 550 nm에서 흡광도를 측정하였다. 아질산 나트륨을 표준시약으로 사용하여 표준곡선을 작성하였고, 추출물의 LPS에 대한 염증 억제 효과는 산화질소 생성을 측정함으로써 조사하였다.
4. 통계 분석
추출물별 활성은 IBM SPSS 통계프로그램(version 25, IBM Corporation, Armonk, NY, USA)을 사용하여 일원 분산분석을 실시하여 조사하였고, 평균값의 차이는 Duncan 다중 범위 검증을 실시하여 p<0.05에서 유의성을 조사하였다. 또한 총페놀, 총플라보노이드 및 리코펜 함량, 항산화 활성 및 항염증 효능 간의 상관관계를 파악하기 위하여 상관분석을 실시하여 조사하였다.
III. 결과 및 고찰
1. 라디칼 소거활성
토마토추출물의 DPPH 라디칼 소거활성은 Fig. 1-A에 나타나 있다. DPPH 라디칼 소거활성은 캄파리, 방울>강원찰>대추방울>플럼>완숙토마토 순으로 높게 나타났다. 캄파리토마토의 소거활성은 방울토마토의 소거활성과 유의적 차이가 나타나지 않았으며(65.5 vs 61.8%), 완숙토마토의 소거활성(33.8%)에 비해 약 2배 높게 나타났다. 양성 대조군으로 사용한 α-토코페롤의 DPPH 라디칼 소거활성은 1, 5, 10, 25 및 50 μg/mL 농도에서 각각 13.0, 32.7, 54.1, 79.8 및 97.2%로 측정되었으며, 완숙토마토와 강원찰토마토의 소거활성은 각각 5와 10 μg/mL 농도의 α-토코페롤과 유사하게 나타났다. 기존 연구(Szabo et al. 2019)에서도 토마토 품종간 DPPH 라디칼 소거활성의 차이가 관찰되었고, 토마토 색깔별 DPPH 라디칼 소거활성은 붉은색>핑크색>노란색 순으로 높게 나타났다(Li et al. 2013). 본 연구에서 관찰된 방울토마토의 높은 DPPH 라디칼 소거활성은 일반토마토에 비해 방울토마토의 소거활성이 높다고 보고된 연구결과(Bhandari et al. 2016)와 일치하고 있다.
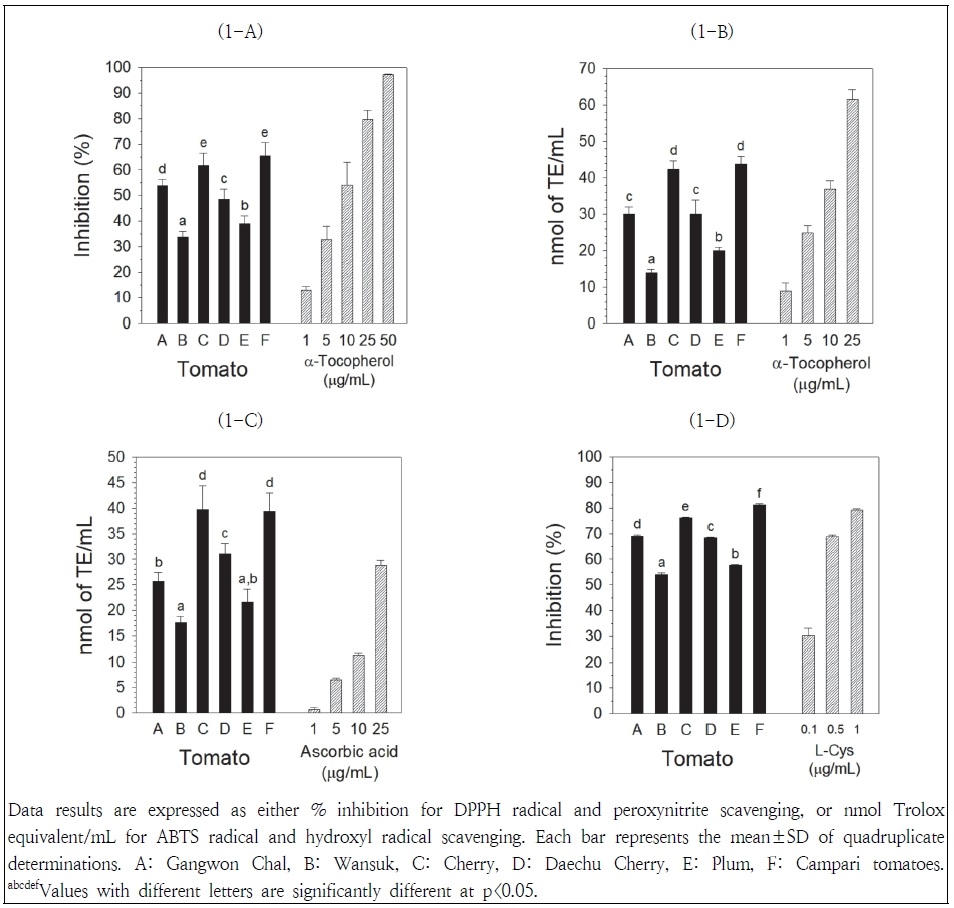
Scavenging activities obtained in the various tomato extracts: DPPH radical (1-A), ABTS radical (1-B), hydroxyl radical (1-C), and peroxynitrite (1-D).
토마토추출물의 ABTS 라디칼 소거활성은 Fig. 1-B에 나타나 있다. ABTS 라디칼 소거활성은 캄파리, 방울>강원찰, 대추방울>플럼>완숙토마토 순으로 높게 나타났다. 캄파리토마토의 소거활성은 방울토마토의 소거활성과 유의적 차이가 나타나지 않았으며(43.7 vs 42.3 nmol TE/mL), 완숙토마토의 소거활성(13.9 nmol TE/mL)에 비해 약 3배 높게 나타났다. 강원찰토마토의 소거활성은 대추방울토마토의 소거활성과 유의적 차이가 나타나지 않았다. 양성 대조군으로 사용한 α-토코페롤의 ABTS 라디칼 소거활성은 1, 5, 10 및 25 μg/mL 농도에서 각각 9.0, 24.8, 36.9 및 61.6 nmol TE/mL로 측정되었으며, 캄파리토마토와 방울토마토의 소거활성은 10 μg/mL 농도의 α-토코페롤에 비해 높게 나타났다. 녹숙기-채숙기-완숙기에 이르는 토마토 완숙과정 동안 숙성별 ABTS 라디칼 소거활성은 채색기>완숙기>녹숙기 순으로 높게 나타났다(Del Giudice et al. 2015). 본 연구의 결과는 토마토 품종간 ABTS 라디칼 소거활성의 차이가 나타났으며, 방울토마토가 일반토마토에 비해 ABTS 라디칼 소거활성이 높다고 보고된 연구결과(Bhandari et al. 2016)와 유사하였다.
히드록실 라디칼은 반응력이 높고, 반감기가 매우 짧으며, 지질, 단백질 및 DNA와 반응하여 비가역적 손상을 유발시키기 때문에 반응산소종 중에서 가장 독성이 높은 라디칼 중의 하나이다(Valko et al. 2007). 토마토추출물의 히드록실 라디칼 소거활성은 Fig. 1-C에 나타나 있다. 히드록실 라디칼 소거활성은 방울, 캄파리>대추방울>강원찰>플럼, 완숙토마토 순으로 높게 나타났다. 방울토마토의 소거활성은 캄파리토마토의 소거활성과 유의적 차이가 나타나지 않았으며(39.7 vs 39.5 nmol TE/mL), 완숙토마토의 소거활성(17.6 nmol TE/mL)에 비해 2배 이상 높게 나타났다. 플럼토마토의 소거활성(21.6 nmol TE/mL)과 완숙토마토의 소거활성 간에 유의적 차이가 나타나지 않았다. 양성 대조군으로 사용한 아스코르브산의 소거활성은 1, 5, 10 및 25 μg/mL 농도에서 각각 0.7, 6.5, 11.3 및 28.9 nmol TE/mL로 측정되었으며, 대추방울토마토의 소거활성(31.0 nmol TE/mL)은 25 μg/mL 농도의 아스코르브산의 소거활성과 유사하게 나타났다.
퍼옥시니트리트는 염증반응 동안 산화질소와 슈퍼옥시드 음이온이 반응하여 생성되는 반응질소종으로, DNA 절단과 산화, LDL 산화, 단백질 산화 등을 유발시켜 조직을 손상시키는 강력한 산화물질로 알려져 있다(Valko et al. 2007). 토마토추출물의 퍼옥시니트리트 소거활성은 Fig. 1-D에 나타나 있다. 퍼옥시니트리트 소거활성은 캄파리>방울>강원찰>대추방울>플럼>완숙토마토 순으로 높게 나타났다. 캄파리토마토의 소거활성(81.3%)은 완숙토마토의 소거활성(54.1%)에 비해 약 1.5배 높게 나타났다. 양성 대조군으로 사용한 시스테인의 퍼옥시니트리트 소거활성은 0.1, 0.5 및 1 μg/mL 농도에서 각각 30.2, 68.7 및 79.4%로 측정되었으며, 강원찰토마토와 대추방울토마토의 소거활성(69.1 및 68.4%)은 0.5 μg/mL 농도의 시스테인의 소거활성과 유사하게 나타났으며, 방울토마토와 캄파리토마토의 소거활성(76.1 및 81.3%)은 1 μg/mL 농도의 시스테인의 소거활성과 유사하게 나타났다.
2. ORAC
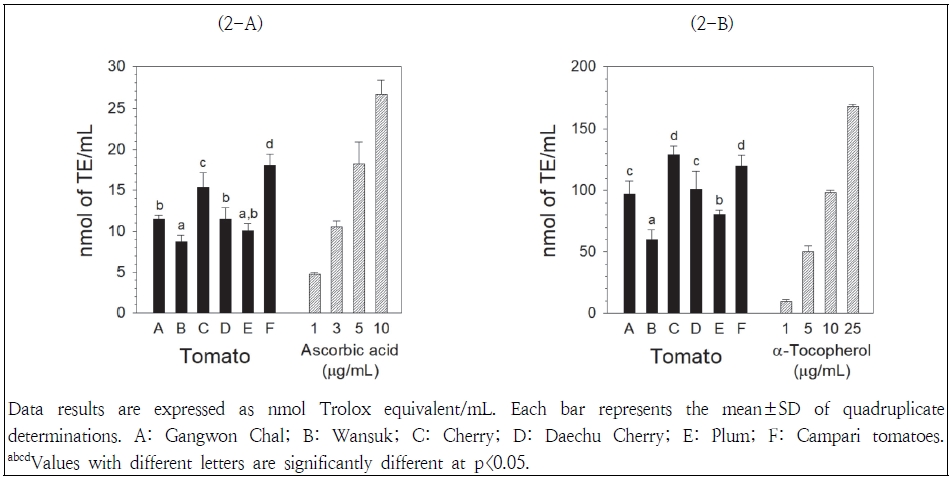
ORAC 분석법은 AAPH에 의해 생성된 퍼옥실 라디칼로 인한 플루오레세인의 산화적 분해(형광도 감소)로부터 추출물의 보호 정도를 측정하는 방법이다(Huang et al. 2002). 토마토추출물의 ORAC는 Fig. 2-A에 나타나 있다. ORAC는 캄파리>방울>강원찰, 대추방울>플럼, 완숙토마토 순으로 높게 나타났다. 캄파리토마토의 ORAC는 완숙토마토의 효능에 비해 약 2배 높게(18.0 vs 8.7 nmol TE/mL) 나타났으며, 플럼토마토의 효능(10.0 nmol TE/mL)은 완숙토마토의 효능과 유사하게 나타났다. 양성 대조군으로 사용한 아스코르브산의 ORAC는 1, 3, 5 및 10 μg/mL 농도에서 각각 4.8, 10.5, 18.2 및 26.6 nmol TE/mL로 측정되었으며, 캄파리토마토의 ORAC는 5 μg/mL 농도의 아스코르브산의 효능과 유사하게 나타났다.
3. CUPRAC
CUPRAC 분석법은 구리(II)-네오쿠프로인 용액을 산화제로서 사용하여 추출물의 구리이온에 대한 환원력을 측정하는 방법으로, 구리(II)이온이 철(III)이온에 비해 산화환원 화학반응에서 화학동력학이 보다 빠르게 이루어지기 때문에 철이온 환원력(ferric reducing antioxidant power, FRAP)에 비해 이점이 있다고 알려져 있다(Apak et al. 2004). 토마토추출물의 CUPRAC는 Fig. 2-B에 나타나 있다. CUPRAC는 방울, 캄파리>대추방울, 강원찰>플럼>완숙토마토 순으로 높게 나타났다. 방울토마토와 캄파리토마토의 환원력 간에 유의적인 차이가 없었으며(129.2 vs 119.6 nmol TE/mL, p>0.05), 완숙토마토의 환원력(59.8 nmol TE/mL)에 비해 약 2배 높게 나타났다. 양성 대조군으로 사용한 α-토코페롤의 환원력은 1, 5, 10 및 25 μg/mL 농도에서 각각 9.7, 49.9, 99.2 및 168.5 nmol TE/mL로 측정되었으며, 대추방울토마토와 강원찰토마토의 환원력(101.1 및 96.8 nmol TE/mL)은 10 μg/mL 농도의 α-토코페롤 환원력과 유사하게 나타났다. 토마토 완숙과정 동안 숙성별 철이온 환원력은 채색기>완숙기>녹숙기 순으로 높게 나타났다(Del Giudice et al. 2015). Bhandari et al.(2016)은 일반토마토 품종간 철이온 환원력의 차이는 관찰되지 않았으나, 방울토마토가 일반토마토에 비해 철이온 환원력이 높게 나타났다고 보고한 바 있어, 본 연구에서 관찰된 방울토마토의 높은 환원력 결과와 유사한 경향을 나타내었다.
4. 총페놀 및 총플라보노이드 함량
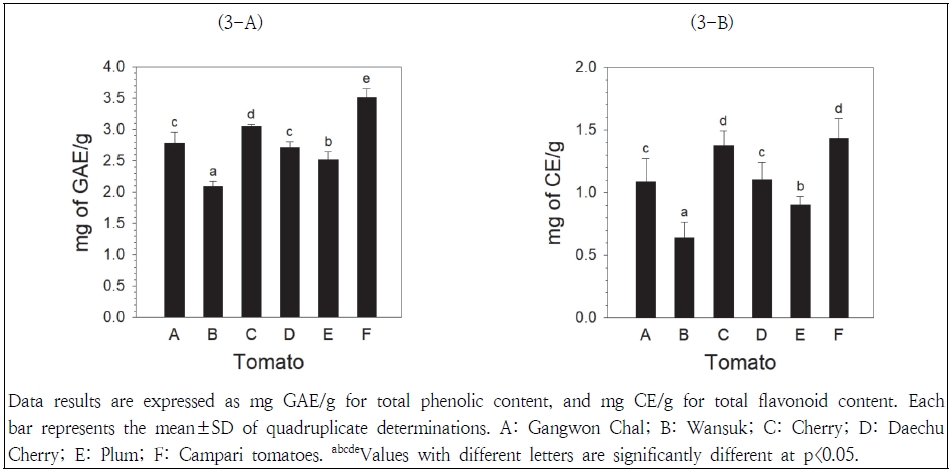
토마토추출물의 총페놀 함량은 Fig. 3-A에 나타나 있다. 총페놀 함량은 캄파리>방울>강원찰, 대추방울>플럼>완숙토마토 순으로 높게 나타났다. 캄파리토마토의 총페놀 함량은 완숙토마토에 비해 약 1.5배(3.51 vs 2.09 mg GAE/g) 높게 나타났으며, 강원찰토마토와 대추방울토마토 간에 총페놀 함량의 차이는 나타나지 않았다. 본 연구에서 조사된 토마토의 총페놀 함량은 Jez et al.(2018)이 보고한 토마토 퓨레의 총페놀 함량(2.25∼3.48 mg GAE/g)과 유사하게 관찰되었다.
토마토추출물의 총플라보노이드 함량은 Fig. 3-B에 나타나 있다. 총플라보노이드 함량은 캄파리, 방울>대추방울, 강원찰>플럼>완숙토마토 순으로 높게 나타났다. 캄파리토마토와 방울토마토의 총플라보노이드 함량 간에 유의적 차이가 없었으며(1.43 vs 1.37 mg CE/g), 완숙토마토의 총플라보노이드 함량(0.64 mg CE/g)에 비해 약 2배 이상 높게 나타났다. 총페놀 함량 결과와 유사하게, 강원찰토마토와 대추방울토마토 간에 총플라보노이드 함량의 차이는 나타나지 않았다.
토마토 완숙과정 동안 채색기에서 완숙기로 전환됨에 따라 총페놀과 총카로티노이드 함량이 감소하고, 완숙기의 총페놀 함량이 녹숙기에 비해 낮은 수준이었으나(Del Giudice et al. 2015), Duma et al.(2018)은 완숙기의 총페놀 및 총플라보노이드 함량이 녹숙기에 비해 높다고 보고하였다. 본 연구에서는 모두 채색기를 거쳐 붉은색을 띠는 완숙기에 도달한 토마토들이 사용되었으나, 그중에서 완숙단계가 가장 오래 진행된 완숙토마토의 총페놀과 총플라보노이드 함량이 가장 낮게 관찰되었다. 방울토마토와 대추방울토마토의 총페놀과 총플라보노이드 함량이 높게 나타난 본 연구 결과는 방울토마토가 일반 토마토에 비해 총페놀과 총플라보노이드함량이 높게 나타났다고 발표된 연구결과(Bhandari et al. 2016)와 일치하고 있다. 체리 형태의 토마토가 플럼 형태의 토마토에 비해 총페놀과 총플라보노이드 함량이 높았으며(Duma et al. 2018), 본 연구에서도 방울토마토가 플럼토마토에 비해 총페놀과 총플라보노이드 함량이 높게 관찰되었다.
5. 리코펜 및 베타-카로틴 함량
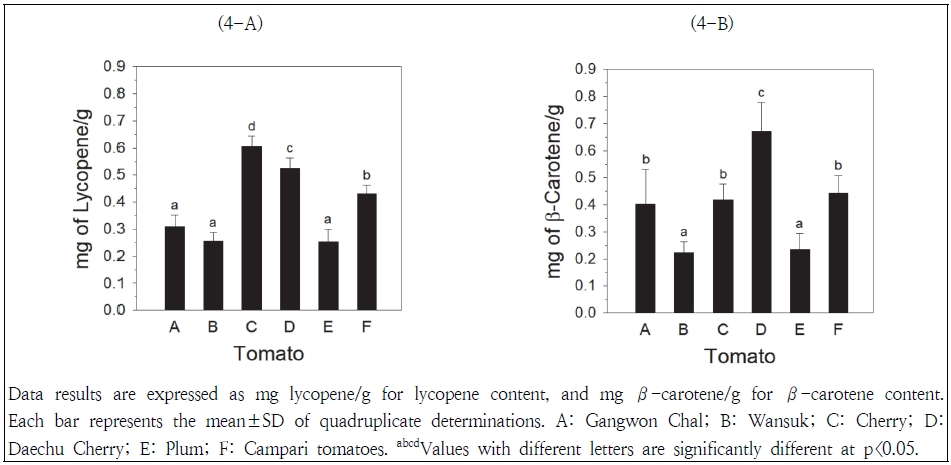
토마토추출물의 리코펜 함량은 Fig. 4-A에 나타나 있다. 리코펜 함량은 방울>대추방울>캄파리>강원찰, 완숙, 플럼토마토 순으로 높게 나타났다. 방울토마토의 리코펜 함량(0.61 mg/g)이 대추방울토마토와 캄파리토마토의 함량(0.52 및 0.43 mg/g) 보다 높았으며, 완숙토마토와 플럼토마토의 함량(0.26 및 0.25 mg/g)에 비해 2배 넘게 높게 나타났다. 강원찰토마토의 리코펜 함량(0.31 mg/g)은 완숙토마토와 플럼토마토에 비해 높게 나타났으나 유의적 차이는 관찰되지 않았다(p>0.05). Duma et al.(2018)은 체리 형태의 토마토가 플럼 형태의 토마토에 비해 리코펜 함량이 높다고 보고한 바 있으며, 본 연구에서도 방울토마토가 플럼토마토에 비해 리코펜 함량이 높게 관찰되었다.
토마토추출물의 베타-카로틴 함량은 Fig. 4-B에 나타나 있다. 베타-카로틴 함량은 대추방울>캄파리, 방울, 강원찰>플럼, 완숙토마토 순으로 높게 나타났다. 대추방울토마토의 베타-카로틴 함량(0.67 mg/g)이 가장 높았으며, 플럼토마토와 완숙토마토의 함량(0.24 및 0.22 mg/g)이 가장 낮게 나타났다. 캄파리토마토, 방울토마토 및 강원찰토마토 간 베타-카로틴 함량의 차이는 관찰되지 않았다. 본 연구에서 측정된 토마토들의 리코펜과 베타-카로틴 함량은 기존 연구(Bhandari et al. 2016)에서 보고된 함량들과 유사한 수준이었다. 본 연구에서 관찰된 방울토마토의 높은 리코펜 및 베타-카로틴 함량은 방울토마토가 일반토마토에 비해 리코펜과 베타-카로틴 함량이 높게 나타난 연구결과(Bhandari et al. 2016)와 일치하고 있다.
6. 염증 억제효과
염증은 세균 또는 바이러스 감염, 국소적 자극 등에 의해 유발된 조직 손상에 대한 생리적 방어 반응이다. 산화질소 합성효소에 의해 생성되는 산화질소는 염증 반응에서 숙주의 항미생물 기전을 매개하는 생물학적 활성이 높은 반응질소종이다(Moncada 1999). 그러나 체내에서 산화질소의 지속적인 과다 생성은 슈퍼옥시드와 같은 반응산소종과 반응하여 반응질소산소종을 형성함으로써 염증을 유발하는 것으로 알려져 있다(Zamora et al. 2000). 세균 LPS에 의해 활성화된 대식세포는 과다한 산화질소를 생성하여 염증이 유발된다는 연구결과(Stuehr & Marletta 1985)는 천연물추출물의 항염증 연구 모델로 사용되고 있다.
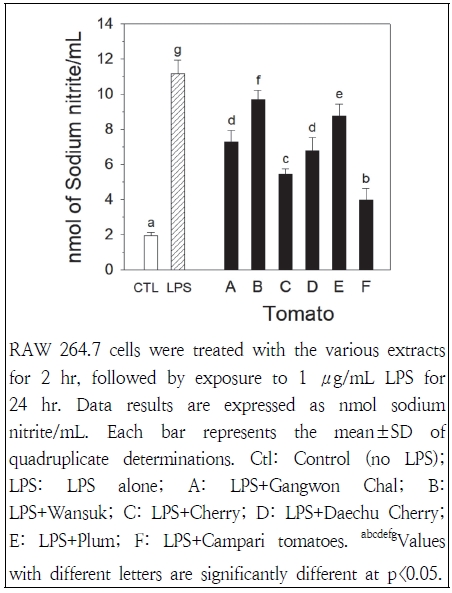
토마토추출물이 LPS로 유발된 대식세포에서 산화질소 생성에 미치는 효과는 Fig. 5에 나타나 있다. LPS(1 μg/mL) 처리시 생성된 산화질소 농도가 LPS 무처리에 비해 5배 이상(11.2 vs 2.0 nmol/mL) 증가하여 RAW 264.7 세포에서 LPS에 의한 염증 유발을 확인하였다. 토마토추출물 처리에 따라 LPS에 의해 유도되어 생성된 산화질소 농도는 완숙>플럼>강원찰, 대추방울>방울>캄파리토마토 순으로 높게 나타났다. 캄파리토마토와 완숙토마토 처리에 의해 생성된 산화질소 농도는 각각 3.98 및 9.68 nmol/mL로 측정되어 이들 토마토의 염증 억제효과는 각각 78.1 및 16.2%로 나타났다. 방울토마토는 대추방울토마토와 강원찰토마토에 비해 LPS에 의해 유도된 산화질소 농도가 낮게(5.45 vs 6.78 및 7.29 nmol/mL) 나타나, 방울토마토의 염증 억제효과가 이들 토마토에 비해 높게 (62.1 vs 47.6 및 42.1%) 나타났다.
본 연구에서 관찰된 토마토추출물의 항염증 효과와 유사하게, 흰쥐를 이용한 연구에서 자주색 토마토추출물 투여는 카라기난(carrageenan)으로 유도된 발 부종을 용량 의존적으로 감소시켜 토마토추출물의 항염증 효과를 나타냈으며(Li et al. 2014), 대식세포를 이용한 연구에서 흑색 방울토마토 주스는 농도 의존적으로 LPS에 의해 유도된 대식세포의 산화질소 합성을 억제시켰다(Jung et al. 2018).
7. 총페놀 함량, 총플라보노이드 함량, 리코펜 함량, 베타-카로틴 함량, 항산화 활성 및 항염증 효능 간의 상관관계
페놀 화합물, 리코펜 및 베타-카로틴 함량과 항산화 활성 그리고 항염증 효능 간의 상관관계를 분석한 결과는 Table 1에 나타나 있다. ORAC, 히드록실 라디칼 소거활성, 퍼옥시니트리트 소거활성 및 CUPRAC와 총페놀 함량 또는 총플라보노이드 함량 간에 유의적으로(p<0.01) 높은(r>0.7) 상관관계가 나타났다. ORAC, 히드록실 라디칼 소거활성, 퍼옥시니트리트 소거활성 및 CUPRAC와 리코펜 함량 간에도 유의적(p<0.01) 상관관계가 나타났으나, ORAC와 베타-카로틴 함량 간에는 유의적 상관관계가 관찰되지 않았다(p>0.05). 총페놀 함량과 리코펜 함량 간에 유의적인(p<0.01) 상관관계가 나타났으나, 총페놀 함량과 베타-카로틴 함량 간에는 유의적 상관관계가 관찰되지 않았다(p>0.05). LPS로 유발된 산화질소 생성과 총페놀 함량, 총플라보노이드 함량 또는 리코펜 함량 간에 유의적으로(p<0.01) 높은 음의 상관관계가 나타났으나, LPS로 유발된 산화질소 생성과 베타-카로틴 함량 간에는 유의적(p<0.05)이지만 중간 정도의(r=-0.495) 상관관계가 나타났다. ORAC, 히드록실 라디칼 소거활성, 퍼옥시니트리트 소거활성 및 CUPRAC와 LPS로 유발된 산화질소 생성 간에 유의적으로(p<0.01) 높은(r<-0.8) 음의 상관관계가 나타났다.

Correlations between phytochemical contents, antioxidant capacities, and anti-inflammatory activity of tomato extracts
DPPH 소거활성과 ABTS 소거활성이 총페놀 함량 또는 리코펜 함량과 유의적으로(p<0.01) 높은 상관관계를 나타낸 본 연구결과(data not shown)와는 상이하게, Szabo et al.(2019)은 DPPH 소거활성과 총페놀 함량 간 유의적인 상관관계는 관찰되지 않았다고 보고한 바 있고, Robaszkiewicz et al.(2010)은 버섯추출물을 이용한 항산화 연구에서 총페놀 및 총플라보노이드 함량과 ABTS 소거활성 또는 환원력 간 상관관계가 높았지만, 리코펜 및 베타-카로틴 함량과 ABTS 소거활성 또는 환원력 간에는 유의적인 상관관계가 관찰되지 않았다고 보고한 바 있다. 본 연구에서 관찰된 라디칼 소거활성, ORAC 및 CUPRAC 등의 항산화 활성과 총페놀 함량 또는 리코펜 함량 간의 높은 상관관계는 기존에 발표된 연구결과(Li et al. 2013; Bhandari et al. 2016; Stinco et al. 2016)와 일치하고 있다.
IV. 요약 및 결론
본 연구에서는 시중에 유통되고 있는 6종(강원찰, 완숙, 방울, 대추방울, 플럼 및 캄파리) 토마토 아세톤추출물의 항산화 활성과 항염증 효능을 비교ㆍ조사하였다. DPPH 라디칼, ABTS 라디칼 및 히드록실 라디칼 소거활성과 구리이온 환원력은 캄파리토마토와 방울토마토가 가장 높았고, 강원찰, 대추방울, 플럼 그리고 완숙토마토 순으로 조사되었다. 퍼옥시니트리트 소거활성, 산소라디칼 흡수 효능 및 총페놀 함량은 캄파리토마토가 가장 높았고, 방울, 강원찰, 대추방울, 플럼 그리고 완숙토마토 순으로 조사되었다. 리코펜 함량은 방울토마토가 가장 높았고, 대추방울, 캄파리토마토 순으로 높았으며, 강원찰, 플럼 그리고 완숙토마토는 가장 낮았다. LPS에 의해 유도된 RAW 264.7 세포의 산화질소 생성은 캄파리토마토에 의해 가장 많이 억제되었으며, 방울, 대추방울, 강원찰, 플럼 그리고 완숙토마토 순으로 조사되었다. 히드록실 라디칼과 퍼옥시니트리트 소거활성, 산소라디칼 흡수 효능 및 구리이온 환원력 등의 항산화 활성은 총페놀 함량 또는 리코펜 함량과 높은 상관관계를 나타냈다. 항염증 효능과 항산화 활성, 총페놀 함량 또는 리코펜 함량 간의 상관성도 높게 나타났다. 따라서 본 연구 결과들은 캄파리토마토와 방울토마토의 항산화 활성과 항염증 효과가 높음을 나타내며, 이러한 효과는 높은 페놀 화합물 함량과 리코펜 함량에 기인한 것으로 사료된다.
Acknowledgments
This research was supported by the Sangji University Research Fund, 2019
References
- Agarwal S, Rao AV(2000) Tomato lycopene and its role in human health and chronic diseases. Can Med Assoc J 163(6), 739-744
-
Ames BN, Shigenaga MK, Hagen TM(1993) Oxidants, antioxidants, and the degenerative diseases of aging. Proc Natl Acad Sci USA 90(17), 7915-7922.
[https://doi.org/10.1073/pnas.90.17.7915]

-
Apak R, Guclu K, Ozyurek M, Karademir SE(2004) Novel total antioxidant capacity index for dietary polyphenols and vitamins C and E, using their cupric ion reducing capability in the presence of neocuproine: CUPRAC method. J Agric Food Chem 52(26), 7970-7981.
[https://doi.org/10.1021/jf048741x]

-
Barros L, Ferreira MJ, Queiros B, Ferreira ICFR, Baptista P(2007) Total phenols, ascorbic acid, β-carotene and lycopene in Portuguese wild edible mushrooms and their antioxidant activities. Food Chem 103(2), 413-419.
[https://doi.org/10.1016/j.foodchem.2006.07.038]

-
Bhandari SR, Chae Y, Lee JG(2016) Assessment of phytochemicals, quality attributes, and antioxidant activities in commercial tomato cultivars. Korean J Hortic Sci Technol 34(5), 677-691.
[https://doi.org/10.12972/kjhst.20160071]

-
Clinton SK(1998) Lycopene: chemistry, biology, and implications for human health and disease. Nutr Rev 56(2), 35-51.
[https://doi.org/10.1111/j.1753-4887.1998.tb01691.x]

-
Del Giudice R, Raiola A, Tenore GC, Frusciante L, Barone A, Monti DM, Rigano MM(2015) Antioxidant bioactive compounds in tomato fruits at different ripening stages and their effects on normal and cancer cells. J Funct Foods 18(Part A), 83-94.
[https://doi.org/10.1016/j.jff.2015.06.060]

-
Duma M, Alsina I, Dubova L, Erdberga I(2018) Bioactive compounds in tomatoes at different stages of maturity. Proc Latvian Acad Sci 72(2), 85-90.
[https://doi.org/10.2478/prolas-2018-0014]

-
Erel O(2004) A novel automated direct measurement method for total antioxidant capacity using a new generation, more stable ABTS radical cation. Clin Biochem 37(4), 277-285.
[https://doi.org/10.1016/j.clinbiochem.2003.11.015]

-
George S, Tourniaire F, Gautier H, Goupy P, Rock E, Caris-Veyrat C(2011) Changes in the contents of carotenoids, phenolic compounds and vitamin C during technical processing and lyophilisation of red and yellow tomatoes. Food Chem 124(4), 1603-1611.
[https://doi.org/10.1016/j.foodchem.2010.08.024]

-
Huang D, Ou B, Hampsch-Woodill M, Flanagan JA, Prior RL(2002) High-throughput assay of oxygen radical absorbance capacity (ORAC) using a multichannel liquid handling system coupled with a microplate fluorescence reader in 96-well format. J Agric Food Chem 50(16), 4437-4444.
[https://doi.org/10.1021/jf0201529]

-
Jez M, Wiczkowski W, Zielinska D, Bialobrzewski I, Blaszczak W(2018) The impact of high pressure processing on the phenolic profile, hydrophilic antioxidant and reducing capacity of puree obtained from commercial tomato varieties. Food Chem 261, 201-209.
[https://doi.org/10.1016/j.foodchem.2018.04.060]

- Jung KI, Ha N, Choi YJ(2018) Anti-inflammatory effects of black cherry tomato (Lycopersicon esculentum M.) juice on LPS-induced RAW 264.7 cells. J Life Sci 28(5), 569-576.
-
Kooy NW, Royall JA, Ischiropoulos H(1997) Oxidation of 2’,7’-dichlorofluorescin by peroxynitrite. Free Radic Res 27(3), 245-254.
[https://doi.org/10.3109/10715769709065763]

-
Kotikova Z, Lachman J, Hejtmankova A, Hejtmankova K(2011) Determination of antioxidant activity and antioxidant content in tomato varieties and evaluation of mutual interactions between antioxidants. LWT-Food Sci Technol 44(8), 1703-1710.
[https://doi.org/10.1016/j.lwt.2011.03.015]

-
Krinsky NI(1989) Antioxidant functions of carotenoids. Free Radic Biol Med 7(6), 617-635.
[https://doi.org/10.1016/0891-5849(89)90143-3]

-
Kubota C, Kroggel M, Torabi M, Dietrich KA, Kim HJ, Fonseca J, Thomson CA(2012) Changes in selected quality attributes of greenhouse tomato fruit as affected by pre- and postharvest environmental conditions in year-round production. Hort Sci 47(12), 1698-1704.
[https://doi.org/10.21273/HORTSCI.47.12.1698]

-
Lee J, Koo N, Min DB(2004) Reactive oxygen species, aging, and antioxidative nutraceuticals. Compr Rev Food Sci Food Saf 3(1), 21-33.
[https://doi.org/10.1111/j.1541-4337.2004.tb00058.x]

-
Li H, Deng Z, Liu R, Loewen S, Tsao R(2013) Carotenoid compositions of coloured tomato cultivars and contribution to antioxidant activities and protection against H2O2-nduced cell death in H9c2. Food Chem 136(2), 878-888.
[https://doi.org/10.1016/j.foodchem.2012.08.020]

-
Li H, Deng Z, Liu R, Loewen S, Tsao R(2014) Bioaccessibility, in vitro antioxidant activities and in vivo anti-inflammatory activities of a purple tomato (Solanum lycopersicum L.). Food Chem 159, 353-360.
[https://doi.org/10.1016/j.foodchem.2014.03.023]

-
Liu M, Li XQ, Weber C, Lee CY, Brown J, Liu RH(2002) Antioxidant and antiproliferative activities of raspberries. J Agric Food Chem 50(10), 2926-2930.
[https://doi.org/10.1021/jf0111209]

-
Moncada S(1999) Nitric oxide: discovery and impact on clinical medicine. J R Soc Med 92(4), 164-169.
[https://doi.org/10.1177/014107689909200402]

-
Moore J, Yin JJ, Yu L(2006) Novel fluorometric assay for hydroxyl radical scavenging capacity (HOSC) estimation. J Agric Food Chem 54(3), 617-626.
[https://doi.org/10.1021/jf052555p]

-
Pandey KB, Rizvi SI(2009) Plant polyphenols as dietary antioxidants in human health and disease. Oxid Med Cell Longev 2(5), 270-278.
[https://doi.org/10.4161/oxim.2.5.9498]

-
Pinela J, Barros L, Carvalho AM, Ferreira ICFR(2012) Nutritional composition and antioxidant activity of four tomato (Lycopersicon esculentum L.) farmer’ varieties in Northeastern Portugal homegardens. Food Chem Toxicol 50(3-4), 829-834.
[https://doi.org/10.1016/j.fct.2011.11.045]

-
Robaszkiewicz A, Bartosz G, Lawrynowicz M, Soszynski M(2010) The role of polyphenols, β-carotene, and lycopene in the antioxidative action of the exracts of dried, edible mushrooms. J Nutr Metab 2010(11), 173274.
[https://doi.org/10.1155/2010/173274]

-
Scherer R, Godoy HT(2009) Antioxidant activity index (AAI) by the 2,2-diphenyl-1-picrylhydrazyl method. Food Chem 112(3), 654-658.
[https://doi.org/10.1016/j.foodchem.2008.06.026]

-
Shen YC, Chen SL, Wang CK(2007) Contribution of tomato phenolics to antioxidation and down-regulation of blood lipids. J Agric Food Chem 55(16), 6475-6481.
[https://doi.org/10.1021/jf070799z]

-
Silaste ML, Alfthan G, Aro A, Kesaniemi YA, Horkko S(2007) Tomato juice decreases LDL cholesterol levels and increases LDL resistance to oxidation. Br J Nutr 98(6), 1251-1258.
[https://doi.org/10.1017/S0007114507787445]

-
Singleton VL, Orthofer R, Lamuela-Raventos RM(1999) Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin-Ciocalteu reagent. Methods Enzymol 299, 152-178.
[https://doi.org/10.1016/S0076-6879(99)99017-1]

-
Stinco CM, Heredia FJ, Vicario IM, Melendez-artinez AJ(2016) In vitro antioxidant capacity of tomato products: relationships with their lycopene, phytoene, phytofluene and alpha-ocopherol contents, evaluation of interactions and correlation with reflectance measurements. LWT-Food Sci Tech 65(2), 718-724.
[https://doi.org/10.1016/j.lwt.2015.08.068]

-
Stuehr DJ, Marletta MA(1985) Mammalian nitrate biosynthesis: mouse macrophages produce nitrite and nitrate in response to Escherichia coli lipopolysaccharide. Proc Nat Acad Sci USA 82(22), 7738-7742.
[https://doi.org/10.1073/pnas.82.22.7738]

-
Stuehr DJ, Nathan CF(1989) Nitric oxide: a macrophage product responsible for cytostasis and respiratory inhibition in tumor target cells. J Exp Med 169(5), 1543-1555.
[https://doi.org/10.1084/jem.169.5.1543]

-
Szabo K, Dulf FV, Diaconeasa Z, Vodnar DC(2019) Antimicrobial and antioxidant properties of tomato processing byproducts and their correlation with the biochemical composition. LWT-Food Sci Tech 116, 108558.
[https://doi.org/10.1016/j.lwt.2019.108558]

-
Valko M, Leibfritz D, Moncol J, Cronin MTD, Mazur M, Telser J(2007) Free radicals and antioxidants in normal physiological functions and human disease. Int J Biochem Cell Biol 39(1), 44-84.
[https://doi.org/10.1016/j.biocel.2006.07.001]

-
Zamora R, Vodovotz Y, Billiar TR(2000) Inducible nitric oxide synthase and inflammatory diseases. Mol Med 6(5), 347-373
[https://doi.org/10.1007/BF03401781]

-
Zhang YJ, Gan RY, Li S, Zhou Y, Li AN, Xu DP, Li HB(2015) Antioxidant phytochemicals for the prevention and treatment of chronic diseases. Molecules 20(12), 21138-21156.
[https://doi.org/10.3390/molecules201219753]