지역 농산물의 항산화 및 NO 생성 효과
 ; Jeong Yeon Im
; Jeong Yeon Im ; Hwal Choi
; Hwal Choi ; Un Yul Jeong
; Un Yul Jeong ; Ji Su Kim
; Ji Su Kim ; Jieun Jung
; Jieun Jung ; Jeong-Sook Choe1)
; Jeong-Sook Choe1) ; Sung Hyen Lee†, 1)
; Sung Hyen Lee†, 1)
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study was conducted to evaluate the antioxidant and nitric oxide (NO) generating effects of local agricultural products commonly used as traditional medicines. The antioxidant activity was measured by the DPPH and ABTS radical scavenging activities and total polyphenol (TP) concentrations in the 70% ethanol extracts of the above products. The Pueraria montana var. lobate extracts showed the highest DPPH and ABTS radical scavenging activities, with a TP content of 1,000 μg/mL. Among the stems and roots, the extracts of Oryza sativa showed the highest DPPH radical scavenging activity and TP content of 1,000 μg/mL. The cell viability and NO production were also analyzed to evaluate their possible immune-stimulating effects. The cell viability of RAW 264.7 macrophages was more than 100% in all the extracts compared to the media control group, at less than 500 μg/mL, indicating that these extracts are non-toxic to the cells. An evaluation of the NO production activity of the macrophages showed that the extracts increased the NO content in a dose-dependent manner. Allium hookeri, Oryza sativa, and Zingiber officinale Rosc extracts showed the highest production of NO content. Thus, P. montana var. lobate and O. sativa with high antioxidant effects and A. hookeri, O. sativa, and Z. officinale Rosc with high NO generating effects may be suitable for use as good functional foods.
Keywords:
local agricultural product, antioxidant, NO production, evaluationⅠ. 서론
코로나 바이러스 감염증(COVID-19)의 장기화로 건강과 면역의 중요성이 대두되고 있다. 바이러스 감염의 명확한 원인이나 치료제가 없는 상황에서 질병 예방과 개선을 위해 항산화 및 면역 증진 효과를 가진 기능성 식품 소재와 다양한 제품 개발 연구가 진행되고 있다(Jeong et al. 2019). 면역 조절제는 면역 체계를 조절하거나 정상화하는 데 도움이 되는 물질로, 면역 체계를 조절하거나 정상화하는 데 도움을 준다. 면역 조절제는 HIV/AIDS, 알레르기 및 암 환자와 같이 면역 체계가 약한 개인의 면역 반응을 향상시킬 수 있다고 보고되었다(Abbas et al. 2018). 또한 면역조절제는 자가면역질환 환자의 과민면역반응을 정상화하는 데 도움이 되고, 일부 식품 및 식물 재료는 면역 체계 기능의 조절과 활성화에 영향을 줄 수 있는 것으로 밝혀졌다. 많은 소비자들이 전통의학에 기반한 ‘자연으로의 회귀’에 관심을 갖고 있으며, 전통의학이 현대의학에 비해 상대적으로 부작용이 적은 것으로 보고하였다(Tanti et al. 2021).
본 연구에서는 지역 기능성 농산물로서 전통의학 서적에 보고된 총 16종의 소재를 선정하고 부위별로 생리활성을 평가하였다. 편의상 부위를 3개로 나누었는데, 줄기와 뿌리, 껍질, 잎과 열매로 분류하였다. 줄기와 뿌리로 감초, 당귀, 백복령, 칡, 삼채, 옥수수속대의 6종을 선정하였다. 껍질 소재 중에서는 귤피, 당귀, 두충 및 흑미 호분층의 4종을 선정하였다. 그리고 잎과 열매에서는 연잎, 솔잎, 녹차, 삼백초, 생강잎, 치자를 포함한 6종을 사용하였다.
감초(Glycyrrhiza uralensis)는 쌍떡잎 식물 콩과에 속하는 다년생 초본식물로 한국, 중국, 일본 등지에서 한약 재료로 널리 사용되고 있다(Fukai et al. 2003). 우리나라에서는 전북 익산에서 주로 생산되는데, 감초의 주요 생리 활성 성분인 플라보노이드는 항산화 활성을 통하여 면역 증진 작용을 나타내는 것으로 알려져 있다(Pastorino et al. 2018).
당귀(Angelica gigas)는 동양권에서 널리 쓰여지는 식물 중의 하나로, 우리나라에서는 강원도 평창 및 홍천, 경북 봉화, 울진에서 주로 재배되고 있으며, 전통적으로 빈혈 치료제와 진정제 및 강장제로 사용되었다. 최근 연구에서는 당귀가 알레르기성 염증에 치료 효과가 있다고 보고되었다(Ji et al. 2021).
백복령(Wolfiporia extensa)은 구멍쟁이 버섯과에 속하며 진균으로 강원도 영월군에서 많이 생산되고 항암 및 항염증 활성이 보고되었다(Jeong et al. 2010).
칡(Pueraria montana var. lobata)은 콩과에 속하는 다년생 덩굴성 관목으로 우리나라에서는 경남 거창에서 주로 생산되고 있으며, 동남아시아와 세계 각지에서 산과 들에 자생하고 있다(Liu et al. 2021).
삼채(Allium hookeri)는 파속 식물로 히말라야 산맥 해발 1,400~4,200미터 이상의 초원지대에서 재배되었으나, 이제 전북 순창, 충북 진천 등 우리나라 전역에서 널리 재배되고 있다. 삼채는 단백질, 당, 섬유소, ascorbic acid, phytosterol, total phenol 등이 양파보다 많이 함유하고 있다(Kim et al. 2012). 또한 Allium 속 식물의 주성분인 함황화합물은 항산화, 항염 및 혈액응고 억제 효과가 우수한 것으로 알려져 있다(Choi et al. 2021).
옥수수(Zea mays)는 세계 3대 작물로서 식의약품으로 활용되고 있는데, 강원도 평창에서 많은 양이 재배되고 있다. 옥수수종실 탈립 후 부산물로 얻어지는 속대(cob)에는 hemicellulose와 cellulose와 lignin이 풍부하게 함유되어 있고, 우리나라 민간요법으로 속대를 끓인 물을 잇몸염증 치료에 사용하였다. 이는 속대에 함유된 phytosterol이 잇몸질환 예방과 치료에 효과가 있기 때문으로 해석되었다(Kim et al. 2020).
제주도가 주요 생산지인 감귤의 껍질인 귤피(Citrus reticulata)는 기능성 물질을 많이 포함하여 차나 의학용 소재로서 널리 이용되어 왔다. 귤피는 비타민 C 이외에도 여러 생리활성 물질들이 포함되어 있고 다양한 기능성이 보고되었다(Yang et al. 2004).
뽕나무(Mori cortex)의 껍질인 상백피는 경북 영천에서 많이 재배되고 있는데, 해열, 항경련, 항알레르기. 항염증과 더불어 이뇨 촉진 등의 효과가 있는 것으로 보고되었다(Jang et al. 2015).
두충은 두충나무과에 속한 낙엽교목인 두충(Eucommia ulmoides)의 나무껍질을 건조한 것으로, 지리산에서 생산된 것이 많이 유통되고 있으며, 항염증, 항산화, 진통 완화 등의 효능을 가지고 있어 고혈압, 요통, 관절통 및 관절염 등에 사용되고 있다(Heo et al. 2019).
흑미(Oryza sativa)는 전국의 40% 이상이 진도에서 생산 및 유통되고 있고 대표적인 유색미이면서 특색 있는 향미를 갖고 있다. 감마 오리자놀, 폴리페놀, 플라보노이드, 안토시아닌 등의 다양한 기능성 성분을 함유하고, 특히 흑미 호분층에 안토시아닌 성분을 많이 함유하고 있고 갱년기 증상 개선 및 우수한 면역 증진 효과가 보고되었다(Lee et al. 2021).
연잎(Nelumbo nucifera)은 부엽식물로 온대 지역이나 열대 지역에서 자생하고, 우리나라 전역에서 볼 수 있지만 강원도 홍천 지역에서 많이 생산되고 있다. 연잎은 예로부터 우리나라를 포함한 동아시아에서 식품 재료 또는 민간 치료제로 널리 사용되고 있다. 식용으로 자주 사용되는 연잎은 항균, 항산화 및 항비만 등의 효과가 우수한 것으로 보고되었다(Yang et al. 2007).
솔잎(Ponus sylvestris)은 노화성 만성질환인 고혈압, 신경통, 동맥경화증 등의 예방 및 치료에 효과가 있다고 보고되었는데 경북 영천에서 많이 재배되고 있다(Jin et al. 2006). 솔잎에는 항산화 및 항염 효과가 우수한 플라보노이드류인 Kaempferol, Querecertin 등이 풍부하게 함유되어 있다(Kim & Shin 2005).
녹차(Camellia sinensis L.)는 동남 아시아에서 많이 섭취되고 있는데 우리나라에서는 경남 하동에서 널리 재배되고 있으며 건강에 대한 관심이 높아짐에 따라 소비도 증가하고 있다. 특히 녹차에 풍부한 카테킨이 항산화 활성과 자유 라디칼 소거 능력에 기여하는 것으로 알려져 있다(Thitimuta et al. 2017). 찻잎의 주요 항산화제는 8개의 유리 히드록실기(OH)가 있는 카테킨 화합물인 EGCG로, 높은 항산화 활성에 결정적인 역할을 한다고 보고되었다(Gramza-Michałowska et al. 2016).
삼백초(Saururus chinensis)는 후추목 삼백초과에 속하는 다년생 식물로(Kim et al. 2019), 우리나라에서는 제주도에서 많이 재배되고 있다. 삼백초 잎에는 Quercetin, Isoquercetrin, Avicularin, Rutin 등이 함유되어 있는데, 이중 Quercetin과 Quercetrin은 플라보노이드의 일종으로 항균 및 항산화 효과를 나타내는 것으로 보고되었다(Kim et al. 2005; Shin et al. 2008).
생강(Zingiber officinale Rosc.)은 생강과의 다년생 식물로 우리나라 충남 서산과 전북 봉동에서 많이 재배되고 있는데, 잎은 식품 공전에 등재되지 않아서 식품으로 사용할 수 없었다. 그러나 생강잎은 다양한 생리 활성 성분이 있고, 뿌리보다 조섬유 4~5배, 조사포닌 1.7배, 총 폴리페놀 및 총 플라보노이드 2~3배가 더 높게 함유되어있다고 보고되었다(Lee et al. 2014). 따라서 농촌진흥청은 문헌 고찰 등의 연구를 통해 2016년에 생강잎을 “식품에 사용할 수 있는 원료” 목록에 등록시켰고 이제 식품 원료로서 사용이 가능해졌다.
치자(Gardenia jasminoides)는 Rubiaceae과에 속하는 상록수의 열매로, 많은 아시아 국가에서 민간요법에 사용되어 왔다(Debnath et al. 2011). 우리나라에서는 경남 남해에서 주로 생산되고 있는데, 천연 황색 염료로 오랫동안 사용되어 왔을 뿐만 아니라 항산화, 항염 및 항우울증의 다양한 생리활성을 갖고 있다(Xiao et al. 2017).
그동안 여러 소재에 대한 생리활성 평가는 보고되었으나, 항산화 및 면역 관련 최적 기능성 소재를 선발하기 위한 기능성 비교 결과는 없는 상황이다. 따라서 본 연구에서는 항산화 및 면역 관련 기능성이 알려진 지역 농산물 16종을 선정하고, 이들의 생리활성을 동시에 비교함으로써 지역 농산물의 제품화 및 실용화 기반 마련을 위한 기초 자료로 활용코자 한다.
II. 연구방법
1. 지역 농산물의 추출물 제조
본 실험에 사용된 삼채는 2014년에 전북 순창군 농업기술센터에서 검증한 후 제공하여 실험에 사용하였으며, 흑미는 진도 소재 정비소에서 구매하였고, 생강잎은 충남 서산시 농가에서 구입하였으며, 나머지 13종의 시료는 두손애 약초에서 건조물을 구매하였다. 본 실험에서 사용된 16종의 시료는 일반적으로 많이 사용되는 70% 주정을 추출 용매로 사용하여 추출하였고, 시료에 따라 용매를 10~40배의 비율로 혼합한 후에 항온수조(70℃, 250~300 rpm)에서 추출하였다. 생강잎은 세척하여 열풍건조(60℃, 12시간)한 다음, 70% 발효주정을 20배 넣어 8시간 동안 추출하였다. 감초, 귤피, 당귀, 백복령, 상백피, 연잎, 옥수수속대, 치자, 칡은 구입한 건조물에 70% 주정을 시료 대비 10배 비율로 넣고 4시간 동안 추출하였다. 녹차잎, 두충, 삼백초, 솔잎 및 연잎은 추출 중에 용매 흡수율이 높아, 연잎은 40배의 70% 주정, 나머지 소재는 시료 대비 30배의 70% 주정을 넣어 같은 조건에서 추출하였다.
2. 항산화 효과 평가
2,2-diphenyl-1-picrylhydrazyl(DPPH) 라디칼 소거 활성은 Brand-Williams et al.(1995)의 방법을 응용하여 측정하였다. 각 시료와 표준품을 50~1,000 μg/mL 농도별로 96 well plate에 분주한 후 0.2 mM 2,2-diphenyl-1-picrylhydrazyl (Sigma-Aldrich Co., St. Louis, MO, USA)을 95.5% 에탄올에 용해하여 제조한 시료 Mixture와 혼합하고 실온에 30분간 반응시켰다. 흡광도는 microplate reader(Molecular Devices, San Jose, CA, USA)를 이용하여 517 nm에서 측정하였다. DPPH radical 소거능을 통해 항산화 활성을 구하였고, 대조군으로 L-ascorbic acid를 사용하였으며, 실험결과는 3회 반복하여 얻은 평균값으로 제시하였다.
2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) 라디칼 소거 활성은 Re et al.(1999)의 방법을 응용하여 측정하였다. 7.4 mM ABTS(Sigma-Aldrich Co.,)와 2.6 mM potassium persulfate (Sigma- Aldrich Co.,)를 지역 농산물의 항산화 및 NO 생성 효과 3411:1 비율로 혼합하고 실온의 암소 공간에 24시간 두었다. ABTS Mixture는 732 nm에서 흡광도 값이 0.70 ± 0.02이 되도록 식염수(pH 7.4)로 희석하여 사용하였다. 제조한 ABTS와 시료를 1:1 (100 μg : 100 μg) 비율이 되도록 혼합하고 실온에서 10분간 반응시킨 다음, microplate reader (Molecular Devices)를 이용하여 760 nm에서 흡광도를 측정하였다.
지역 농산물에 함유된 총 폴리페놀 함량은 Folin-Denis(1912) 방법을 응용하여 측정하였다. 최적 조건에서 생산된 추출물을 농도별로 희석하고 시료와 Folin-Denis’ reaent(Sigma-Aldrich Co.,)를 혼합하여 3분 동안 실온에서 반응시켰다. 10% Na2CO3(Samchun, Korea) 용액을 혼합하여 암실에서 2시간 처리하고, 725 nm에서 microplate reader(Molecular Devices)를 이용하여 흡광도를 측정하였다. 표준 물질 Galic acid (Sigma- Aldrich, USA)를 사용하여 표준 검량선을 구하고 얻어진 계산식에 따라 각 추출물의 총 폴리페놀 함량을 구하였다.
3. NO 생성 효과 평가
본 연구에 사용된 마우스의 대식세포주(RAW 264.7)는 한국세포주은행(Korea Cell Line Bank, Seoul, Korea)에서 구입하여 사용하였다. RAW 264.7 세포는 Dulbecco’s modified Eagle’s medium(DMEM, GIBCO BRL, Grand Island, NY)에 10% fetal bovine serum(FBS), 100 units/mL penicillin과 100 μg/mL streptomycin을 첨가하여 사용하였고 37℃, 5% CO2 조건에서 세포를 배양하였다.
RAW 264.7 세포는 96 well plate에 2 × 104 cells/well로 분주하고 37℃, 5% CO2 incubator에서 4시간 동안 안정화시켰다. 다음에 16종 지역 농산물의 추출물(125, 250, 500 μg/mL) 또는 LPS(2 μg/mL)를 처리하고, 48시간 동안 CO2 incubator에서 배양하였다. 처리가 끝난 후에 MTS(Promega Corporation, Fitchburg, WI, USA) 시약을 10% 수준에서 plate에 첨가하여 37℃에 2시간 반응시켰고, 490 nm에서 microplate reader(Molecular Devices)로 흡광도(OD)를 측정하였다. 세포 독성 정도는 시료를 처리하지 않은 대조군과 추출물 처리군의 OD 값을 비율로 계산하였다.
RAW 264.7 세포에서 생성되는 NO의 함량은 Green et al.(1982)의 방법에 따라 측정하였다. 먼저 RAW 264.7 세포를 96 well plate에 2 × 104 cell/well의 농도로 분주한 후 4 시간 동안 37℃, 5% CO2 incubator에서 배양하였다. 세포가 안정화된 후에 LPS(2 μg/mL)와 추출물(125, 250, 500 μg/mL)을 첨가하고 24시간 동안 배양하였다. 새로운 96 well plate에 세포 배양 상등액 100 μL와 griess reagent 100 μL을 넣어 상온에서 15분 반응시키고, microplate reader (Molecular Devices)를 이용하여 540 nm에서 흡광도를 측정하였다.
4. 통계 분석
모든 데이터는 SPSS 프로그램(Statistical Package for the Science ver. 24, IBM Corp, Armonk, NY, USA)을 사용하여 분석하였고, 결과는 Mean ± S.E(n=3)로 나타내었다. One-way ANOVA (one-way analysis of variance)와 Duncan의 다중 검정법(Duncan’s multiple range test)을 이용하여 사후검정을 실시하였다(p<0.05).
III. 결과 및 고찰
1. 항산화 효과
본 연구에서는 지역 농산물의 항산화 활성을 비교하기 위해, 항산화 평가시 대표적으로 많이 이용되고 있는 DPPH 및 ABTS 라디칼 소거능을 측정하였다(Kim et al. 2021). 식품 원료마다 자유 라디칼과 양이온 라디칼에 대한 결합도가 다르므로 이 실험 결과의 차이를 통해 항산화 우수 소재를 선발할 수 있다(Wang et al. 1998). 지역 농산물 소재의 부위별(줄기와 뿌리, 껍질, 잎과 열매) DPPH 라디칼 소거 활성과 ABTS 라디칼 소거 활성 측정 결과는 Table 1과 Table 2에 제시하였다. 껍질 부분으로 분류된 추출물에서 농도 의존적으로 DPPH 라디칼 소거 활성이 귤피 추출물은 18.40~64.60%, 상백피 추출물은 27.60~88.20%, 두충 추출물은 18.40~74.68%, 흑미 추출물은 39.20~86.69%의 소거능을 보이며 유의적으로 차이가 있었다. DPPH 라디칼 소거 활성은 줄기와 뿌리 부분에서 분류된 추출물에서는 칡 추출물과 껍질 부분의 추출물 중에서는 흑미 추출물이 동일 농도에서 유의적으로 우수한 항산화 활성을 보였다. ABTS 라디칼 소거 활성은 줄기와 뿌리 부분에서 분류된 추출물에서는 칡 추출물과 껍질 부분에서는 상백피 추출물이 동일 농도에서 유의적으로 높은 항산화 활성을 보였다. 그리고 본 실험에 사용된 가장 높은 농도 1,000 μg/mL에서 DPPH 라디칼 소거 활성은 줄기와 뿌리 부분으로 분류된 추출물에서는 칡 추출물과 옥수수 속대 추출물, 껍질 부분으로 분류된 추출물에서는 흑미 추출물, 잎과 열매에서는 치자 추출물이 활성이 가장 높았으며, ABTS 라디칼 소거 활성에서는 줄기와 뿌리 부분 추출물 중에서는 옥수수속대 추출물, 껍질 추출물 중에서는 상백피, 잎과 열매에서는 생강잎 추출물이 가장 높게 나타났다.

Comparison of DPPH radical scavenging activities of the ethanol extracts of 16 agricultural products(%)
지역 농산물 소재의 부위별 (줄기와 뿌리, 껍질, 잎과 열매)에서 분석한 총 폴리페놀 함량을 Table 3에 나타내었다. 1,000 μg/mL의 농도에서 줄기와 뿌리 부분으로 분류된 칡 추출물, 껍질 부분으로 분류된 흑미 추출물, 잎과 열매 부분 중에서는 연잎 추출물과 녹차 추출물에서 총 폴리페놀 함량이 높았으며 유의적인 차이가 있었다. 각 농도에서 칡 추출물의 총 폴리페놀의 함량이 13.05 μg GAE/g로 높게 나왔는데 이는 칡뿌리의 항산화 성분에 대하여 분석한 이전 연구에서 플라보노이드 성분의 일종인 Puerarin으로 확인 동정되었으며, 주요한 폴리페놀 물질이라고 보고되었다(Oh et al. 1990). 껍질 부분에서는 흑미 추출물의 총 폴리페놀 함량은 11.37 μg GAE/g로 높게 나타났는데 흑미의 rice bran층에 존재하는 높은 Flavonoid 함량으로 인하여 총 폴리페놀 함량이 높아진 것으로 사료된다. 1,000 μg/mL의 농도에서 잎과 열매 부분으로 분류된 연잎 추출물은 13.63 μg GAE/g, 녹차 추출물은 13.48 μg GAE/g의 총 폴리페놀이 함유된 것으로 나타났다. 이것은 Park et al.(2021)이 보고한 내용과 유사한 결과로, 연잎 추출물에서 녹차 추출물보다 총 폴리페놀 함량이 많았고, 연잎은 다른 부위(연자방, 연자육, 연근, 우절)보다 총 폴리페놀 함량이 많다고 하였다(Park et al. 2021). Özbek et al.(2020)은 증류수보다 유기용매가 첨가된 에탄올이나 메탄올의 추출 용매가 총페놀 화합물을 추출하기에 효과적이라고 보고하였다.
2. NO 생성 효과
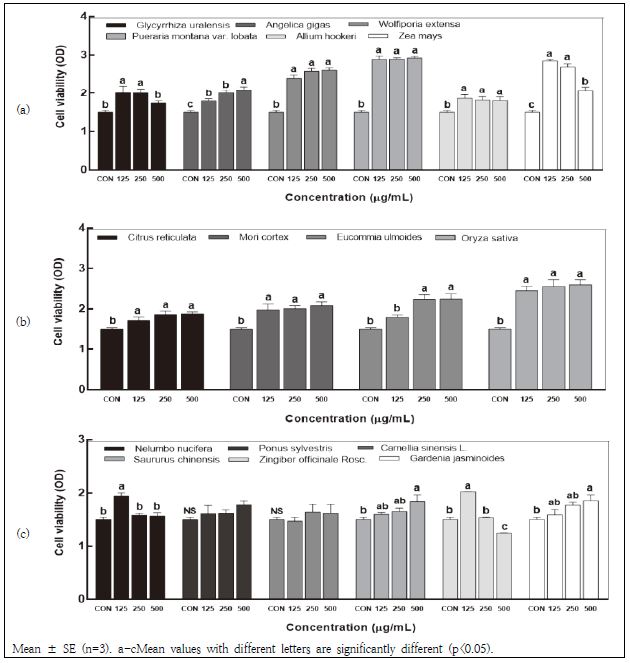
항산화 효과가 우수하여도 독성이 있으면 식용으로 사용하기 어렵다. 따라서 본 연구에서는 우수한 지역 농산물이 Raw 264.7 세포의 안전성에 영향을 미치는지 알아보기 위하여 MTS assay를 수행하였다. 그 결과, 모든 시료가 대조군과 비교할 때, 500 μg/mL 농도 범위까지 세포 생존율이 95% 이상으로 나타났으며 세포 안전성 및 독성에 영향을 주지 않는 것으로 확인되었다(Fig. 1a-c). 그림은 지역 농산물 소재의 부위별 (줄기와 뿌리, 껍질, 잎과 열매) 세포 생존율에 대한 영향을 보여주고 있는데, 이러한 결과를 토대로 소재의 유효 농도 범위를 500 μg/mL까지로 설정하였고, 세포에서 NO 생성 효과 평가를 진행하였다.
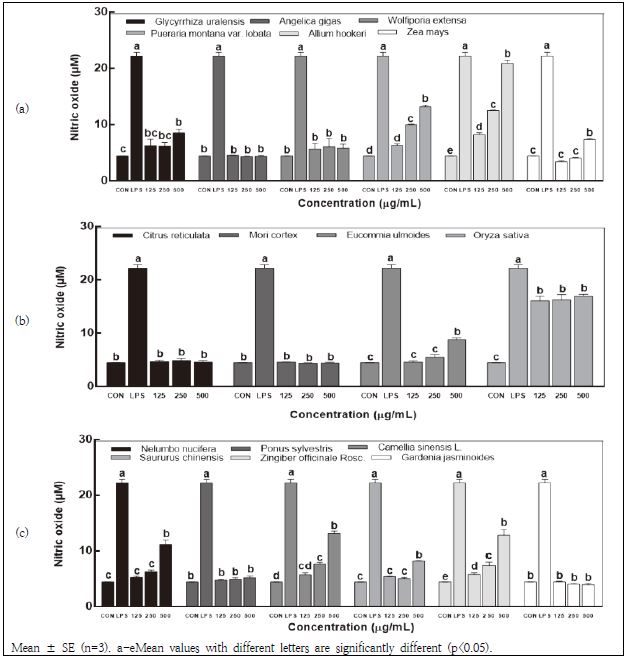
과량의 NO는 정상세포를 공격하고 염증을 유발시켜 독성을 갖는 염증질환의 매개인자로 알려져 있다. 그러나 활성화된 면역세포에서 분비되는 적절한 양의 NO는 면역 신호 전달자로서 면역세포를 활성화시켜 암세포에 대한 독성 및 외부 병원체로부터의 저항성을 증강시킨다고 한다(Kim et al. 2018). 본 실험에 사용된 지역 농산물 16종 추출물의 처리가 대식세포 활성화에 미치는 영향을 평가하기 위하여 RAW 264.7 세포에 농도별로 처리하였고 세포 상등액의 NO의 함량을 Griess 반응법으로 분석하였다. 줄기와 뿌리, 껍질, 잎과 열매로 나누어 비교했을 때 최고 농도인 500 μg/mL 수준에서 줄기와 뿌리 소재로서는 삼채 추출물이 가장 많은 양의 NO 생성량을 보였다(Fig. 2a). 삼채는 뿌리 뿐 아니라 잎에서 NO 생성을 비롯한 면역 관련 요인들을 개선시키는 것으로 보고되었다(Lee et al. 2016). 껍질로서는 흑미 호분층 추출물이 높은 NO 생성량을 보였고(Fig. 2b), 잎과 열매로 분류된 추출물에서는 생강잎이 많은 NO 생성량을 나타냈다(Fig. 2c). 삼채 추출물과 생강잎 추출물은 농도 의존적으로 NO 생성량을 증가시켰는데, Lee et al.(2011)은 독활 추출물의 농도 의존적인 NO 생성 증가는 대식세포의 면역 활성 증진과 관련된다고 보고하였다. 본 연구에서 줄기와 뿌리, 껍질, 잎과 열매에 속한 총 16종 지역 농산물 중에서, 감초, 삼채, 옥수수속대, 두충, 흑미 호분층, 연잎, 녹차, 연잎, 삼백초 및 생강잎 추출물이 우수한 NO 생성능을 보여 면역 활성을 증진시키는 효능이 있다고 사료된다.
IV. 요약 및 결론
본 연구는 지역 농산물의 소비 및 실용화 촉진을 위하여 최근 관심이 높은 항산화와 면역 관련 기능성 소재를 선발하고자 수행되었다. 소재로는 최근 식품 원료로 등록된 생강잎과 전통 의학 및 민간에서 많이 활용되고 있는 기능성 소재 16종을 선정하여 항산화 및 NO 생성 효과를 동시에 비교하였다. 항산화 활성으로 DPPH 라디칼 소거능, ABTS 라디칼 소거능 및 총 폴리페놀 함량을 측정하였고, 면역 관련 요인으로 대표적인 NO 생성 효과를 평가하였다. 우수한 생리활성에 앞서 안전성이 중요하기 때문에, 대식 세포에서 총 16종 소재의 줄기 및 뿌리, 껍질, 잎과 열매로 분리하여 세포 안전성을 평가하고 NO 활성을 측정하였다. DPPH 라디칼 소거 활성은 줄기와 뿌리 중에서는 칡 추출물, 그리고 껍질 부분 중에서는 흑미 추출물이 동일 농도에서 우수한 항산화 활성을 보였다. ABTS 라디칼 소거 활성은 줄기와 뿌리 부분 중에서는 칡 추출물, 그리고 껍질 부분 중에서는 상백피 추출물이 동일 농도에서 높은 항산화 활성을 보였다. 총 폴리페놀 함량은 줄기와 뿌리 부분에서 칡 추출물, 껍질 부분에서는 흑미 추출물, 그리고 잎과 열매 부분 중에서는 연잎 및 녹차 추출물에서 많은 것으로 나타났다. 총 16종 소재의 추출물은 500 μg/mL 미만의 농도에서 세포 독성을 나타내지 않았으며, 삼채 추출물과 생강잎 추출물이 농도가 증가함에 따라 NO 생성이 촉진되었다.
본 연구에 사용된 지역 농산물은 대체적으로 항산화 활성이 우수하고 세포 안전성이 높았다. 특히 뿌리 부분은 칡 추출물, 잎과 열매 부분은 연잎 추출물과 녹차 추출물, 껍질 부분은 흑미 추출물에서 항산화 및 면역 활성이 우수하였다. 따라서 이들 소재는 항산화 및 면역 조절 소재로 활용이 기대되며, 지역 경제 활성화와 국민의 건강 개선에 도움이 될 수 있는 농산물의 안정된 생산과 다양한 제품화가 필요할 것으로 보인다.
References
-
Brand WW, Cuvelier ME, Berset C(1995) Use of a free radical method to evaluate antioxidant activity. LWT 28(1) 25-30.
[https://doi.org/10.1016/S0023-6438(95)80008-5]

-
Choi JH, Lee EB, Jang HH, Cha YS, Park YS, Lee SH(2021) Allium hookeri extracts improve scopolamine-induced cognitive impairment via activation of the cholinergic system and anti-neuroinflammation in mice. Nutr 13(8), 2890.
[https://doi.org/10.3390/nu13082890]

-
Folin O, Denis W(1912) On phosphotungastic-phosphomolybetic compounds as color reagents. J Biol Chem 12, 239-249.
[https://doi.org/10.1016/S0021-9258(18)88697-5]

-
Fukai T, Satoh K, Nomura T, Sakagami H(2003) Preliminary evaluation of antinephritis and radical scavenging activities of glabridin from Glycyrrhiza glabra. Fitoter 74(7-8), 624-629.
[https://doi.org/10.1016/S0367-326X(03)00164-3]

-
Gramza-Michałowska A, Kobus-Cisowska J, Kmiecik D, Korczak J, Helak B, Dziedzic K, Górecka D(2016) Antioxidative potential, nutritional value and sensory profiles of confectionery fortified with green and yellow tea leaves (Camellia sinensis). Food Chem 211, 448-454.
[https://doi.org/10.1016/j.foodchem.2016.05.048]

-
Green LC, Wagner DA, Glogowski J, Skipper PL, Wishnok JS, Tannenbaum SR(1982) Analysis of nitrate, nitrite, and [15N] nitrate in biological fluids. Anal Biochem 126, 131-138.
[https://doi.org/10.1016/0003-2697(82)90118-X]

- Heo W, Kim YJ, Choi HS, Kang KS, Hwang GS, Baek JY, Koo BA, Kim HY(2019) Anti-inflammatory effect of eucommia ulmoides oliver bark extract on p.gingivalis lps-induced yd-38 cells. Korean J Pharmacogn 50(3), 185-190
-
Hosseinzadeh A, Bahrampour JK, Fatemi MJ, Kamarul T, Bagheri A, Tekiyehmaroof N, et al.(2017) Protective effect of ginger (Zingiber officinale Roscoe) extract against oxidative stress and mitochondrial apoptosis induced by interleukin-1β in cultured chondrocytes. Cells Tissues Organs 204, 241-250.
[https://doi.org/10.1159/000479789]

-
Hwang KA, Kim GR, Hwang YJ, Hwang IG, Song J(2016) Oxidative stress inhibitory effects of low temperature-aged garlic (Allium sativum L.) extracts through free radical scavenging activity. J Korean Soc Food Sci Nutr 45(1), 27-34.
[https://doi.org/10.3746/jkfn.2016.45.1.027]

-
Jang YJ, Leem HH, Jeon YH, Lee DH, Choi SW (2015) Isolation and identification of α-glucosidase inhibitors from Morus root bark. J Korean Soc Food Sci Nutr 44(7), 1090-1099.
[https://doi.org/10.3746/jkfn.2015.44.7.1090]

- Jeong HJ, Lee SG, Lee EJ, Park WD, Kim JB, Kim HJ(2010) Antioxidant activity and anti-hyperglycemic activity of medicinal herbal extracts according to extraction methods. Korean J Food Sci Technol 42(5), 571-577.
-
Jeong IS, Kim EH, Park SM, Chung MJ(2019) Immunostimulatory effect of sweet potato peel-based plant mixture on RAW264.7 macrophages. Korean J Food Preserv 26(7), 828-836.
[https://doi.org/10.11002/kjfp.2019.26.7.828]

-
Ji KY, Jung DH, Pyun BJ, Kim YJ, Lee JY, Choi S, Kim T(2021) Angelica gigas extract ameliorates allergic rhinitis in an ovalbumin-induced mouse model by inhibiting Th2 cell activation. Phytomed 93, 153789.
[https://doi.org/10.1016/j.phymed.2021.153789]

- Jin SY, Han YS, Joo NM(2006) Optimization of iced cookies with the addition of pine leaf powder. Korean J Food Cookery Sci 22, 164-172
-
Kim DS, Sung NY, Park SY, Kim G, Eom J, Yoo JG, Seo IR, Han IJ, Cho YB, Kim KA(2018) Immunomodulating activity of Sargassum horneri extracts in RAW264.7 macrophages. J Nutr Health 51(6), 507-514.
[https://doi.org/10.4163/jnh.2018.51.6.507]

- Kim SK, Ban SY, Kim JS, Chung SK(2005) Change of antioxidant activity and antioxidant compounds in Saururus chinensis by extraction conditions. J Korean Soc Appl Biol Chem 48, 89-92
- Kim SL, Kim MJ, Jung GH, Lee YY, Son BY, Kim JT, Lee JS, Bae HH, Go YS, Kim SG, Baek SB (2020) Identification and quantification of phytosterols in maize kernel and cob. Korean J Crop Sci 176-176
-
Kim YS, Kim KH, Youn CK, Kim IJ, Kim YH (2021) Effect of mixed organic fertilizer on growth, yield and component content of saururus chinensis baill in paddy field cultivation. Korean J Soil Sci Fert 54(4), 432-441.
[https://doi.org/10.7745/KJSSF.2021.54.4.432]

-
Kim YS, Shin DH(2005) Volatile components and antibacterial effect of pine needle (Pinus densiflora S. and Z.) extracts. Food Microbiol 22, 37-45.
[https://doi.org/10.1016/j.fm.2004.05.002]

- Kim, YS, Kim KH, Yun CG, Kim IJ, Hong ST (2019) Root production and field application technology of Saururus chinensis Baill. p. 10. CBARES (Chungcheongbuk-do Agricultural Research and Extension Services).
-
Kong S, Kim DJ, Oh SK, Choi IS, Jeong HS, Lee J (2012) Black rice bran as an ingredient in noodles: chemical and functional evaluation. J Food Sci 77(3), C303-C307
[https://doi.org/10.1111/j.1750-3841.2011.02590.x]

- Lee EB, Choi JH, Kim SH, Jang HH, Lee SH (2021) Effects of black rice (Oryza sativa L.) Aleurone layer on cyclophosphamide-induced immunosuppression in mice. Korean J Pharmacogn 52(3), 170-176
- Lee JH, Kim YS, Lim EM(2011) Effects of angelicae pubescentis radix water extract on immune property in RAW264.7 macrophages. Korean J Med 32(1), 175-184
-
Lee KW, Kim YS, Park PJ, Jeong JH(2014) Comparison of effect of water and ethanolic extract from roots and leaves of Allium hookeri. J Korean Soc Food Sci Nutr 43(12), 1808-1816.
[https://doi.org/10.3746/jkfn.2014.43.12.1808]

-
Lee Y, Lee SH, Jeong MS, Kim JB, Jang HH, Jeong SC, Lillehoj HS(2016) In vitro analysis of the immunomodulating effects of Allium hookeri on lymphocytes, macrophages, and tumour cells. J Poult Sci 0160108.
[https://doi.org/10.2141/jpsa.0160108]

-
Liu J, Zhang J, Liao T, Zhou L, Zou L, Liu Y, Li Z, Liu W(2021) Thermal inactivation kinetics of kudzu (Pueraria lobata) polyphenol oxidase and the influence of food constituents. Foods 10, 1320.
[https://doi.org/10.3390/foods10061320]

- Oh MJ, Lee KS, Son HY, Kim SY(1990) Antioxidative components of Pueraria root. Korean J Food Sci Technol 22(7), 793-798
-
Özbek HN, Halahlih F, Göğüş F, Yanık DK, Azaizeh H(2020) Pistachio (Pistacia vera L.) hull as a potential source of phenolic compounds: evaluation of ethanol-water binary solvent extraction on antioxidant activity and phenolic content of pistachio hull extracts. Waste Biomass Valor 11(5), 2101-2110.
[https://doi.org/10.1007/s12649-018-0512-6]

-
Park EJ, Cho HW, Park YJ, In MJ, Kim DC (2021) In vitro biological activities of lotus (Nelumbo nucifera) leaves extract. J Appl Biol Chem 64(2), 121-125.
[https://doi.org/10.3839/jabc.2021.018]

-
Pastorino G, Cornara L, Soares S, Rodrigues F, Oliveira MBP(2018) Liquorice (Glycyrrhiza glabra): a phytochemical and pharmacological review. Phytother Res 32(12), 2323-2339.
[https://doi.org/10.1002/ptr.6178]

-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C(1999) Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic. Biol Med 26, 1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

- Shin HH, Kang MJ, Cho HY, Kim BB, Cho EK (2008) Optimization of extraction conditions for Houttuynia cordara Thunb and Saururus chinensis Baill mixture by response surface methodology. Food Eng Prog 12, 247-255
-
Sujono TA, KusumowatiI TD, Munawaroh R (2021) Effects of Jamaican cherry (Muntingia calabura L.) fruits extract on immunoglobulin G levels and hematological profiles in mice. Pharmacogn J 13(2), 535-541
[https://doi.org/10.5530/pj.2021.13.67]

-
Thitimuta S, Pithayanukul P, Nithitanakool S, Bavovada R, Leanpolchareanchai J, Saparpakorn, P(2017) Camellia sinensis L. Extract and its potential beneficial effects in antioxidant, anti-inflammatory, anti-hepatotoxic, and anti-tyrosinase activities. Molecules 22(3), 401.
[https://doi.org/10.3390/molecules22030401]

-
Wang M, Li J, Rangarajan M, Shao Y, LaVoie EJ, Huang TC, Ho CT(1998) Antioxidative phenolic compounds from sage (Salvia officinalis). J Agric Food Chem 46(12), 4869-4873.
[https://doi.org/10.1021/jf980614b]

- Yang DM, Wang QS, Ke LQ, Jiang JM, Ying TJ (2007) Antioxidant activities of various extracts of lotus (Nelumbo nuficera Gaertn) rhizome. Asia Pac J Clin Nutr 16, 158-163
-
Yang HS, Yu Kwang, Choi YM(2004) Isolation of polysassharides modulation mouse’s intestional immune system from peels of citrus unshiu. J Korea Soc Food Sci Nutr 33(9),1476-1485.
[https://doi.org/10.3746/jkfn.2004.33.9.1476]