흰색 무궁화꽃과 분홍색 무궁화꽃 추출물의 항산화, 멜라닌 합성 저해 및 항균활성 비교
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study investigates the bioactivities of Hibiscus syriacus (H. syriacus) L. flower extracts on dermal cells and bacteria. The white and pink H. syriacus L. flower extracts showed no or minimal cytotoxicity on HaCaT (human keratinocyte) and B16F10 (mouse melanoma) cell lines. H. syriacus L. flower extract inhibited oxidative stress, and its effect was superior to the effect of glutathione. The antioxidant efficacy of pink H. syriacus L. flower extract was higher than the white flower extract. The chloroform layer of the white H. syriacus L. flower extract (40 μg/mL) inhibited melanin synthesis and showed remarkable antibacterial effects against Staphylococcus aureus. The extracted layer also exhibited antibacterial effects on Staphylococcus epidermidis and Pseudomonas aeruginosa. Based on the bioactivity experiment, the white H. syriacus L. flower extract was more effective than the pink flower extract in inhibiting melanin synthesis and antibacterial efficacy. The results of this study indicate potential applications of H. syriacus L. flowers in cosmetics.
Keywords:
antibacterial activity, antioxidant, Hibiscus syriacus L. flower, melanin synthesis inhibition, novel cosmetic materialⅠ. 서론
사람은 생활하는데 필요한 에너지를 얻기 위해 절대적으로 산소를 필요로 하며 호흡을 통해 체내로 유입된 산소는 혈액을 통해 세포까지 전달된다(Kim et al. 2012). 산소는 인간의 생존에 꼭 필요한 물질인 반면에 독성을 지닌 물질로 작용할 수 있다. 활성산소(ROS: active oxygen, Reactive Oxygen Species)는 산소의 대사 과정에서 불가피하게 만들어지는데 체내에 과량 존재하게 되면 단백질, 지방, 효소, DNA 대사 등을 교란시키고 체내의 항상성을 파괴하며 질병과 노화를 촉진시킨다(Bohr 2002; Seitz & Stickel 2006; Hwang & Nhuan 2014). 활성산소 중에 대표적인 것으로는 슈퍼옥사이드 음이온 라디칼(superoxide radical, O2-)과 히드록시 라디칼(hydroxy radical,ㆍOH), 과산화수소(hydrogen peroxide, H2O2),단일항 산소(singlet oxygen, 1O2)가 있다(Kim et al. 2012).
생물체는 활성산소에 대해 효소적 또는 비효소적인 항산화 메커니즘을 가지고 있는데 효소적인 항산화 작용은 세포 내 물질이 손상받기 전에 제거하고 비효소적인 항산화제는 활성산소의 중간매개체로서 산화스트레스를 제거하기에 중요하다고 여겨지고 있다(Mager & De Kruijff 1995; Kim & Ham 2003). 비효소적 항산화제인 glutathione (GSH)은 활성산소인 O2-,ㆍOH, H2O2와 반응하여 안정한 glutathione radical(GS-)을 형성하며 glutathione synthetase에 의하여 합성되는 tripeptide (γ-Glu-Cys-Gly)로서 활성산소를 소거하고 세포 조절작용을 하여 세포 내에 존재하는 중요한 방어 메커니즘으로 여겨지고 있다(Loewen 1979). 즉, glutathione은 세포 내에서 활성산소에 대해 완충작용을 하여 산화적 손상에 대하여 방어를 좋게 한다(Reed 1990). 항산화제의 항산화 효과는 직접적으로 산소를 제거하거나 흡수하는 것이 아니라 free radical과 반응함으로써 산화의 연쇄반응을 차단하여 free radical이 특정 비타민류와 필수 아미노산 등과 반응하여 파괴되는 것을 방지함으로써 나타나는 것으로 알려져 있다(Yang et al. 2013). 항산화제는 합성 항산화제와 천연 항산화제가 있는데 전자는 간 비대, 간장 중 microsomal 효소활성 증가, 체내 흡수물질의 독성화 및 발암 가능성 등의 문제가 제기되어 허용대상 식품이나 사용량이 엄격히 제한되어 있다(Branen 1975; Farag et al. 1989). 후자는 항산화 효과가 비교적 낮고 원료 수급의 문제, 낮은 수율 및 안정성 등의 문제점으로 상업용 추출물에 대한 효과가 확인된 보고가 없고 항산화 효소가 온도와 pH에 영향을 받아 산업적 이용에 어려움이 있다(Cort 1974; Kitahara et al. 1992; Hatano 1995; Masaki et al. 1995; Kim et al. 2006). 그러나 천연 항산화 물질은 매우 적은 양으로도 현저한 활성을 나타내는 고부가가치 물질로서 여러 종류가 쓰이고 있으며 새로운 물질들에 대한 연구도 활발히 진행되고 있다(Larson 1988). 항산화제에 대한 연구는 식품첨가물로서 항산화제 개발이 주류였으나 각종 질병 및 노화 등에 활성산소 및 과산화물이 직접적인 작용을 한다는 사실이 밝혀지면서 질병 예방 및 치료제로서의 항산화제 탐색으로 연구가 확대되고 있다(Kim & Ham 2003). 그리고 화장품 원료로서 항산화 효과를 세포주를 통해 검증하는 연구도 시도되고 있다(Kim & Park 2017; Kim 2018; Kim & Park 2019a; Kim & Park 2019b).
무궁화는 아욱과에 속하는 낙엽성 소교목 또는 관목으로 지리적으로는 중국, 인도 및 시베리아에 분포하고 우리나라에서도 식재한다(Ohwi 1978; Yoo et al. 1996). 무궁화는 관상 외에도 식용과 약용으로 사용한 기록들이 있다. 무궁화잎의 식용에 관한 기록으로 1930년대 “만선식물”에서는 무궁화 어린잎을 식용하였고 불에 볶아서 차대용으로 사용하였다고 하였다. 1960년대까지 춘궁기에는 무궁화잎으로 나물이나 국으로 조리해 먹었으며 “민의약” 1990년 3월호에서는 무궁화잎이 나물로 먹을 수도 있다고 하였다(Cho & Lee 2017). 동의보감을 보면, 무궁화의 줄기와 꽃은 다려서 마시거나 차를 이용하면 장풍(腸風)과 사혈(瀉血) 등에 효과가 있다고 하고 종자는 두통에, 뿌리는 위장에, 줄기의 껍질은 피부, 잎은 이뇨에 효험이 있다고 하였다(Shibata 1957). Choi et al.(2007)은 한의학 고문헌 24종에 등재된 무궁화의 약용 부위와 주치증을 분석, 서술하였다. 연구에서는 약용 부위로 꽃과 껍질이 각각 34.5%와 33.8%로 많다고 하였다. 무궁화 껍질은 개선충 또는 사상균증, 질과 자궁출혈에 기대 효능을 상정하였고 껍질과 함께 가지는 불면증, 열매는 두통에서 기대 효능을 기록하였다. 무궁화꽃은 출혈성 대장질환, 치질과 치루, 탈항증에 효과가 있다고 하였다. 무궁화꽃은 대한민국의 국화이면서 주변에서 흔히 접할 수 있는 식물자원이다. 최근에 무궁화를 미용의 측면에서 다루는 연구들이 발표되고 있지만 무궁화꽃을 화장품 원료로서 접근하는 연구가 부족한 실정이다(Geng et al. 2012; Yoon et al. 2017; Yang et al. 2020; Karunarathne et al. 2021; Yang et al. 2021). 본 연구는 흰색과 분홍색 무궁화꽃 분획물을 세포주와 균주 단계에서 항산화와 멜라닌 합성 억제 효과, 항균 효과 여부를 살펴보고 화장품의 원료로서 가능성을 탐색해 보고자 하였다.
Ⅱ. 연구방법
1. 실험 재료
본 연구는 부산시 삼락생태공원에서 서식하고 있는 무궁화를 꽃 부위만 채취하여 세척하고 음지에서 말린 후 세절하여 사용하였다. 무궁화꽃은 흰색 홑꽃과 분홍색 홑꽃으로 구분하였다.
무궁화꽃의 실험은 피부세포와 박테리아를 이용하여 진행하였다. 피부세포로는 각질형성세포(HaCaT cell; Korea Cell Line Bank, Seoul, Korea)와 멜라닌형성세포(B16F10 cell; Korea Cell Line Bank, Seoul, Korea)가 사용되었다. 세포를 배양한 후 HaCaT cell과 B16F10 cell의 세포생존율 실험을 진행하였다. HaCaT cell로는 항산화 효과를 살펴보았고 B16F10 cell로는 멜라닌 합성 저해 효과를 알아보았다. 세포의 배양에 사용된 DMEM과 FBS, Antibiotics, PBS는 Hyclone™(GE Healthcare Life Sciences, Utah, USA)에서 제조된 제품을 사용하였다. 세포생존율은 Promega(Wisconsin, USA)의 CellTiter 96® AQueous One Solution Cell Proliferation Assay를 통해 진행하였다. 항산화 효과는 Abcam(Cambridge, UK)의 DCFDA/ROS Detection Assay Kit와 Sigma-Aldrich(St. Louis, USA)의 glutathione을 이용해 검증하였다. 멜라닌 합성 저해 효과는 Sigma-Aldrich(St. Louis, USA)의 α-MSH와 arbutin 그리고 RIPA lysis buffer(Tris-Cl (pH 7.5) 50 mM, NP-40 1%, NaCl 50 mM, SDS 0.1%, sodium deoxycholate 0.5%, protease inhibitor cocktail) (Roche, Switzerland)를 사용하여 확인하였다.
박테리아를 이용한 항균 실험은 그람양성균과 그람음성균에서 각 2종씩 선정하여 진행하였다. 박테리아는 한국세포주은행(Korean Collection for Type Cultures, Jeongeup, Korea)을 통해 구입하였다. 그람양성균으로는 S. aureus(KCTC 1927)와 S. epidermidis (KCTC 1917)를 사용하였고 그람음성균으로는 P. aeruginosa (KCTC 2004)와 E. coli (KCTC 2571)를 이용하였다. 항균 실험은 LB(Luria-Bertai) 액체배지에서 배양하여 관찰하였다. 액체배지 조성은 Kim et al.의 연구(2020)와 동일한 방법으로 진행하였다.
추출과 분획에 사용한 시약들은 1급 제품으로 대정화금(Daejeon, Korea)에서 구입하여 사용하였다.
2. 기기
본 연구의 진행에 사용된 기기는 다음과 같다. 추출과 분획에는 BÜCHI Labortechnik AG(Flawil, Switzerland)의 rotary evaporator(Rotavapor R-114)를 사용하였다. 세포 배양과 효과 실험은 SANYO Electric(Osaka, Japan)의 CO2 incubator(MCO-175), Hanil Science Industrial Co.,Ltd.(Gimpo,Korea)의 centrifuge(Union32R)와 micro highspeed centrifuge(Micro17TR)를 이용하여 진행하였다. 박테리아 배양과 증식은 DAE HAN BIO LINK CO., LTD.(Eumseong, Korea)의 auto clave와 Vision Scientific(Daejeon, Korea)의 shaking incubator(VS-8480SF), BioFree(Seoul, Korea)의 shaker(BF-350SK)를 사용하여 시행하였다. 효과 측정은 BioTek Instruments(Winooski, USA)의 microplate reader(Synergy HT)를 통해 진행하였다.
3. 시료의 추출
연구 시료의 추출은 Kim(2018)의 연구와 동일한 방법으로 진행하였다. 세절한 무궁화꽃 2종을 각각 85% ethanol 용매로 빛을 차단한 채 1일 동안 담금하고 감압, 여과, 농축하였다. 이 과정을 3회 반복 시행하여 1차 추출물을 얻었다. 1차 추출물에 chloroform과 distillied water를 동량으로 적용하여 chloroform층과 distillied water층으로 분획하고 distillied water층에 동일 용량의 ethyl acetate를 투입해 distillied water층과 ethyl acetate층으로 분리하였다. 3종의 분획물들은 다시 감압, 여과, 농축의 과정을 통해 최종 적용 시료로 얻어졌다.
4. 세포 생존율 실험
세포 생존율은 Kim & Park(2021)의 연구와 동일한 방법으로 시행하였다. HaCaT cell과 B16F10 cell을 96 well plate에 1.5×104 cells/well로 분주하고 37℃, CO2 5% 조건의 incubator에서 24 h 동안 배양하였다. 흰색과 분홍색의 무궁화꽃 분획물들을 각각 DMSO로 용해한 후 10 μg/mL와 20 μg/mL, 40 μg/mL 농도로 세포에 처리하고 incubator에서 24 h 동안 배양하였다. 배지가 있는 상태에서 MTS 시약을 20 μL씩 가하고 3 h 동안 incubator에 두면서 formazan을 관찰하였다. formazan이 형성되면 microplate reader의 495 nm에서 흡광도를 측정하였다. 대조군에 대한 실험군의 비를 백분율로 하여 효과값을 얻었다.
5. 항산화 실험
HaCaT cell을 이용한 항산화 실험도 Kim & Park(2021)의 연구 방법과 동일하게 진행하였다. HaCaT cell을 96 well plate에 1.5×104 cells/well로 분주한 후 incubator에서 24 h 동안 배양하였다. 세포가 well에 80% 전후로 배양되었는지 확인한 후 배지를 제거, PBS로 세척하여 phenol red를 제거한다. 세척된 well에 DCFDA를 20 μM로 처리한 후 incubator에서 45 min 동안 보관하였다. well의 배지를 다시 제거하고 PBS로 세척한 다음 대조군을 제외한 H2O2 대조군과 실험군들에 H2O2(hydrogenperoxide) 500μM를 처리하였다. 실험군들에는 분획물을 10 μg/mL와 20 μg/mL, 40 μg/mL 농도로 함께 처리하고 45 min 동안 incubator에서 보관한 후 Microplate reader의 485/528 nm에서 형광값을 구하였다. 항산화 효과값은 대조군에 대한 실험군의 비를 백분율로 하여 얻었다.
6. 멜라닌 합성 저해 실험
멜라닌 합성 저해 실험도 Kim & Park(2021)의 연구 방법과 동일한 절차로 시행하였다. B16F10 cell을 1×105 cells/well로 6 well에 분주하여 incubator에서 24 h 동안 배양하였다. 대조군에는 serum free DMEM을 처리하고 α-MSH 대조군과 실험군들에는 α-MSH(100 nM)를 녹인 serum free DMEM을 well에 30 min 동안 방치하였다. 이후 실험군의 배지를 두고 분획물을 실험 농도의 2배로 처리한 다음 incubator에서 48 h 동안 배양하였다. well의 배지들을 제거하고 PBS로 세척한 다음 튜브에 담아 원심 분리(4℃, 12,000 rpm, 3 min)하였다. 튜브의 상층액을 제거한 다음 남은 세포의 pellet에 RIPA lysis buffer를 처리하고 30 min 동안 ice box에서 보관하였다. 다시 원심분리(4℃, 14,000 rpm, 10 min)하여 상층액을 제거한 다음 pellet만 남기고 60℃ 오븐에서 건조하였다. pellet이 건조되면 20% DMSO와 2N NaOH 200 μL를 처리하여 섞어주고 60℃ 오븐에서 pellet을 용해시켰다. 용해물을 96 well에 100 μL씩 담아 microplate reader의 405 nm에서 흡광도를 측정하였다. 효과값은 대조군에 대한 실험군의 비를 백분율로 하여 구하였다.
7. 항균 활성 실험
항균 활성 실험은 Kim et al.(2020)의 연구와 동일한 과정으로 진행하였다. 실험에 사용된 박테리아들은 멸균된 LB 배지에서 배양한 후 이를 고체 배지에서 다시 배양하였다. 고체 배지에서 배양된 박테리아의 single strain을 다시 LB 배지에 첨하고 shaking incubator에서 24 h 배양하여 실험에 사용하였다. 멸균된 LB 배지(5 mL)가 담긴 시험관에 배양된 박테리아 5 uL와 분획물들을 0.1 mg/mL, 0.2 mg/mL, 0.5 mg/mL의 농도로 하여 더하고 shaker에서 고루 섞었다. 접종 직후(0 h) 대조군과 실험군의 배지를 100 uL씩 96well에 담아 microplate reader의 600 nm에서 흡광도를 측정하였다. 이후 배양 6 h부터 3 h 간격으로 접종 24 h까지 앞선 과정을 반복하여 흡광도를 측정하였다. 효과값은 대조군의 흡광도(0 h 기준)에 대한 시간대별 실험군의 흡광도의 비를 백분율하여 얻었다. 이 때 실험군의 흡광도 값은 시료들이 갖는 색채값을 제한 값으로 하였다. 항균활성은 시간이 흐름에 따라 관찰할 수 있도록 나타내었다.
8. 통계 분석
위의 실험들은 3회 반복해서 진행되었고 그 측정치들의 평균과 표준편차를 이용하여 그래프로 결과를 나타내었다. 통계프로그램은 SPSS 18.0(IBM, USA)을 사용하였다. 항산화와 멜라닌 합성 저해 효과에 대한 대조군과 실험군 간의 결과의 유의성은 student’s t-test로 검증하였다(*p<0.05, **p<0.01, ***p<0.001).
Ⅲ. 결과 및 고찰
1. 세포 생존율
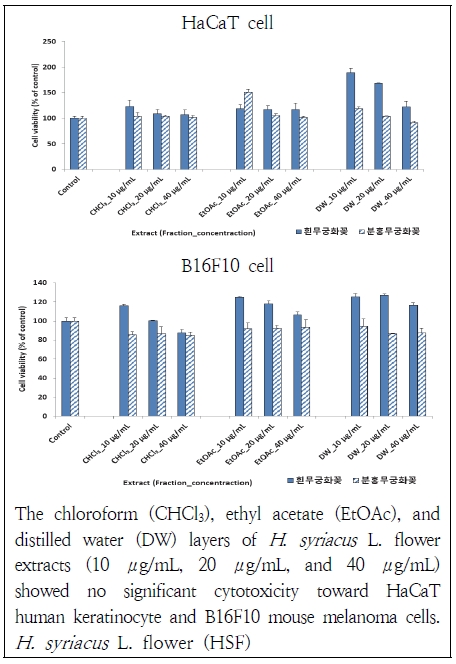
무궁화꽃에 대한 세포 단계에서의 생물활성 실험을 진행하기 위해 세포 생존율 실험을 선행하였다(Fig. 1). 먼저, HaCaT cell에 대해 흰 무궁화꽃 분획물들은 모두 영향을 주지 않았고 농도의존적 경향을 보였다. 분홍 무궁화꽃 분획물들도 대부분 세포의 생존에 영향을 주지 않았으며 distilled water층 40 μg/mL에서 91%의 생존율이 나타나 큰 영향은 없었다. B16F10 cell에 대해서도 흰 무궁화꽃 분획물들은 거의 영향을 미치지 않았으며 chloroform층 40 μg/mL에서 87% 생존율이 관찰되었다. 분홍 무궁화꽃 분획물들은 94~85%의 세포생존율을 보여 크게 영향을 주지 않았다. 본 결과와 유사한 연구로는 Yang et al.(2021)의 연구와 Kim et al.(2018)의 연구가 있다. Yang et al.(2021)은 무궁화꽃 추출물이 HaCaT cell과 NHDF cell에 영향을 주지 않았다고 하였다. Kim et al.(2018)도 흰 무궁화의 뿌리 추출물이 세포에 영향을 주지 않았다고 보고하였다. 본 결과를 통해 HaCaT cell과 B16F10 cell에 각각 항산화 실험과 멜라닌 합성 저해 실험을 진행할 수 있는 것으로 판단하였다.
2. 항산화 효과
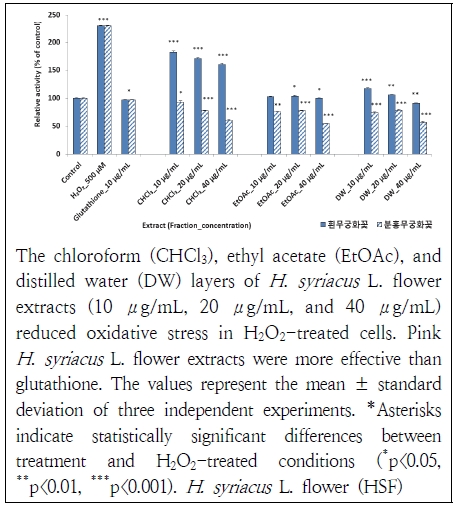
무궁화꽃 분획물들이 활성산소종에 대해 산화억제력이 있는지 알아보았다. 진행한 실험에서 분홍 무궁화꽃 분획물들이 흰 무궁화 분획물들에 비해 우수한 항산화 효과를 나타내었다(Fig. 2). 이는 양성대조군인 glutathione과 비교했을 때도 우수하였다. 대표적인 항산화제인 glutathione이 H2O2대조군(100%)에 비해 산화 물질을 58% 제거하였는데 분홍 무궁화꽃 분획물들은 모두 glutathione보다 항산화 효과가 높게 나타났다. glutathione(10 μg/mL)과 동일 농도에서 distilled water층과 ethyl acetate층, chloroform층은 산화 스트레스가 각각 32%, 33%, 40%까지 낮아졌다. 항산화 효과는 농도의존적 경향을 보였고 ethyl acetate층에서 가장 낮은 산화 상태가 관찰되었다. 흰 무궁화꽃 분획물들도 H2O2대조군에 대해 항산화 효과를 보였다. 특히, distilled water층 40 μg/mL에서는 glutathione과 유사한 수준으로 산화 스트레스가 낮아졌다. 흰 무궁화꽃 추출물들 중에서 ethyl acetate층들은 모두 43~45%까지 산화 스트레스가 낮아져 glutathione과 거의 유사한 산화억제력이 나타났다. 이는 Yang et al.(2020)이 무궁화꽃 추출물이 HaCaT cell에서 ROS를 소거하는데 효과가 있다고 한 보고와 유사하였다. 또한, Kim et al.(2018)이 흰 무궁화 뿌리 추출물이 산화억제 효과가 있다고 한 결과와도 유사하였다.
3. 멜라닌 합성 저해 효과
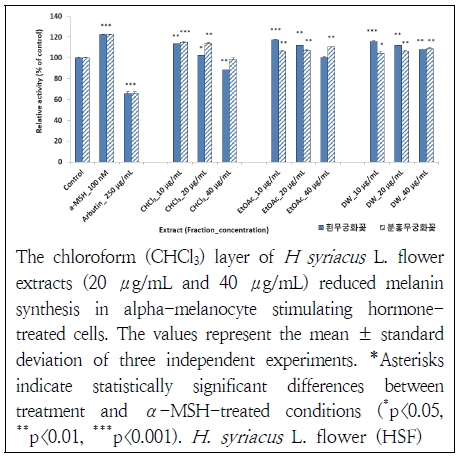
무궁화꽃 분획물들이 활성화된 α-MSH에 대해 멜라닌이 합성되는 것을 저해할 수 있는지를 살펴보았다(Fig. 3). 무궁화꽃 분획물들 중에 흰 무궁화꽃 chloroform층 40 μg/mL가 멜라닌의 합성을 28% 억제하여 가장 우수하였다. 이는 α-MSH의 무처리 대조군과 비교해도 12% 더 효과가 있었다. 분홍 무궁화꽃 chloroform층 40 μg/mL에서도 20%의 억제 능력을 나타났다. 본 연구 결과는 arbutin에 비해 효과가 낮지만 처리된 농도의 차이와 α-MSH의 무처리 대조군과 비교를 통해 무궁화꽃이 멜라닌 합성을 저해하는 효과가 있는 것으로 간주할 수 있다. Jang et al.(2015)도 무궁화의 수피 추출물들이 tyrosinase의 활성을 저해하였다고 하여 무궁화의 수피와 꽃 부위에 멜라닌 합성을 억제하는 물질이 있는 것으로 판단된다.
4. 항균 효과
무궁화꽃 분획물들이 2종의 그람양성균과 2종의 그람음성균에 대해 억제 효과가 있는지 24 h 동안 3 h 간격으로 살펴보았다. 그람양성균인 S. aureus과 S. epidermidis는 chloroform층과 ethyl acetate층에서 균의 증식이 억제되었다(Fig. 4, 5). 먼저, S. aureus는 흰 무궁화꽃 chloroform층 0.5 mg/mL에서 24 h 동안 균의 증식이 저지되었고 분홍 무궁화꽃 chloroform층 0.5 mg/mL에서도 18 h까지 균의 증식이 억제되었다. Chloroform층에서는 농도의존적 항균 효과가 나타났다. Ethyl acetate층 0.5 mg/mL에서도 대조군에 비해 균의 성장이 더디게 나타나 항균 효과가 관찰되었다. Distillied water층은 S. aureus에 대해 항균 효과가 나타나지 않았다. S. epidermidis는 무궁화꽃 chloroform층과 ethyl acetate층에서 유사한 항균 효과가 나타났다. Distillied water층은 S. epidermidis의 증식을 억제하지 못하였다. Kim et al.(2018)도 흰 무궁화 뿌리 추출물 중에 chloroform층은 S. aureus에 대해 항균 효과가 있고 distillied water층은 효과가 없었다고 하여 본 연구와 유사하였다. Jang et al.(2015)도 무궁화의 수피 열수 추출물이 S. aureus에 대해 효과가 없었다고 하여 본 결과와 유사하였다.
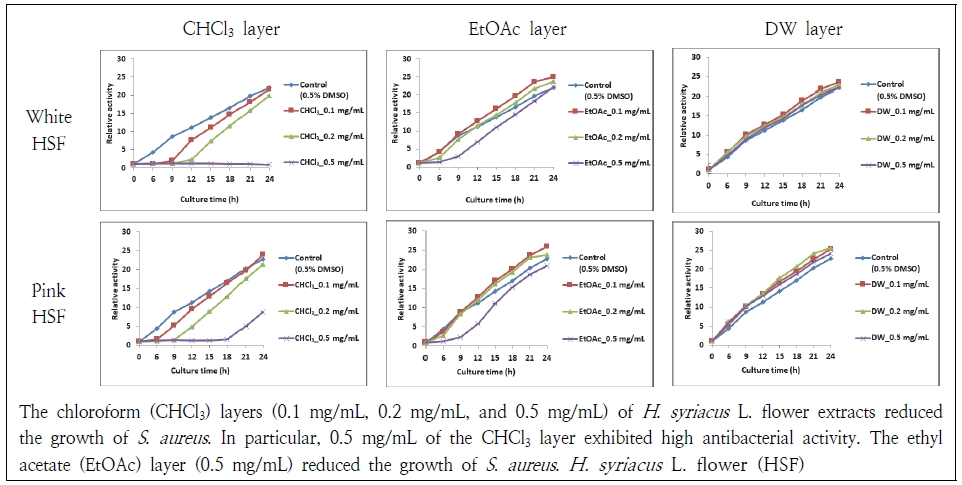
Antibacterial activity of Hibiscus syriacus (H. syriacus) L. flower extracts against Staphylococcus aureus (S. aureus).
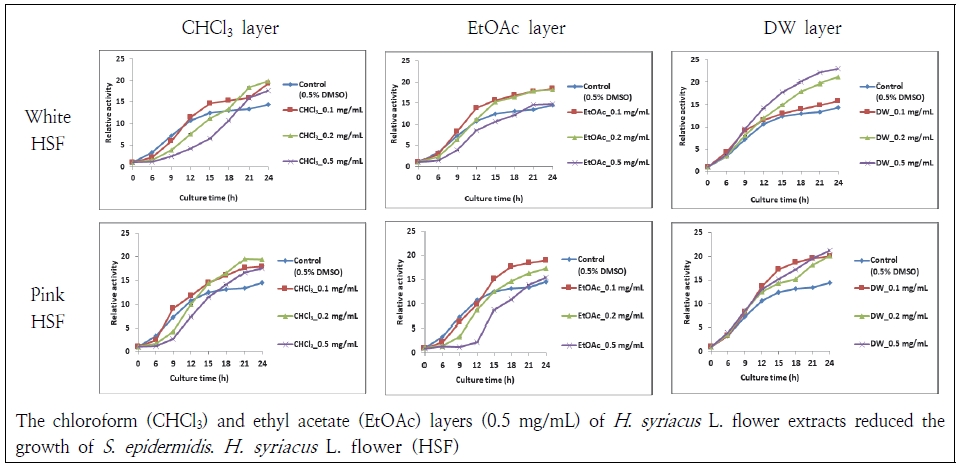
Antibacterial activity of Hibiscus syriacus (H. syriacus) L. flower extracts against Staphylococcus epidermidis (S. epidermidis).
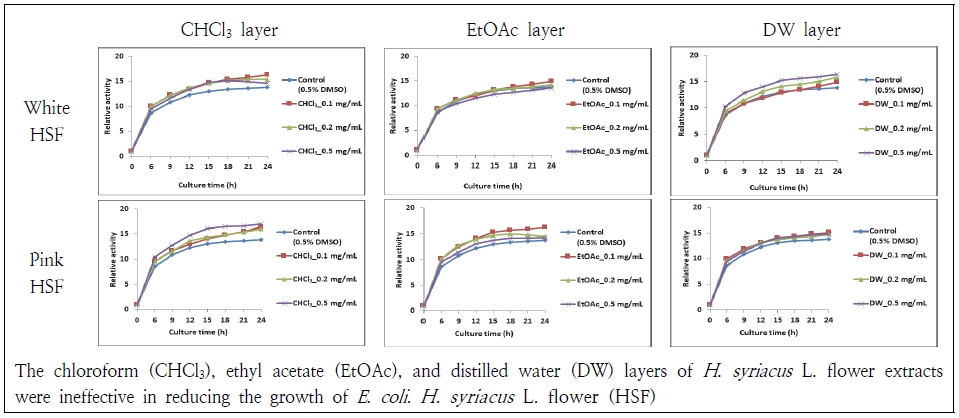
그람음성균인 P. aeruginosa와 E. coli에 대한 무궁화꽃 분획물의 항균 효과는 P. aeruginosa에서 관찰되었다(Fig. 6). 흰 무궁화꽃과 분홍 무궁화꽃 chloroform 0.5 mg/mL에서 P. aeruginosa가 관찰 시간 동안 미약하지만 증식이 억제되었다. 다른 분획물과 농도에서는 항균 활성이 관찰되지 않았다. 또한, E. coli 에 대해서도 무궁화꽃 분획물들이 균의 증식을 억제하지 못하였다(Fig. 7). 이는 Kim et al.(2018)이 흰 무궁화 뿌리 chloroform층이 S. aureus보다 P. aeruginosa에 대해 효과가 더 있었다는 연구와는 다소 상이하였다. Jang et al.(2015)은 무궁화 수피 열수 추출물이 P. aeruginosa 에 대해서 효과가 없다고 하여 본 결과와 유사하였다. 하지만 E. coli 에 대해서는 처리 농도에 따라 균이 감소하였다고 보고하여 상이하였다. 무궁화꽃의 항균 효과는 흰색 무궁화꽃이 분홍 무궁화꽃보다 우수한 경향이 있고 chloroform층이 다른 분획물보다 활성이 높았다.
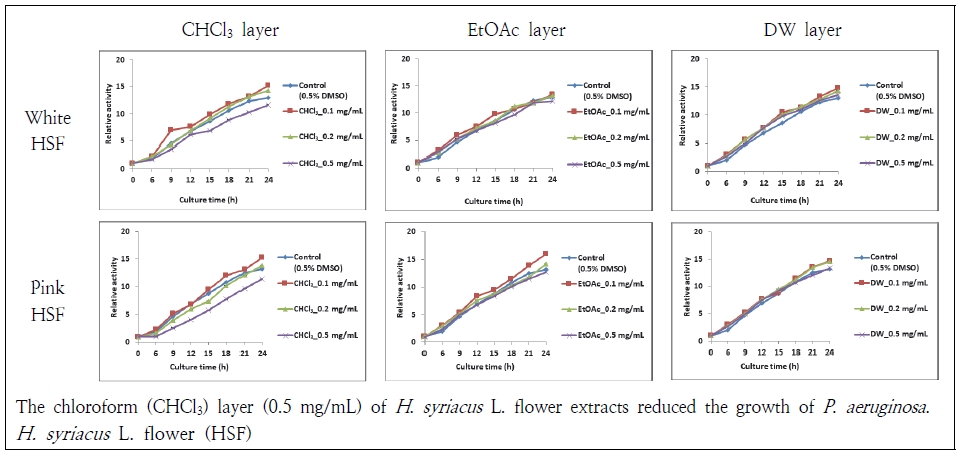
Antibacterial activity of Hibiscus syriacus (H. syriacus) L. flower extracts against Pseudomonas aeruginosa (P. aeruginosa).
Ⅳ. 요약 및 결론
본 연구는 흰색과 분홍색 무궁화꽃이 피부 세포와 박테리아에 대해 효과가 있는지 알아보고자 하였다. HaCaT cell과 B16F10 cell에 대해 흰 무궁화꽃과 분홍 무궁화꽃은 세포 독성을 보이지 않거나 미약한 정도로 영향을 주어 세포 실험이 가능하였다. 무궁화꽃은 항산화 효과 실험에서 우수한 산화 억제력을 보였는데 분홍 무궁화꽃 분획물들이 흰 무궁화꽃 분획물들보다 우수하였다. 분홍 무궁화꽃 분획물들은 대표적인 항산화제인 glutathione보다 높은 항산화 효과를 보여 주목할 만하였다. 무궁화꽃 분획물들의 멜라닌 합성 저해 능력은 흰 무궁화꽃 chloroform 40 μg/mL에서 효과가 나타나 미백 원료로 가능성을 확인할 수 있었다. 무궁화꽃 분획물들은 그람양성균과 그람음성균에 대해서도 항균 효과를 보였다. 흰 무궁화꽃 chloroform층 0.5 mg/mL에서는 S. aureus의 증식이 확인되지 않아 항균제 원료로 가능하다고 판단할 수 있었다. 무궁화꽃 chloroform층 0.5 mg/mL는 S. epidermidis와 P. aeruginosa 에도 항균 효과를 보였다. 흰 무궁화꽃 분획물은 미백과 항균 활성에서 분홍 무궁화꽃보다 효과가 관찰되었고 분홍 무궁화꽃은 항산화 효과에서 흰 무궁화꽃보다 좀더 우수한 효과가 나타났다. 본 연구를 통해 흰 무궁화꽃과 분홍 무궁화꽃 분획물들의 항산화 및 미백, 항균 효과를 확인할 수 있었다.
Acknowledgments
This research was supported by the Dongduk Women’s University grant (2021).
References
-
Bohr VA(2002) Repair of oxidatve DNA damage in nuclear and mitochondrial DNA, and some changes with aging in mammalian cells. Free Radic Biol Med 32, 804-812.
[https://doi.org/10.1016/S0891-5849(02)00787-6]

-
Branen AL(1975) Toxicology and biochemistry of butylated hydroxyanisole and butylated hydroxytoluene. J Am Oil Chem Soc 52(2), 59-63.
[https://doi.org/10.1007/BF02901825]

- Cho IS, Lee JS(2017) Natural dyeing of silk fabrics with the extract of leaves of rose of sharon [Hibiscus syriacus L.]. Fashion Tex Res J 19(4), 515-522.
- Choi GY, Yoon TS, Choo BG, Lee IY, Chaie SY, Joo YS, Kim HK(2007) Study on the medicinal parts and expected efficacys of the Hibiscus syriacus by literature review on the classics of oriental medicine. Korean J Oriental Med 13(2), 27-36
-
Cort WM(1974) Antioxidant activity of tocopherols, ascorbyl palmitate, and ascorbic acid and their mode of action. J Am Oil Chem Soc 51(7), 321-325.
[https://doi.org/10.1007/BF02633006]

-
Farag RS, Badei AZMA, El Baroty GSA(1989) Influence of thyme and clove essential oils on cottonseed oil oxidation. J Am Oil Chem Soc 66(6), 800-804.
[https://doi.org/10.1007/BF02653671]

-
Geng M, Ren M, Liu Z, Shang X(2012) Free radical scavenging activities of pigment extract from Hibiscus syriacus L. petals in vitro. Afr J Biotechnol 11(2), 429-435.
[https://doi.org/10.5897/AJB11.3037]

- Hatano T(1995) Constituents of natural medicines with scavenging effects on active oxygen species-Tannins and related polyphenols. Natural Med 49(4), 357-363
-
Hwang ES, Nhuan DT(2014) Antioxidant contents and antioxidant activities of hot-water extracts of aronia (Aronia melancocarpa) with different drying methods. Korean J Food Sci Technol 46(3), 303-308.
[https://doi.org/10.9721/KJFST.2014.46.3.303]

- Jang AR, Song YS, Kim MK, Lee KK(2015) Evaluation on the phenolic acid compositions and possibility of functional cosmetic ingredients of Hibiscus syriacus Bark extracts. J Korean Soc Cosm 21(5), 895-902
-
Karunarathne WAHM, Molagoda IMN, Lee KT, Choi YH, Yu SM, Kang CH, Kim GY(2021) Protective effect of anthocyanin-enriched polyphenols from hibiscus syriacus l. (malvaceae) against ultraviolet b-induced damage. Antioxidants 10(4), 584.
[https://doi.org/10.3390/antiox10040584]

- Kim HS, Ham JS(2003) Antioxidative ability of Lactic Acid Bacteria. Korean J Food Sci Ani Res 23(2), 186-192
- Kim HS, Kim JY, Kim GH, Kim GY, Kim SO, Kim IC, Kim JS, Kim H, Bum HJ, Shim EK, Oh SJ, Lee ES, Lee HJ, Jung KJ, Jo WA, Jo CH, Han CJ, Hong SW(2012) Beauty scienceⅠ; 2nd edition, Seoul, Chung-Ku Publisher, p161. ISBN 978-89-5616-483-0 93590
- Kim KB, Yoo KH, Park HY, Jeong JM(2006) Anti-oxidative activities of commercial edible plant extracts distributed in Korea. J Korean Soc Appl Biol Chem 49(4), 328-333
- Kim M(2018) Screening of cosmetics ingredients from natural product extracts. Dissertation, Dongduk Women’s University
-
Kim M, Ahn S, Park S(2020) Identifying antibacterial activity components of cosmos flower extract. J Appl Biol Chem 63(3), 249-257.
[https://doi.org/10.3839/jabc.2020.034]

-
Kim M, Kim Y, Park S(2018) Effects of White Hibiscus syriacus L. Root Extracts as Functional Cosmetic Materials. Asian J Beauty Cosmetol 16(4), 477-486.
[https://doi.org/10.20402/ajbc.2018.0229]

-
Kim M, Park S(2017) Effects of Corchorus olitorius L. (Molokhia) extracts as functional cosmetic materials. Asian J Beauty Cosmetol 15(1), 23-31.
[https://doi.org/10.20402/ajbc.2016.0086]

-
Kim M, Park S(2019a) Antioxidant and anti-bacterial effect of Costaria Costata (C. Agardh) Saunders extracts. Korean J Community Living Sci 30(4), 509-516.
[https://doi.org/10.7856/kjcls.2019.30.4.509]

-
Kim M, Park S(2019b) Potential uses of Aristotelia chilensis extracts as novel cosmetic materials. J Appl Biol Chem 62(4), 339-345.
[https://doi.org/10.3839/jabc.2019.047]

-
Kim M, Park S(2021) Bioactivities of feral peach (Prunus persica Batsch var. davidiana Max.) flower extracts and Prunus mume flower extracts. J Appl Biol Chem 64(2), 133-140.
[https://doi.org/10.3839/jabc.2021.020]

-
Kitahara K, Matsumoto Y, Ueda H, Ueoka R (1992) A remarkable antioxidation effect of natural phenol derivatives on the autoxidation of γ-irradiated methyl linoleate. Chem Pharm Bull 40(8), 2208-2209.
[https://doi.org/10.1248/cpb.40.2208]

-
Larson RA(1988) The antioxidants of higher plants. Phytochemistry 27(4), 969-978.
[https://doi.org/10.1016/0031-9422(88)80254-1]

-
Loewen PC(1979) Levels of glutathione in Escherichia coli. Can J Biochem 57(2), 107-111.
[https://doi.org/10.1139/o79-013]

-
Mager WH, De Kruijff AJ(1995) Stress-induced transcriptional activation. Microbiol Mol Biol Rev 59(3), 506-531.
[https://doi.org/10.1128/mr.59.3.506-531.1995]

-
Masaki H, Sakaki S, Atsumi T, Sakurai H(1995) Active-oxygen scavenging activity of plant extracts. Biol Pharm Bull 18(1), 162-166.
[https://doi.org/10.1248/bpb.18.162]

- Ohwi J(1978) Flore of Japan. Tokyo; Shibundo Co. Ltd. Publishers, 1-724
-
Reed DJ(1990) Glutathione: toxicological implications. Annu Rev Pharmacol Toxicol 30(1), 603-631.
[https://doi.org/10.1146/annurev.pa.30.040190.003131]

-
Seitz HK, Stickel F(2006) Risk factors and mechanisms of hepatocarcinogenesis with special emphasis on alcohol and oxidative stress. Biol Chem 387, 349-360.
[https://doi.org/10.1515/BC.2006.047]

- Shibata K (Ed.)(1957) A cyclopedia of useful plants and plant products. Tokyo: The Hokuryukan Co. Ltd.
-
Yang HS, Lee YB, Yoo BJ(2013) Antioxidant activity of water-soluble extracts from Kalopanacis cortex. J Korean Soc Food Sci Nutr 42(4), 527-533.
[https://doi.org/10.3746/jkfn.2013.42.4.527]

-
Yang JE, Park SW, Ngo HTT, Seo SA, Go EB, Hwang JS, Hwang E, Yi TH(2020) Skin-protective and anti-inflammatory effects of Hibiscus syriacus L. (Mugunghwa): a comparative study of five parts of the plant. Pharmacogn Mag 16(67), 183-191.
[https://doi.org/10.4103/pm.pm_185_19]

- Yang JE, Seo SA, Kang MC, Yoon DH, Im TJ, Hwang E, Won KH, Lee TH, Kim SY(2021) Oral administration of H. syriacus L. flower ameliorates photoaging and dryness in UVB-irradiated skin. Korean J Food Sci Technol 53(4), 399-407.
- Yoo KO, Lim HT, Kim JH(1996) Studies on the flavonoids of the Hibiscus syriacus L. complex. Korean J Plant Res 9(3), 224-229
- Yoon SW, Lee KP, Kim DY, Hwang DI, Won KJ, Lee DW, Lee HM(2017) Effect of absolute from Hibiscus syriacus L. flower on wound healing in keratincytes. Pharmacogn Mag 13(49), 85-89.