양파껍질 아임계수 추출물의 항산화 및 면역 증진 효과
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
Onion peel generated in industrial processes is a rich source of bioactive compounds with biological activities. This study examined the antioxidant and immune-enhancing effects of the onion peels produced using a subcritical water extraction method. The antioxidant effects were determined by the total phenolic content, radical scavenging activity, and antioxidant enzyme activity. The immune-stimulating activities were evaluated by the cell viability, the levels of cytokines (IL-2 and IL-6) produced by RAW 264.7 cells, and the proliferation of splenocytes. In the onion peel extract, the total phenolic content was 33.40 ± 0.46 mg GAE/g and IC50 values of DPPH- and ABTS-radical scavenging activities were 143.9 and 22.92 μg/mL, respectively. The superoxide dismutase activity was 1.88 ± 0.00 U/mL at 250 μg/mL and the catalase activity was 3.52 ± 0.05 U/mL at 500 μg/mL. The onion peel extract was nontoxic and increased the IL-2 and IL-6 concentrations in the supernatant from RAW 264.7 cells. Mouse splenocytes were exposed to various concentrations of onion peel extract with media, lipopolysaccharide, concanavalin A, or cyclophosphamide. The onion peel extract enhanced the levels of splenocytes proliferation. Hence, onion peel extract has considerable antioxidant and immune activities and can be a potential candidate for antioxidant and immune enhancement.
Keywords:
onion (Allium cepa L.), peel, subcritical water extraction, antioxidant effect, immune-stimulating activityⅠ. 서론
아임계수(subcritical water)는 pressurized hot water 또는 superheated water라고도 불리며, 물의 끓는점(100℃)에서 임계점(374℃)까지 22.064 MPa 이하의 액체 상태로 이루어지는 고온고압수를 일컫는다. 아임계수는 일반 물에 비하여 비극성 물질을 추출하는데 효과적으로 이용될 수 있다(Han et al. 2018; Kim & Lim 2018). 아임계수는 높은 밀도와 높은 반응성, 유기 화합물에 대한 높은 용해도, 그리고 중합체에 함유된 에스테르, 에테르 결합을 가수분해하는 독특한 성질을 갖는다. 아임계수는 유용 물질의 추출과 회수율이 높은 환경친화적인 추출 방법으로 이용되고 있다(Jo & Lee 2011; Han et al. 2018).
양파(Allium cepa L.)는 백합과에 속하는 2년생 초본으로, 식품의 향신 조미료 외에 약재로도 널리 사용되어 왔다(Kang et al. 2015). 줄기의 색깔에 따라 노란 양파(yellow onion), 붉은 양파(red onion), 흰 양파(white onion)로 구분되고, 맛에 의해 단 양파와 매운 양파로 구분된다(Bang & Cho 1998). 2020년 전세계적으로 양파의 생산량은 104,554천 톤이었으며, 국내 생산량은 1,168천 톤이었다(Rural Development Administration 2022). 양파는 quercetin, anthocyanin, 황화합물 등 다양한 기능성 성분을 함유한 식품이며, 이러한 유용 물질들로 인하여 항산화, 항염증, 항암, 혈압 강하, 항당뇨, 항천식 등 다양한 생리활성이 있는 것으로 보고되었다(Rural Development Administration 2022). Quercetin은 양파 과육에 0.01%가 함유되어 있으며 겉껍질로 갈수록 함량이 높아져 양파껍질에는 약 6.5%에 달하는 quercetin이 함유되어 있다(Joung & Jung 2014). 양파껍질에는 esterified form, free form, 그리고 비수용성 섬유질, 다당류, lignin 등과 불용성 bound form 등의 페놀 화합물이 함유되어 있다(Kim & Lim 2018).
양파는 생산량의 약 10% 정도가 가공품으로 이용되고 있고, 소비자의 신선식품 선호 추세로 껍질과 뿌리를 제거한 1차 가공품 상태로의 유통이 많아지고 있다. 가공 시 발생하는 껍질과 뿌리가 증가하고 있지만, 단순히 사료로 이용되거나 폐기물로 버려지고 있다(Kang et al. 2015). 따라서 양파가공 중의 부산물인 양파껍질을 활용하기 위해 열수 추출, 용매 추출 방법 개발 등 다양한 기술을 활용하여 고부가가치의 기능성 소재로의 개발 연구가 진행되고 있다. 용매 추출법과 아임계수추출법, 가압가열추출법, 저온고압추출법, 환류냉각추출법, 상온교반추출법 등 다양한 방법을 이용한 양파껍질 추출물의 항산화효과 및 항균효과, 세포보호효과, 항노화효과, α-glucosidase 저해효과, angiotensin I converting enzyme 저해효과 등의 다양한 기능성이 보고되었다(Ra et al. 1997; Son et al. 1998; Kim et al. 2011; Joung & Jung 2014; Jeong et al. 2015; Kim & Lim 2018; Kim et al. 2023). 농촌진흥청도 아임계수 기술을 이용하여 생산된 양파껍질 추출물의 항산화 및 면역 증진 활성을 평가함으로써 농업부산물의 실용화 및 활용을 위한 기초 자료로 사용하고자 한다.
Ⅱ. 연구방법
1. 시료 준비 및 추출물 제조
실험에 사용한 시료는 전라남도 무안지역에서 재배한 양파의 껍질을 사용하였다. 수분 함량 5% 이하가 되도록 60℃ 열풍 건조한 시료를 고속믹서(Blender 7012S, Waring Co., Torrington, CT, USA)를 이용하여 1-10 mm 크기로 분쇄하여 사용하였다.
아임계수 추출은 용매인 물을 아임계 상태의 고온ㆍ고압 상태를 유지하며, 자동으로 추출할 수 있는 추출기(ASE 350, DIONEX Co., Sunnyvale, CA, USA)를 이용하였다. 분쇄된 양파껍질 시료 200 g을 4.4 L의 아임계수 추출용 셀(ASE Stainless Extraction Cell, Dionex Co.) 안에 넣고 추출기에 장착하여 수행하였다. 추출 온도는 150℃, 추출 시간은 10분으로 수행하였으며, 추출 시간 동안 압력은 1-10 MPa로 유지된다. 아임계수 추출이 끝나면, 양파껍질 추출물은 일회용 셀룰로스 필터(cellulose filter, Whatman, Buckinghamshire, UK)를 통하여 자동으로 고체의 용질은 제거되고 추출되어 건더기 없는 액상으로 얻어졌다. 양파껍질 아임계수 추출물은 동결건조기(FD 8508, ilshinBioBase Co. Ltd., Dongducheon, Korea)를 이용하여 건조하고 냉장보관하며 분석하였다(Ko et al. 2021).
2. 총 폴리페놀 함량 측정
양파껍질 아임계수 추출물 20 μL와 증류수 80μL, Folin-Ciocalteu’s phenol reagent(Sigma-Aldrich Co., St. Louis, MO, USA) 40 μL를 96 well plate에 분주하고 3분 동안 실온에서 반응시켰다. 10% Na2CO3 용액을 60 μL를 넣고 실온에서 2시간 동안 반응시킨 후 725 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 표준물질인 gallic acid(Sigma-Aldrich Co.)로 구한 표준 곡선을 이용하여 계산하였다(Jung et al. 2022).
3. DPPH 라디칼 소거 활성 측정
양파껍질 아임계수 추출물 50 μL와 0.2 mM 2,2-diphenyl-1-picryl-hydrazyl(DPPH, Sigma-Aldrich Co.) 용액 200 μL를 혼합한 96 well plate를 상온에서 30분 동안 정치시키고 517 nm에서 흡광도를 측정하였다(Jung et al. 2022).
4. ABTS 라디칼 소거 활성 측정
7.4 mM의 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS, Sigma-Aldrich Co.)와 2.6 mM의 potassium persulfate를 1:1로 혼합하고, 라디칼 형성을 위해 실온에서 16-18시간 동안 보관하였다. 용액은 실험 직전에 760 nm에서 흡광도가 0.70-0.75가 되도록 증류수로 희석한 후 사용하였다. 희석된 용액 200 μL와 양파껍질 아임계수 추출물 50 μL를 96 well plate에 넣고 빛을 차단한 상태로 10분 동안 반응시켰다. 추출물의 ABTS 라디칼 소거 활성은 반응물을 760 nm에서 흡광도를 측정하여 평가하였다(Jung et al. 2022).
5. 세포배양
본 연구에서 사용된 RAW 264.7 세포는 한국세포주은행(Korean Cell Line Bank, Seoul, Korea)에서 구입하여 사용하였다. RAW 264.7 세포는 10% heat inactivated fetal bovine serum(FBS, Gibco, ThermoFisher Scientific, Waltham, MA, USA)과 1% penicillin-streptomycin solution(GenDEPOT, Katy, TX, USA)이 포함된 Dulbecco’s Modified Eagle Medium(DMEM, Gibco) 배지를 사용하여 37℃, 5% CO2 incubator에서 배양하였다. 배양용 plate에서 RAW 264.7 세포가 80% 정도 밀집하면 떼어낸 후 실험에 사용하였다.
6. Superoxide dismutase 활성도 측정
Superoxide dismutase(SOD) 활성은 SOD colorimetric activity kit(Invitrogen Co., Carlsbad, CA, USA)를 이용하여 측정하였다. 2×105 cells/mL 농도의 RAW 264.7 세포를 6 well plate에 분주하고 37℃에서 4시간 배양한 후 양파껍질 아임계수 추출물을 농도별(31.25, 62.5, 125, 250 μg/mL)로 처리하였다. 세포를 48시간 동안 배양하고, 상층액을 회수 및 원심분리(1,500 rpm 10 min, 4℃)하여 얻은 상등액으로 SOD 활성을 측정하였다. 상등액 10 μL와 substrate 50 μL, xanthine oxidase 25 μL를 96 well plate에 분주하고 20분 동안 반응시키고 450 nm에서 흡광도를 측정하였다. 양파껍질 추출물의 SOD 활성도는 SOD standard를 사용하여 얻은 표준 곡선으로부터 계산하였다(Jeong et al. 2022).
7. Catalase 활성도 측정
Catalase(CAT) 활성은 CAT colorimetric activity kit(Invitrogen Co.)를 이용하여 측정하였다. 2×105 cells/mL 농도의 RAW 264.7 세포를 6 well plate에 분주하고 37℃에서 4시간 배양한 후 양파껍질 아임계수 추출물을 농도별(50, 100, 500 μg/mL)로 처리하였다. CAT 활성은 48시간 동안 배양한 상층액을 회수 및 원심분리(1,500 rpm 10 min, 4℃)하여 측정하였는데, 상등액 25 μL와 hydrogen peroxide reagent 25 μL를 96 well plate에 분주하고 30분 동안 실온에서 반응시켰다. Substrate 25 μL와 HRP solution 25 μL를 분주한 후 15분 동안 실온에서 반응시키고, 560 nm에서 흡광도를 측정하였다. 양파껍질 추출물의 CAT 활성도는 CAT standard를 이용하여 얻은 표준 곡선을 이용하여 평가하였다(Jeong et al. 2022).
8. 세포 생존율 측정
RAW 264.7 세포를 96 well plate에 2×105 cells/mL로 분주하고 37℃, 5% CO2 incubator에서 4시간 동안 안정화시켰다. 세포에 lipopolysaccharide(LPS 1 μg/mL, Sigma-Aldrich Co.)를 넣고 37℃, 5% CO2 incubator에서 2시간 동안 배양하였으며, 양파껍질 아임계수 추출물(62.5, 125, 250 μg/mL)을 처리한 후에 48시간 동안 배양하였다. 상등액 100 μL을 제거한 후 MTS(Promega Co., Fitchburg, WI, USA) 시약을 10 μL 분주하고 37℃, 5% CO2 incubator에서 2시간 반응시켰다. 흡광도는 490 nm에서 측정하였고, 세포 생존율은 시료를 처리하지 않은 대조군과 추출물 처리군의 흡광도 수치 비율로 계산하였다(Kim et al. 2022).
9. 세포배양 상등액의 Cytokine 수준 측정
RAW 264.7 세포(2×105 cells/mL)를 6 well plate에 분주하고 37℃에서 4시간 배양한 후 양파껍질 아임계수 추출물(62.5, 250 μg/mL)을 처리하였다. 세포를 48시간 동안 배양하고 상층액을 회수 및 원심분리(1,500 rpm 10 min, 4℃)한 후에 cytokine 수준 분석에 사용하였다. Interleukin-2(IL-2)와 IL-6의 농도는 IL-2 ELISA kit(AE38352MO, Abebio, Wuhan, China)과 IL-6 ELISA kit(abcam 222503, abcam, Cambridge, UK)의 protocol에 따라 측정하였으며, 표준용액으로부터 산출된 표준곡선으로부터 계산하였다.
10. 비장세포 증식능의 측정
마우스의 비장을 적출한 후 Hank’s balanced salt solution(HBSS, Gibco)으로 2회 세척하고, 10 mL HBSS가 들어있는 배양 접시에 놓은 40 μm nylon cell strainer(BD Biosciences, San Jose, CA, USA) 안에서 균질화시켰다. 균질화된 비장세포는 histopaque(Sigma-Aldrich Co.)에 올려 넣고 1,500 rpm에서 3분간 원심분리하여 림프구를 분리하였다. 준비된 림프구(3×106 cells/mL)를 96 well plate에 100 μL씩 분주하고, 각 well에 50, 125, 250 μg/mL 농도의 양파껍질 아임계수 추출물을 50 μL 분주하였다. 단순한 세포배양용 배지, mitogen인 LPS(1 μg/mL)와 concanavalin A(Con A, 5 μg/mL, Sigma-Aldrich Co.), 면역억제제인 cyclophosphamide (CPA, 1 μg/mL, Sigma-Aldrich Co.)를 각 well에 50 μL씩 분주하고 37℃에서 48시간 배양하였다. 비장면역세포의 증식능은 plate에 MTS (Promega Co.) 10 μL를 첨가하고 2시간 동안 배양한 후, 490 nm에서 흡광도를 측정하여 평가하였고(Jung et al. 2022), 배지로 처리한 비장세포를 대조군(control)으로 삼았다.
11. 통계 분석
모든 데이터는 SPSS 프로그램(Statistical Analysis Program ver. 18.0, SPSS, Chicago, IL, USA)을 사용하여 분산분석(ANOVA)한 후에 제시하였다. 유의적인 차이가 있는 항목에 대하여는 Duncan’s multiple range test로 p<0.05 수준에서 시료 농도 사이의 차이를 표시하였다.
Ⅲ. 결과 및 고찰
1. 양파껍질 아임계수 추출물의 총 폴리페놀 함량
Kim et al.(2019)은 양파껍질의 quercetin을 높은 수율로 추출하기 위해 다양한 온도(105-185℃)와 시간(5-30분)에 따른 아임계수 추출법으로 양파껍질을 추출하였다. 선행 연구를 참고하여 수행한 본 연구(150℃, 10분, 10 MPa)에서 양파껍질 추출물의 총 폴리페놀 함량은 33.40 ± 0.46 mg GAE/g으로 나타났다. 페놀성 화합물은 식물계에 널리 분포되어 있으며, 항산화 및 항암 등의 생리활성이 우수한 것으로 보고되었고(Hwang et al. 2015), 양파의 갈색 껍질과 바깥층에는 페놀 화합물이 풍부하게 함유되어 있다(Benito-Román et al. 2020).
165℃에서 10분, 500 psi 조건으로 아임계수 추출한 양파껍질 추출물의 총 페놀 함량은 25.0 ± 1.75 mg GAE/g이었고, 110℃ 또는 165℃에서 15분, 500 psi 조건으로 처리하였을 때 218.73 ± 5.68 또는 56.68 ± 2.28 mg GAE/g으로 추출 온도 및 시간에 따라 총 폴리페놀 함량에서 차이를 보였다(Lee et al. 2011; Lee et al. 2014). 양파껍질 열수 및 주정 추출물의 총 폴리페놀 함량은 211.91 ± 3.74와 233.91 ± 1.70 mg/g이었으며, 95% 에탄올 또는 60% 발효 주정 첨가 후 citric acid로 pH 조정한 양파껍질 추출물의 총 폴리페놀 함량은 217.12 ± 4.42 및 614.67 ± 14.51 mg/g으로 보고되었다(Jeon et al. 2012: Joung & Jung 2014). 따라서 총 폴리페놀 함량은 아임계수 추출물에서 적은 경향을 보였고, 가압가열추출, 환류냉각추출, 저온고압추출, 상온교반추출 등 다양한 추출 방법과 아임계수 추출장치의 추출 온도 및 시간에 따라 양파껍질 추출물 내 총 폴리페놀 함량에 차이가 있는 것으로 보고되었다(Jeong et al. 2015; Han et al. 2018; Kim & Lim 2018).
2. 양파껍질 아임계수 추출물의 항산화 효과
양파껍질 아임계수 추출물의 항산화 활성을 확인하기 위해 라디칼 소거 활성과 항산화 효소 활성을 평가하였다.
라디칼 소거 활성으로 DPPH- 및 ABTS 라디칼 소거 활성을 측정하였으며, 그 결과는 Table 1과 같다. DPPH assay는 항산화 활성을 간접적으로 측정하는 가장 오래된 방법(Gulcin 2020)으로, 보라색의 DPPH 라디칼은 항산화 성분에 의해 노란색으로 환원된다(Boligon et al. 2014). DPPH 라디칼 소거능은 양파껍질 추출물의 농도가 증가함에 따라 유의적으로 활성이 증가하였고(30.8-81.3%), IC50값은 143.9 μg/mL으로 나타났다. 이전 연구에서 추출 방법에 따른 DPPH 라디칼 소거 활성의 차이가 보고되었는데, 1 mg/mL 농도에서 autoclave로 가압가열추출한 양파껍질의 DPPH 라디칼 소거능은 28.39%, 저온고압추출물은 24.35%, 상온교반추출물은 19.53%, 환류냉각추출물은 26.07%로 나타났다(Jeong et al. 2015). 초고속 진공 저온 농축 추출기에 의해 얻은 양파껍질 열수 추출물의 IC50값은 1.20-1.83 mg/mL이었다(Joung & Jung 2014). 아임계수 추출 방법으로 얻은 양파껍질 추출물의 DPPH 라디칼 소거 활성은 온도에 따라 그 활성에서 차이가 있었다. 110℃ 또는 165℃, 15분, 500 psi 조건으로 추출한 시료는 0.2 mg/mL 농도에서 각각 64.72 ± 1.82와 11.45 ± 0.22%이었다(Lee et al. 2014). 양파껍질 아임계수 추출물은 온도(100-150℃)와 시간(5-20분)에 따라 라디칼 소거 활성에 차이를 나타냈으며, CO2 처리에 의해 같은 조건의 아임계수 추출물보다 높은 라디칼 소거 활성을 보였다(Kim & Lim 2018). 따라서 본 연구의 양파껍질 아임계수 추출물은 가압가열추출 및 저온고압추출, 상온교반추출, 환류냉각추출 등의 방법으로 생산된 추출물보다 라디칼 소거 활성이 높았다.
ABTS assay는 다양한 소재의 항산화 활성을 평가하는데 사용되는 방법으로(Schaich et al. 2015), ABTS 라디칼은 친유성 및 친수성 성분과 작용하며, ABTS 라디칼과의 반응으로 인한 탈색 작용을 통해 항산화 능력을 측정한다(Gulcin 2020). 본 연구에서 양파껍질 아임계수 추출물은 94.6-100%의 ABTS 라디칼 소거 활성을 보였고, IC50값은 22.92 μg/mL이었다. 가압가열추출법에 의한 양파껍질 추출물은 33.29%, 저온고압추출물은 25.35%, 환류냉각추출물은 26.72%, 상온교반추출물은 17.45%의 ABTS 라디칼 소거 활성이 보고되었다(Jeong et al. 2015). 70% 메탄올, 70% 에탄올, 클로로폼-메탄올 혼합 용매로 추출한 양파껍질 추출물의 IC50값은 각각 0.46 ± 0.01, 0.43 ± 0.00, 0.62 ± 0.01 mg/mL이었다(Duan et al. 2015). 양파껍질 열수 추출물의 ABTS 라디칼 소거능은 432.78 ± 1.43 mg AA eq/g이었으며, 열수 추출물을 다시 주정 추출한 시료와 주정 추출물을 citric acid로 pH 조정한 시료의 ABTS 라디칼 소거능은 431.22 ± 1.65과 416.08 ± 0.48 mg AA eq/g으로 나타났다(Joung & Jung 2014). 따라서 양파껍질 추출물의 ABTS 라디칼 소거 활성은 추출 방법과 용매에 따라 영향을 받고, 본 실험에 사용된 아임계수 추출물은 항산화 효과가 높은 것을 확인하였다.
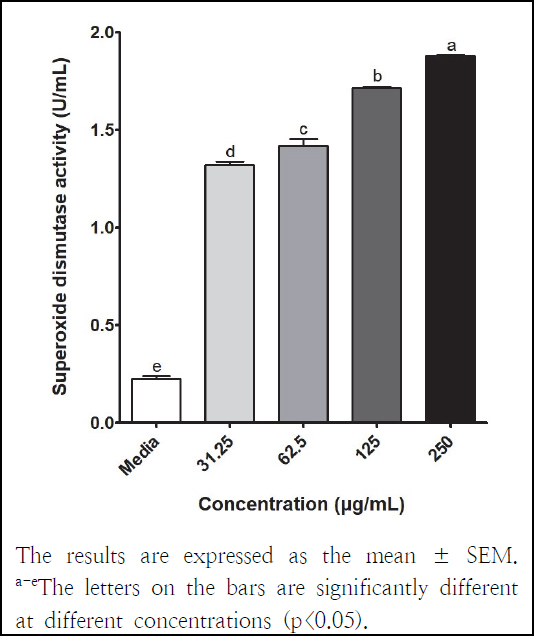
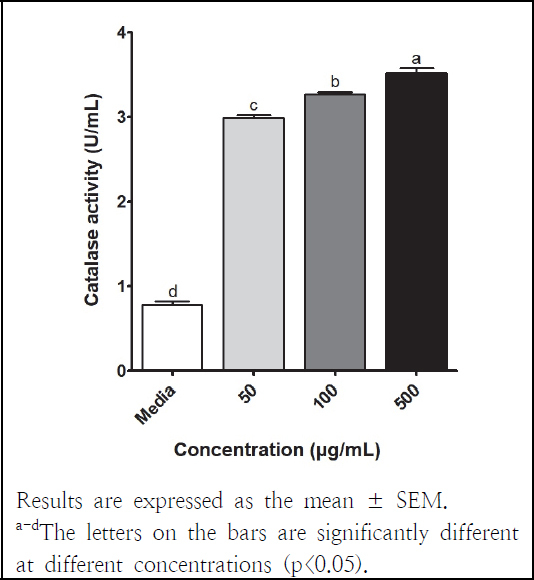
세포에서의 항산화 효소 활성 검증을 위해 SOD와 CAT 활성을 측정하였고, 그 결과는 Fig. 1, 2와 같다. SOD와 CAT는 활성산소(reactive oxygen species, ROS)로부터 기관을 보호하는 항산화 효소로 SOD가 ROS를 H2O2로 전환시키고 CAT에 의해 물과 산소로 분해된다(Jeong et al. 2021; Kim et al. 2022). 본 연구에서 양파껍질 아임계수 추출물의 SOD 활성은 1.32-1.88 U/mL이었고, 농도가 높아짐에 따라 유의적으로 증가하였다. LPS로 염증을 발생시킨 RAW 264.7 세포에 양파 전초 주정 추출물(50, 100, 250 μg/mL)을 처리한 결과 5.82-6.08 U/mL SOD 활성이 보고되었다(Kim et al. 2022). 노란 양파껍질 주정 추출물을 약 6개월 동안 투여한 랫드의 plasma(7.89 ± 2.51 U/mg protein)에서 대조군(6.65 ± 1.58 U/mg protein)보다 높은 SOD 활성을 나타냈다(Chernukha et al. 2021). 본 연구에서 양파껍질 아임계수 추출물의 CAT 활성은 3.00-3.52 U/mL이었고, 농도가 높아짐에 따라 활성이 유의적으로 증가하였다. 양파 전초 주정 추출물은 LPS 처리한 RAW 264.7 세포 내에서 CAT 활성을 향상시켰으며(Kim et al. 2022), 노란 양파껍질 주정 추출물의 경구투여는 랫드의 plasma 내 CAT 활성을 증가시켰다(Chernukha et al. 2021). 따라서 본 연구의 양파껍질 아임계수 추출물은 이전 보고와 유사하게 항산화 효소 활성을 향상시키는 것으로 확인되었다.
3. 양파껍질 아임계수 추출물의 안전성과 cytokine 분비능에 미치는 영향
양파껍질 아임계수 추출물의 독성 및 RAW 264.7 세포의 안전성에 미치는 영향을 확인하기 위하여 MTS assay를 수행하였다. 그 결과, 시료의 모든 농도에서 대조군인 배지보다 세포 생존율이 증가하여 100% 이상을 보였고(Fig. 3a), 양파껍질 아임계수 추출물은 세포 독성이 없는 것으로 나타났다.
Cytokine은 면역세포가 분비하는 단백질로서 면역세포들 사이의 활성을 조절하는 중요한 매개체이다(Sohn et al. 2012). T세포 성장인자로 알려진 IL-2는 초기 염증반응에서 세포 사이의 신호전달을 수행하며 면역반응에서 중요한 역할을 담당한다(Shin et al. 2020). IL-6는 활성화된 B세포에 의한 면역글로불린 합성을 촉진하는 B세포 자극 인자로 알려져 있다(Aliyu et al. 2022).
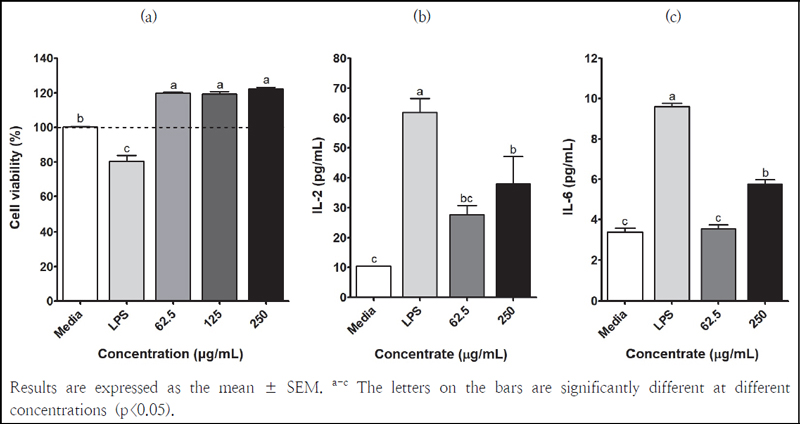
Effects of the subcritical water extract from onion peels on (a) the cell viability and the levels of (b) IL-2 and (c) IL-6 produced by RAW 264.7 cells.
양파껍질 아임계수 추출물의 cytokine 농도를 측정한 결과는 Fig. 3b 및 3c와 같다. 양파껍질 추출물의 62.5와 250 μg/mL 농도에서 IL-2 생성량은 27.68 ± 3.07과 38.11 ± 9.08 pg/mL이었고, IL-6 생성량은 3.57 ± 0.19와 5.76 ± 0.21 pg/mL으로 나타났다. 양파껍질 추출물 처리군은 단순히 배지를 처리한 RAW 264.7 세포 내에서 분비된 cytokine 농도보다 높은 함량을 보였다. 이는 양파껍질 추출물이 대식세포를 활성화시켜 IL-2와 IL-6 분비를 촉진시켰기 때문인 것으로 해석된다.
4. 양파껍질 아임계수 추출물이 비장세포 증식능에 미치는 영향
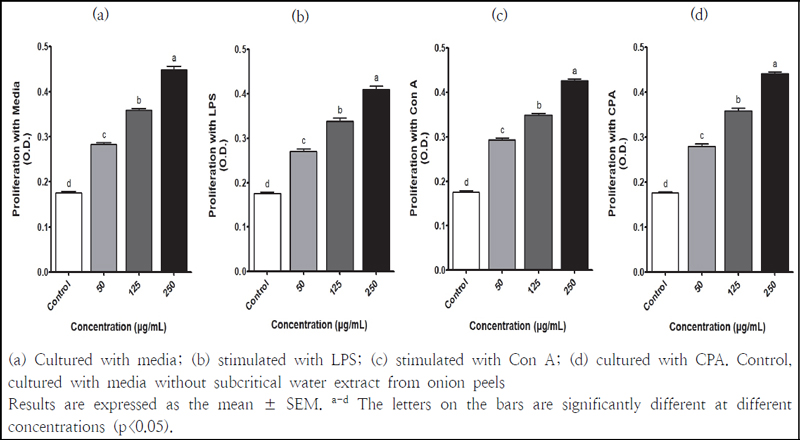
비장은 B 및 T 림프구의 성숙과 항원의 자극에 의한 림프구의 분화가 이루어지는 기관으로, 항원에 대해 주된 보호 면역반응을 담당한다. 비장세포의 크기나 수는 면역반응의 직접적인 인자로서 주요 면역지표로 사용된다(Kim et al. 2019). Mitogen은 특정 면역세포를 자극하여 면역세포의 활성을 촉진시키는 물질의 총칭으로 비장세포 실험에서 LPS와 Con A를 대표적으로 사용한다. LPS는 B 세포를 자극하여 세포 활성을 유도시키며, Con A는 T 세포를 자극하여 세포 증식 유도와 사이토카인의 분비를 증가시킨다(Kim et al. 2019). CPA는 비장세포의 DNA를 알킬레이션시켜 T 및 B 임파구에 의한 면역반응을 억제시킨다(Choi et al. 2019). 양파껍질 아임계수 추출물의 면역 활성 효과를 확인하기 위해 비장세포 증식능을 측정하였고 그 결과는 Fig. 4와 같다. 비장세포에 LPS, Con A 및 CPA와 양파껍질 아임계수 추출물을 처리하였을 때, 추출물의 농도가 높아짐에 따라 유의적으로 흡광도가 증가되었다. 괭생이 모자반의 열수 및 주정, 초임계 추출물을 경구투여한 마우스의 비장세포에 LPS와 Con A를 처리한 결과, 열수와 초임계 추출물 처리군에서 비장세포의 증식능이 유의적으로 증가되었다(Kim et al. 2019). CPA로 면역 저하시킨 마우스의 비장세포에 LPS와 Con A를 처리하였을 때, 홍도라지 주정 추출물을 섭취한 마우스에서 비장세포 증식능이 우수한 것으로 나타났다(Choi et al. 2019). 또한 강황 열수 및 주정 추출물은 배지와 LPS, Con A, CPA 처리한 마우스 비장세포의 증식능을 유의적으로 증가시키는 효과가 있었다(Jung et al. 2022). 본 연구에서 사용된 양파껍질 아임계수 추출물도 농도 의존적으로 비장세포 증식을 향상시켜 면역 증진 활성이 우수한 것으로 나타났고, 면역이 저하된 모델에서 면역을 회복하는 효과가 있을 것으로 기대된다.
Ⅳ. 요약 및 결론
본 연구는 양파껍질 아임계수 추출물의 항산화 및 면역 증진 효과를 평가하기 위해 수행되었다. 항산화 요인으로 총 폴리페놀 함량, DPPH-와 ABTS 라디칼 소거능, SOD와 CAT 활성을 분석하였고, 면역 관련 요인으로는 대식세포에 대한 안전성과 cytokine 생성 및 비장세포 증식능을 확인하였다. 그 결과, DPPH-와 ABTS 라디칼 소거능에 대한 양파껍질 아임계수 추출물의 IC50값은 143.9와 22.92 μg/mL으로 이전에 보고된 연구보다 높은 라디칼 소거 활성을 보였다. 세포에서 항산화 효소 활성인 SOD와 CAT도 각각 1.32-1.88과 3.00-3.52 U/mL로 농도가 높아짐에 따라 활성이 증가하였다. 또한 양파껍질 추출물은 RAW 264.7 세포에 독성을 보이지 않으면서 사이토카인(IL-2, IL-6) 생성과 LPS, Con A 및 CPA를 처리한 비장세포에서 농도 의존적으로 증식효과를 보였다. 따라서 아임계수 추출법을 활용한 국내 양파껍질 추출물은 안전할 뿐 아니라 항산화 및 면역 증진에 도움을 줄 수 있는 것으로 나타났다. 앞으로 양파껍질 아임계수 추출물의 활성 물질 분석과 기전 구명 및 in vivo 실험을 통해 안전하고 국제 경쟁력을 갖춘 기능성 식품 재료로서 활용될 수 있길 기대한다.
Acknowledgments
This research was supported by the R&D grant (PJ01602002) from the Rural Development Administration, Republic of Korea.
References
-
Aliyu M, Zohora FT, Anka AU, Ali K, Maleknia S, Saffarioun M, Azizi G(2022) Interleukin-6 cytokine: an overview of the immune regulation, immune dysregulation, and therapeutic approach. Int Immunopharmacol 111(4), 109130.
[https://doi.org/10.1016/j.intimp.2022.109130]

- Bang HA, Cho JS(1998) Antioxidant effects on various solvent extracts from onion peel and onion flesh. J Korean Diet Assoc 4(1), 14-19.
-
Benito-Román Ó, Blanco B, Sanz MT, Beltrán S (2020) Subcritical water extraction of phenolic compounds from onion skin wastes (Allium cepa cv. Horcal): effect of temperature and solvent properties. Antioxidants 9(12), 1233.
[https://doi.org/10.3390/antiox9121233]

-
Boligon AA, Machado MM, Athayde ML(2014) Technical evaluation of antioxidant activity. Med Chem 4(7), 517-522.
[https://doi.org/10.4172/2161-0444.1000188]

-
Chernukha I, Fedulova L, Vasilevskaya E, Kulikovskii A, Kupaeva N, Kotenkova E(2021) Antioxidant effect of ethanolic onion (Allium cepa) husk extract in ageing rats. Saudi J Biol Sci 28(5), 2877-2885.
[https://doi.org/10.1016/j.sjbs.2021.02.020]

- Choi JH, Lee EB, Park YG, Lee HK, Jang HH, Choe J, Hwang KA, Park SY, Hwang IG, Hong HC, Lee HJ, Jeong HC, Kim HJ, Lee SH(2019) Aged doraji (Platycodon grandiflorum) ameliorates cyclophosphamide-induced immunosuppression in mice. Korean J Pharmacogn 50(3), 219-225.
-
Duan Y, Jin DH, Kim HS, Seong JH, Lee YG, Kim DS, Chung HS, Jang SH(2015) Analysis of total phenol, flavonoid content and antioxidant activity of various extraction solvents extracts from onion (Allium cepa L.) peels. J Korea Oil Chemists’ Soc 32(3), 418-426.
[https://doi.org/10.12925/jkocs.2015.32.3.418]

-
Gulcin I(2020) Antioxidants and antioxidant methods: an updated overview. Arch Toxicol 94(3), 651-715.
[https://doi.org/10.1007/s00204-020-02689-3]

-
Han JK, Kang MS, Lee SC(2018) Total phenolic content and DPPH radical scavenging activity of subcritical water extract of onion, and its effect on alcohol dehydrogenase activity. J Agric Life Sci 52(1), 71-81.
[https://doi.org/10.14397/jals.2018.52.1.71]

-
Hwang JS, Lee BH, An X, Jeong HR, Kim YE, Lee I, Lee H, Kim DO(2015) Total phenolics, total flavonoids, and antioxidant capacity in the leaves, bulbs, and roots of Allium hookeri. Korean J Food Sci Technol 47(2), 261-266.
[https://doi.org/10.9721/KJFST.2015.47.2.261]

-
Jeon SY, Baek JH, Jeong EJ, Cha YJ(2012) Potential of onion peel extract as a functional ingredient for functional foods. J Life Sci 22(9), 1207-1213.
[https://doi.org/10.5352/JLS.2012.22.9.1207]

-
Jeong DS, Back DA, Kwon YR, Kwon GM, Youn KS(2015) Quality characteristics and antioxidant activity of onion peel extracts by extraction methods. Korean J Food Preserv 22(2), 267-274.
[https://doi.org/10.11002/kjfp.2015.22.2.267]

-
Jeong UY, Jung J, Lee EB Choi JH, Kim JS, Jang HH, Park SY, Lee SH(2022) Antioxidant and Immune stimulating effects of Allium hookeri extracts in the RAW 264.7 cells and immune-depressed C57BL/6 mice. Antioxidants 11(10), 1927.
[https://doi.org/10.3390/antiox11101927]

-
Jeong WY, Kim AN, Choi Y, Kim N, Jeong MS, Kim C(2021) Physicochemical characteristics and antioxidative activities of Tenebrio molitor larvae hydrolysates with different extraction methods. Korean J Community Living Sci 32(4), 599-610.
[https://doi.org/10.7856/kjcls.2021.32.4.599]

-
Jo EK, Lee SC(2011) Antioxidant and acetylcholinesterase inhibitory activities of subcritical water extracts from Houttuynia cordata Thunb. J Korean Soc Food Sci Nutr 40(10), 1391-1396.
[https://doi.org/10.3746/jkfn.2011.40.10.1391]

-
Joung EM, Jung KH(2014) Antioxidant activity of onion (Allium cepa L.) peel extracts obtained as onion byproducts. Korean J Food Sci Technol 46(3), 364-368.
[https://doi.org/10.9721/KJFST.2014.46.3.364]

-
Jung J, Lee EB, Kim SH, Choi JH, Kim JS, Kim JH, Jeong UY, Choi H, Lee YS, Lee SH(2022) Antioxidant and immune-enhancing effects of Curcuma longa extracts. J East Asian Soc Diet Life 32(3), 137-148.
[https://doi.org/10.17495/easdl.2022.6.32.3.137]

-
Kang BK, Kim KBWR, Ahn NK, Choi YU, Kim MJ, Bark SW, Pak WM, Kim BR, Park JH, Bae NY, Ahn DH(2015) Anti-inflammatory effect of onion (Allium cepa) peel hot water extract in vitro and in vivo. KSBB J 30(4), 148-154.
[https://doi.org/10.7841/ksbbj.2015.30.4.148]

-
Kim DS, Sung NY, Han IJ, Lee BS, Park SY, Nho EY, Eom J, Kim G, Kim KA(2019) Splenocyte-mediated immune enhancing activity of Sargassum horneri extracts. J Nutr Health 52(6), 515-528.
[https://doi.org/10.4163/jnh.2019.52.6.515]

-
Kim DS, Lim SB(2018) Composition of phenolic compounds and antioxidant activities of subcritical water extracts of onion skin. J Korean Soc Food Sci Nutr 47(4), 403-413.
[https://doi.org/10.3746/jkfn.2018.47.4.403]

-
Kim JE, Kim AR, Kim MJ, Park SN(2011) Antibacterial, antioxidative and antiaging effects of Allium cepa peel extracts. Appl Chem Eng 22(2), 178-184.
[https://doi.org/10.14478/ACE.2011.22.2.178]

-
Kim JH, Kim JS, Kim SH, Jeong SH, Jeong UY, Jung JE, Lee SK, Lee SH(2022) Antioxidant and anti-inflammatory effects of ethanol extract from whole onion (Allium cepa L.) with leaves. Agriculture 12(7), 963.
[https://doi.org/10.3390/agriculture12070963]

-
Kim JS, Lee EB, Choi JH, Jung J, Jeong UY, Bae UJ, Jang HH, Park SY, Cha YS, Lee SH(2023) Antioxidant and immune stimulating effects of Allium cepa skin in the RAW 264.7 cells and in the C57BL/6 mouse immunosuppressed by cyclophosphamide. Antioxidants 12(4), 892.
[https://doi.org/10.3390/antiox12040892]

-
Kim SW, Ko MJ, Chung MS(2019) Extraction of the flavonol quercetin from onion waste by combined treatment with intense pulsed light and subcritical water extraction. J Clean Prod 231(4), 1192-1199.
[https://doi.org/10.1016/j.jclepro.2019.05.280]

-
Ko MJ, Kwon MR, Chung MS(2021) Antioxidant activities of phenolic compounds from Ziziphus jujuba mill extract using subcritical water. Korean J Food Sci Technol 53(3), 329-333.
[https://doi.org/10.9721/KJFST.2021.53.3.329]

-
Lee KA, Kim KT, Nah SY, Chung MS, Cho SW, Paik HD(2011) Antimicrobial and antioxidative effects of onion peel extracted by the subcritical water. Food Sci Biotechnol 20(2), 543-548.
[https://doi.org/10.1007/s10068-011-0076-8]

-
Lee KA, Kim KT, Kim HJ, Chung MS, Chang PS, Park H, Paik HD(2014) Antioxidant activities of onion (Allium cepa L.) peel extracts produced by ethanol, hot water, and subcritical water extraction. Food Sci Biotechnol 23(2), 615-621.
[https://doi.org/10.1007/s10068-014-0084-6]

- Ra KS, Suh HJ, Chung SH, Son JY(1997) Antioxidant activity of solvent extract from onion skin. Korean J Food Sci Technol 29(3), 595-600.
- Rural Development Administration(2022) Onions. In: Agricultural Technology Guide 96. 7th ed. Jeonju-si: Rural Development Administration, pp 10-11.
-
Schaich KM, Tian X, Xie J(2015) Reprint of “hurdles and pitfalls in measuring antioxidant efficacy: a critical evaluation of ABTS, DPPH, and ORAC assays”. J Funct Foods 18(Part B), 782-796.
[https://doi.org/10.1016/j.jff.2015.05.024]

-
Shin J, Park J, Jun W(2020) Effect of hot water extract of Salvia plebeia R. on the production of splenocyte cytokines in mouse. J Korean Soc Food Sci Nutr 49(7), 754-758.
[https://doi.org/10.3746/jkfn.2020.49.7.754]

-
Sohn EH, Yoon JW, Koo HJ, Park DW, Jeong YJ, Namkoong S, Han HS, Kang SC(2012) Immunomodulating effects of red ginseng on the regulation of cytokine release in vivo. Korea J Plant Res 25(5), 578-585.
[https://doi.org/10.7732/kjpr.2012.25.5.578]

- Son JY, Son HS, Cho WD(1998) Antioxidant effect of onion skin extract. Korean J Soc Food Sci 14(1), 16-20.