뿌리채소 혼합물의 항산화 및 항염 효능
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study examined the antioxidant and anti-inflammatory effects of a mixture comprising white radish, shiitake mushroom, Chinese radish (dried), carrot, burdock, lance asiabell, and balloon flower root. Each root vegetable mixture (M1, M2, and M3) was extracted using 80% ethanol. The total polyphenol, total flavonoid, FRAP values, DPPH, and ABTS radical scavenging abilities were measured to evaluate the antioxidant activities of M1, M2, and M3. The results revealed significantly higher levels of total polyphenols and total flavonoids in M3 (74.07 mg TAE/g, 115.82 mg GAE/g) than in M1 or M2. Furthermore, The highest FRAP value was observed in M3, followed by M2 and M1. In addition, the effects of M1, M2, or M3 treatments on nitric oxide (NO) production in Raw 264.7 cells were investigated. The result showed that various concentrations of M1, M2, and M3 significantly inhibited NO production in Raw 264.7 cells compared to treatment with lipopolysaccharide (LPS) alone. These results suggest that root vegetable mixture extracts have promising antioxidant and anti-inflammatory properties, laying the foundation for further exploration.
Keywords:
Root vegetable mixture, antioxidant, anti-inflammationⅠ. 서론
현대인들에게 건강을 위한 균형 잡힌 식단의 제공은 매우 중요하며 이중 채소의 섭취에 대한 중요성을 강조하고, 이를 권장하고 있다(Melbye et al. 2021). 고열량 저 영양 식품의 확산으로 섬유소 섭취 부족과 지방 위주의 식사가 주를 이루고 있으며 이는 만성질환 증가의 원인으로 나타나 채식 섭취에 대한 관심이 더욱 필요한 실정이다. 여러 채소의 종류 중 뿌리채소는 당근, 무, 감자, 참마, 인삼, 셀러리, 파슬리, 고추냉이 등이 있으며 이들은 섬유소와 수분이 충분하고 열량이 낮으며 폴리페놀, 플라보노이드 및 비타민C 등의 함량이 높은 것으로 알려져 있다(Knez et al. 2022).
무(Raphanus sativus L.)는 십자화과에 속하는 초본식물로 뿌리채소 중 수분함량이 가장 높고 열량이 가장 낮으며 항산화력이 뛰어난 것으로 알려져 있다(Gamba et al. 2021). 또한 소화불량, 숙취해소, 진해거담, 해열 소염작용, 이뇨작용, 정장작용과 같은 생리활성을 가지고 있어 항균 및 항암 효능 등이 연구되었다(Lee et al. 2009). 무의 잎 부분인 무청(Brassica rapa)은 건조하여 국이나 나물로 이용하며 35% 이상의 식이섬유와 단백질 및 철분, 칼슘 등을 함유하고 있으며 항산화 및 암 예방 효과 등이 있다고 알려져 있다(Seo et al. 2021). 표고버섯(Lentinus edodes)은 전 세계적으로 널리 이용되는 천연물로 풍부한 폴리페놀성 화합물 및 다당류, 식이섬유, 에르고스테롤, 비타민 B1, B2, C 및 무기질을 포함한 다양한 생리활성물질을 포함하며 항균, 항암, 간 기능 개선 등에 효능이 있는 것으로 보고되었다(Chen et al. 2012). 당근(Daucus carota L.)은 특정 품종에 따라 평균 수분 함량이 69% 이상이며 카로티노이드, 단순당, 셀룰로오스 및 헤미셀룰로오스와 같은 섬유질이 포함되어 있다(Boadi et al. 2021). 또한 당근에는 암세포 성장 억제와 관련된 폴리아세틸렌이 포함되어 있으며 항응고제, 항진균제, 항염증 작용을 하는 것으로 알려져 있다(Olejnik et al. 2016; Rasheed et al. 2022). 우엉(Arctium lappa L.)은 국화과에 속하는 식물로서 원산지는 유럽 및 우리나라를 비롯한 아시아에서 널리 재배되고 있다(Tae et al. 2016). 우엉은 뿌리부위가 식품의 용도로 오랫동안 사용되어 왔으며 고혈압, 통풍, 간염 및 기타 염증성 질환에 대한 효과로 널리 알려져 있고(Predes et al. 2009) 플라보노이드와 리그난 등의 다양한 생리활성물질을 함유하고 있다(Ferracabe et al. 2010). 또한 우엉 뿌리는 caffeoylquinic acid 유도체로 인해 간 보호(Lin et al. 2000), 항염증(Duh 1998) 및 자유 라디칼 제거 활성(Duh 1998)을 가지고 있으며 최근에는 우엉 추출물이 연골 분화를 촉진하는 것으로 보고되었다(Wu et al. 2020). 더덕(Codonopsis lanceolata Trautv.)은 초롱꽃과의 덩굴식물로 한국을 포함한 아시아 지역 등에서 자생하고 봄, 가을에 주로 뿌리를 채취하여 사용한다(Lee et al. 2019). 더덕은 항암, 항비만, 항염증 및 항산화 효과를 가지고 있는 것으로 알려져 있으며(Wang et al. 2011; Cha et al. 2012; Lee et al. 2013; Lee et al. 2014) 탄닌과 triterpenoid 계열의 사포닌(lancemaside A, lancemaside B, lancemaside E, foetidissimoside A) 등을 함유하고 있다(Hossen et al. 2016). 이 중 lancemaside A 성분은 코로나(COVID-19)를 일으키는 변종 바이러스에 대한 항바이러스 작용에 도움이 된다는 연구가 발표되어 기능성식품 소재로서의 가능성을 확인하였다(Kim et al. 2022). 도라지(Platycodon grandiflorum)는 도라지속(Platycodon)에 속하는 여러해살이풀로 사포닌(Guo et al. 2021), 다당류(Hao et al. 2023), 플라보노이드(Nam et al. 2023) 등이 풍부하다. 도라지는 여러 약리적인 효과를 나타내며 기침 억제제(Wang et al. 2022), 간 보호(Kim et al. 2020), 항염증제(Si-Cong et al. 2021), 항암(Yang et al. 2022), 항산화(Kim et al. 2020), 면역 조절(Chan-Zapata et al. 2018) 등이 보고되었다.
현재까지 뿌리채소를 활용한 연구는 무, 무청, 표고버섯, 당근, 우엉, 더덕, 도라지 중 일부를 선택하여 첨가한 부재료로써 사용되어 기존 제품의 품질 향상 및 다양한 생리활성의 변화에 대해 주로 진행되었다. 하지만 다양한 생리활성을 가진 이들 7가지 뿌리채소의 종류 및 혼합비율을 달리하여 그 차이를 확인하고자 한 연구는 아직 미비한 실정이다. 따라서 본 연구는 이들 뿌리채소 혼합물의 에탄올 추출물을 사용하여 항산화 및 항염증 관련 효과를 중심으로 평가하고 기능성 식품 소재로서의 가능성을 나타내는 기초자료로 활용하고자 한다.
Ⅱ. 연구방법
1. 실험재료
본 연구를 위해 사용된 무, 표고버섯, 무청, 당근, 우엉, 더덕, 도라지는 ㈜현대에프앤비(Kwangju, Korea)에서 제공받아 실험에 사용하였다. 이들 모두 이물질이 없도록 세척하고 껍질을 박피한 후 일정한 크기로 절단한 후 40℃~60℃로 열풍 건조기(Daedong, Nonsan, Korea)에서 16시간 이상 건조하였다. 이후 분쇄기(EV-GB 8000 model, Everhome, Seoul, Korea)를 이용하여 분쇄 후 -70℃로 냉동보관하며 사용하였다.
2. 시료추출
Table 1과 같이 무, 표고버섯, 무청, 당근, 우엉, 더덕, 도라지를 각기 다른 비율로 혼합하여 각각의 뿌리채소 혼합물(M1, M2, M3)을 제조하였다. 혼합물 1(M1)의 혼합비율은 무 27%, 표고버섯 20%, 무청 20%, 당근 18%, 우엉 15%이다. 혼합물 2(M2)의 혼합비율은 무 25%, 표고버섯 18%, 무청 18%, 당근 16%, 우엉 14%, 더덕 9%이다. 혼합물 3(M3)의 혼합비율은 무 25%, 표고버섯 18%, 무청 18%, 당근 16%, 우엉 14%, 도라지 9%이다(Table 1). M1, M2, M3의 시료 일정량에 20배 부피의 80% 에탄올 flask에 붓고 환류 냉각관을 장착한 65℃의 heating mentle(Mtops ms-265, Seoul, Korea)을 통해 3시간씩 총 3회 반복 추출하였다. 이후 각각의 뿌리채소 혼합물 추출액을 whatman filterpaper(Whatman No.2)를 사용하여 걸러내고 추출된 여액은 40℃ 수욕 상에서 진공회전농축기를 이용하여 용매 제거 후 감압․농축하여 동결건조하였다. 시료는 사용 전까지 -70℃에 보관하였다.
3. 총 polyphenol 함량
총 polyphenol 함량은 Folin-Demis 법(Folin & Denis 1912)을 응용하여 측정하였다. 1.5 mL tube에 시료 및 농도별 standard 용액 200 μL와 Folin reagent 200 μL을 넣은 후 실온에서 3분간 반응시켰다. 10% NaCO₃ 400 μL을 첨가하여 voltex한 후 암소에서 40분간 반응시켰다. 그 후 UV-spectrophotometer(MPM6, Bio-Rad, Hercules, CA, USA)를 이용하여 750 nm에서 흡광도를 측정하였다. 표준물질은 tannic acid를 이용하여 표준곡선을 그리고 추출물의 총 polyphenol 함량을 산출하였다.
4. 총 flavonoid 함량
총 flavonoid 함량은 Davis 법을 변형한 Chae 등의 방법(2002)에 따라 측정하였다. 1.5 mL tube에 시료 및 농도별 standard 용액 500 μL에 diethylene glycol 500 μL를 첨가한 후 1N NaOH 10 μL을 넣고 37℃ heating block에서 60분 동안을 반응시켰다. 그 후 UV-spectrophotometer (MPM6, Bio-Rad, Hercules, CA, USA)를 이용해 415 nm에서 흡광도를 측정하였다. Rutin을 이용하여 표준곡선을 그리고 추출물의 총 flavonoid 값을 계산하였다.
5. Ferric acid reducing antioxidant power (FRAP) assay
FRAP은 Benzie & Strain(1996)의 방법을 변형하여 측정하였다. 300 mM sodium acetate buffer(pH 3.6)(Sigma-Aldrich, St. Louis, MO, USA) 10 mL, 10 mM 2,4,6-tris(2-pyridyl)- s-triazine(TPTZ) (Sigma-Aldrich, St. Louis, MO, USA) 1 mL, 20 mM ferric chloride (Sigma-Aldrich, Louis, MO, USA) 1 mL를 혼합한 FRAP reagent를 사용하였다. 각각의 시료 10 μL와 증류수 90 μL를 FRAP reagent 200 μL와 혼합하고 UV-spectrophotometer(MPM6, Bio-Rad, Hercules, CA, USA)를 이용하여 595 nm에서 흡광도를 측정한 후 FRAP 값을 계산하였다. 측정값은 표준물질인 FeSO4ㆍ7H2O를 이용하여 만든 검량식에 대입하여 계산하였다.
6. ABTS+ radical 소거능
2,2’-Azinobis-3-ethylbenzo thiazoline-6- sulfonic acid(ABTS) radical 소거능은 Re 등의 방법(1999)을 변형하여 측정하였다. 7 mM ABTS와 2.4 mM potassiun persulfate를 1:1 비율로 섞어 암실에서 24시간 동안 방치하여 radical 생성을 유도하였다. 그 후 7 mM ABTS 통에 2.4 mM potassiun persulfate 10 mL를 주입하였다. UV-spectrophotometer로 750 nm에서 흡광도 값이 0.7 정도가 되도록 메탄올로 희석하여 사용하였다. ABTS+ 라디칼 용액 450 μL와 각 농도별로 제조된 시료를 각 50 μL 혼합하여 37℃에서 30분간 반응시킨 후 UV-spectrophotometer로 750 nm에서 흡광도 측정하였다. IC50 value (half maximal inhibitory concentration value)는 50%의 ABTS+ 라디칼 소거활성을 나타내는 시료의 농도(mg/mL)로 정의하였다.
7. DPPH radical 소거능
2,2-diphenyl-1-picrylhydrazyl(DPPH) radical 소거능은 Blois의 방법(1958)에 따라 다음과 같이 측정하였다. 시료 추출액과 희석한 DPPH 용액을 혼합한 후 37℃ heating block을 이용하여 30분간 반응시켰다. 그 후 UV-spectrophotometer (MPM6, Bio-Rad, Hercules, CA, USA)를 사용하여 595 nm에서 흡광도 측정하여 분석하였다. 시료의 항산화능은 항산화제로 잘 알려진 ascorbic acid(1 mg/mL) 용액과 Butylated Hydroxyanisole (BHA) (1 mg/mL) 용액의 항산화능을 측정한 값과 비교하였다. IC50 value(half maximal inhibitory concentration value)는 50%의 DPPH 라디칼 소거활성을 나타내는 시료의 농도(mg/mL)로 정의하였다.
8. 세포 배양
RAW 264.7 대식세포는 100 units/mL penicillin, 100 μg/mL streptomycin과 10%의 fetal bovine serum(Gibco-BRL, Grand Island, NY, US)이 함유된 Dulbecco’s modified Eagle’s medium (DMEM)을 사용하여 37°C, 5% CO2 incubator에서 배양하였다.
9. Nitric oxide(NO) 생성 측정
NO 소거 활성 측정을 위해 RAW 264.7 세포를 24 well plate에 분주하여 6시간 경과 후 lipopolysaccharide(LPS) 0.5 μg/mL와 M1, M2, M3 혼합추출물을 혼합 처리 후 24시간 배양하였다. 배양 상층액 내의 NO 생성은 Greiss 시약[0.1%(w/v) N-(1-naphathyl)-ethylenediamine, 1%(w/v) sulfanilamide in 5%(v/v) phosphoric acid]과 세포 상등액을 반응시킨 후 UV-spectrophotometer(MPM6, Bio-Rad, Hercules, CA, USA)를 이용하여 570 nm에서 흡광도를 측정하였다. 세포로부터 생성된 NO의 함량은 nitrite를 사용하여 작성한 표준 검량곡선에 대입하여 산출하였다.
10. 통계처리
본 연구에서 실행한 모든 실험은 독립적으로 3회에 걸쳐 반복 시행하였으며 측정결과는 평균(mean)과 표준편차(standard deviation, SD)로 나타내었고, GraphPad Prism 6 program (GraphPad Software, Inc., La Jolla, CA, USA)을 이용하여 각 실험군 간의 유의성을 증명하였다. p<0.05 수준으로 일원배치 분산분석(one-way analysis of variance)을 실시한 후 Tukey’s multiple range test법에 따라 각 시료 간의 통계적 유의성을 조사하였다.
Ⅲ. 결과 및 고찰
1. 총 polyphenol, 총 flavonoid 함량 및 FRAP 환원력 분석
뿌리채소의 종류 및 비율을 달리 한 세 가지 혼합 에탄올 추출물의 총 polyphenol 및 총 flavonoid 함량은 Table 2와 같다. M1의 총 polyphenol 함량은 66.94 mg TAE/g이며 총 flavonoid 함량은 96.55 mg RE/g을 나타내었다. M2의 총 polyphenol 함량은 69.59 mg TAE/g이며 총 flavonoid 함량은 92.39 mg RE/g로 측정되었다. 도라지 성분을 포함한 M3은 다른 뿌리채소 혼합 추출물에 비해 총 polyphenol 및 총 flavonoid 함량이 각각 74.07 mg TAE/g, 115.82 mg RE/g로 높게 나타났으며 M1 및 M2와 비교하여 유의적인 차이를 나타내었다. Lee et al.(2013)의 연구에 의하면 흑도라지를 이용한 총 polyphenol 및 총 flavonoid 함량은 각각 28.38 mg/g과 5.38 mg/g으로 나타났다. 표고버섯 에탄올 추출물을 이용한 총 polyphenol 및 총 flavonoid 함량은 각각 2.12 mg/g과 0.35 mg/g으로 보고하였다(Han et al. 2015). Kim et al. (2014)은 우엉의 총 polyphenol 및 총 flavonoid 함량은 각각 0.96 mg/g과 5.01 mg/g으로 측정되었으며, 당근의 총 polyphenol 및 총 flavonoid 함량은 각각 101.45 mg/g과 8.42 mg/g으로(Park et al. 2022) 나타났다. 이러한 결과를 토대로 본 연구와 비교하였을 시 단일 뿌리채소보다 뿌리채소 혼합물에 의한 총 polyphenol 및 총 flavonoid 함량이 더 높은 것으로 확인되었다.
FRAP value의 측정은 낮은 pH에서 환원제에 의해 ferric tripyridyltriazine(Fe3+-TPTZ) 복합체가 파란색의 ferrous tripyridyltriazine(Fe2+- TPTZ)으로 환원되는 원리를 이용한 측정법이다(Gulcin 2020). 세 가지 다른 비율의 뿌리채소 혼합물에 대한 FRAP 환원력을 분석한 결과는 Table 2와 같다. M1, M2, M3의 FRAP 환원력을 비교한 결과, 각각 22.69 μM, 26.96 μM, 35.77 μM으로 나타났다. M1에 비해 M2의 FRAP 환원력이 증가하였으나 통계적 유의차는 없었으며 M3 추출물이 M1과 M2에 비해 유의적으로 증가한 것을 확인하였다. Sánchez-González et al.(2005)의 연구에 의하면 높은 폴리페놀 함량과 FRAP value는 밀접한 상관관계가 있다고 보고하였으며, 본 연구에서 M3 추출물이 다른 추출물에 비해 높은 폴리페놀 함량이 관찰되어 FRAP 환원력에 영향을 미친 것으로 사료된다.
2. ABTS+ radical 소거능
ABTS radical 소거능은 ABTS 용액과 과황산칼륨과의 반응에 의해 생성된 ABTS 양이온이 추출물의 항산화력에 의해 ABTS 양이온 고유의 색인 청록색이 탈색되어 decolorization 되는 원리를 이용한 측정방법이다(Gulcin 2020). 뿌리채소의 종류 및 비율을 달리 한 세 가지 혼합추출물의 ABTS+ radical 소거능은 Table 3과 같다. 각 뿌리채소 혼합추출물의 ABTS+ radical 소거능은 농도 의존적으로 증가함을 보였으며 2.00 mg/L 농도에서의 각각 67.70%, 84.58%, 84.77%로 나타났다. 또한 IC50 값은 M1이 1.42 mg/mL M2가 0.92 mg/mL, M3가 0.79 mg/mL로 측정되어 M3 추출물이 다른 추출물보다 ABTS+ radical 소거 활성이 높았음을 확인하였다. Park et al. (2022)의 연구에 의하면 당근의 ABTS+ radical 소거능은 2.00 mg/L 농도에서 26.80%로 보고하였다. 또한 순무 및 월동무 0.2 mg/mL에서 각각 31.72%, 28.34%를 나타내어 본 연구와 다소 차이를 보였다(Hwang et al. 2021).
3. DPPH radical 소거능
DPPH radical은 에탄올에서 보라색 용액을 생성하는 자유 라디칼로 항산화 활성을 갖은 물질과 반응하면 수소 전자를 받아 환원되어 DPPH radical은 감소하고 무색의 에탄올이 되는 원리를 이용한 비교적 간편하고 빠르게 측정할 수 있는 항산화능 측정법이다(Gulcin 2020). 세 가지 다른 비율의 뿌리채소 혼합추출물에 대한 DPPH 라디칼 소거능을 분석한 결과는 Table 4와 같다. M1. M2, M3 추출물은 2.00 mg/L 농도에서 DPPH radical 소거능이 각각 81.23%, 89.71%, 89.71%로 나타났다. 또한 각각의 IC50 값은 1.26 mg/mL 1.02 mg/mL, 1.00 mg/mL로 측정되었다. M2와 M3의 경우에는 1.00 mg/mL의 농도에서 합성 항산화제인 BHA와 유사한 DPPH 라디칼 소거능을 확인할 수 있었다. Hwang et al.(2021)의 연구에 의하면 순무 및 월동무(0.2 mg/mL)의 경우 DPPH 라디칼 소거능은 각각 31.44%, 26.89%로 나타났다. 또한 국화과에 속하는 볶음 처리한 우엉과 돼지감자의 DPPH radical 소거능의 IC50 값은 12.99 mg/mL와 19.74 mg/mL, 로 보고하였다(Lee 2016). 도라지 추출물이나 사포닌 및 phenylpropanoid ester 성분은 DPPH radical 소거 능 등의 항산화에 효능이 있음이 보고되었으며(Lee et al. 2004; Fu et al. 2009) 이러한 물질들이 결과에 영향을 준 것으로 추정된다. 따라서 이러한 결과를 바탕으로 본 뿌리채소 혼합추출물의 사용은 인체 내에서 활성 라디칼의 억제에 효과적일 것으로 사료된다.
4. NO assay
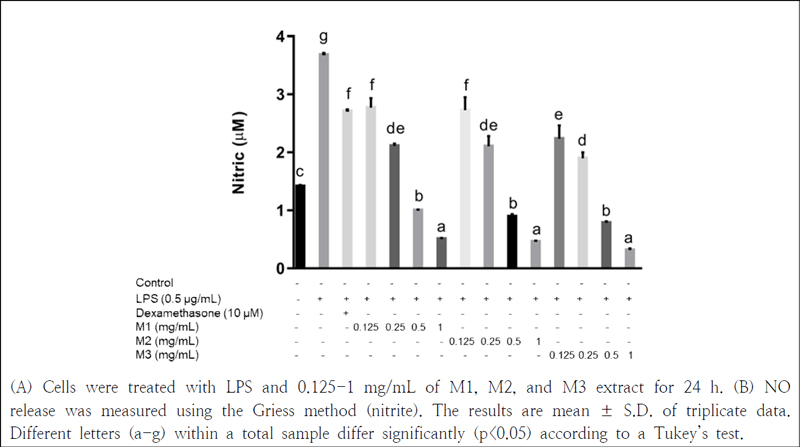
Nitric oxide(NO)는 정상적인 발현 시 종양 억제, 신경전달물질 운반 등의 다양한 역할을 하나 과발현시에는 신체에 여러 염증 유발, 신경 및 조직 손상, 유전자 변이 등의 영양을 주는 것으로 알려져 있다(Jung et al. 2010). 본 연구에서는 세 가지 다른 비율의 뿌리채소 혼합추출물에 대한 항염증 활성을 측정하기 위하여 RAW 264.7 세포에 LPS를 처리하여 세포 내의 NO 생성을 유도한 후 추출물을 처리하여 NO 합성에 미치는 영향을 관찰하였다. LPS 처리로 NO 생성을 유도한 후 M1, M2, M3 추출물을 각 농도별로 처리한 결과, NO 합성이 LPS 단독 처리한 군보다 모두 유의적으로 감소하였다(Fig. 1). Sim et al.(2010)의 연구에서 NO 생성을 측정한 결과 LPS를 처리한 군에서 NO의 농도는 19.53 μM이었으나 무, 당근, 무청, 우엉 및 표고버섯을 이용한 야채수프를 처리한 실험군은 15.54 μM로 NO 생성이 억제되는 것을 보고하였다. 더덕 잎추출물을 이용한 Sim et al. (2010)의 연구에서 62.5, 125 및 250 μg/mL에서 각각 73, 90, 99%의 NO생성 저해활성을 나타내었다. 본 연구 결과 M1, M2, M3 추출물은 LPS로 유도된 RAW 264.7 세포에 대해 NO 생성 억제 효과가 있는 것으로 나타나 염증조절제로서의 가능성을 확인할 수 있었다.
Ⅳ. 요약 및 결론
본 연구에서는 뿌리채소(무, 무청, 표고버섯, 당근, 우엉, 더덕, 도라지)의 성분 및 혼합비율을 달리한 80% 에탄올 추출물(M1, M2, M3)의 항산화 및 항염증 효과를 비교하고자 하였다. 총 polyphenol과 flavonoid 함량은 M1과 M2에 비해 도라지를 함유한 M3 추출물이 유의적으로 높은 함량을 나타내었다. FRAP 활성의 경우 M1과 M2 추출물 사이에 유의적인 차이가 없었으나 M3 추출물은 이들에 비해 유의적으로 높은 값을 나타내었다. ABTS+ radical 소거능과 DPPH radical 소거능의 경우도 M1과 M2에 비해 M3 추출물의 항산화능이 우수한 것으로 나타났다. RAW 264.7 대식세포의 NO 생성을 관찰한 결과, M1, M2, M3 추출물은 0.125~1 mg/mL의 농도에서 40~ 91%의 억제율을 나타내었다. 위와 같은 결과로 무, 무청, 표고버섯, 당근, 우엉, 더덕, 도라지의 뿌리채소를 이용한 혼합물의 에탄올 추출물은 항산화 및 항염증 효과가 우수함을 확인하였으며, 추가적인 연구를 통하여 기능성 식품 소재로 활용할 수 있을 것으로 판단된다.
References
-
Benzie IF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay(1996) Anal Biochem 239(1), 70-76.
[https://doi.org/10.1006/abio.1996.0292]

-
Blois MS(1958) Antioxidant determination by the use of a stable free radical. Nat 181, 1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Boadi NO, Badu M, Kortei NK, Saah SA, Annor B, Mensah MB, Okyere H, Fiebor A(2021) Nutritional composition and antioxidant properties of three varieties of carrot (Daucus carota). Sci Afr 12, e00801.
[https://doi.org/10.1016/j.sciaf.2021.e00801]

-
Cha A, Choi Y, Jin Y, Sung MK, Koo YC, Lee KW, Park T(2012) Antilipogenic and anti-inflammatory activities of Codonopsis lanceolata in mice hepatic tissues after chronic ethanol feeding. J Biomed Biotechnol 141395.
[https://doi.org/10.1155/2012/141395]

-
Chan-Zapata I, Canul-Canche J, Fernandez-Martin K, Martin-Quintal Z, Torres-Romero JC. Lara-Riegos JC, Arana-Argaez VE(2018) Immunomodulatory effects of the methanolic extract from Pouteria campechiana leaves in macrophage functions. Food and Agricult Immunology 29(1), 386-399.
[https://doi.org/10.1080/09540105.2017.1386163]

-
Chen H, Ju Y, Li J, Yu M(2012) Antioxidant activities of polysaccharides from Lentinus edodes and their significance for disease prevention. Int J Biol Macromol 50(1), 214-218.
[https://doi.org/10.1016/j.ijbiomac.2011.10.027]

-
Duh P(1998) Antioxidant activity of burdock (Arctium lappa Linne): its scavenging effect on free-radical and active oxygen. J Am Oil Chem Soc 75(4), 455-461.
[https://doi.org/10.1007/s11746-998-0248-8]

-
Ferracane R, Graziani G, Gallo M, Fogliano V, Ritieni A(2010) Metabolic profile of the bioactive compounds of burdock (Arctium lappa) seeds, roots and leaves. J Pharm Biomed Anal 51(2), 399-404.
[https://doi.org/10.1016/j.jpba.2009.03.018]

- Folin O, Denis W(1912) On phosphotungastic-phosphomolybdic compounds as color regents. J Biol Chem 12(2), 239-249.
-
Fu XJ, Liu HB, Wang P, Guan HS(2009) A study on the antioxidant activity and tissues selective inhibition of lipid peroxidation by saponins from the roots of Platycodon grandiflorum. Am J Chin Med 37(5), 967-975.
[https://doi.org/10.1142/S0192415X09007375]

- Gamba M, Asllanaj E, Raguindin PF, Glisic M, Franco OH, Minder B, Bussler W, Metzger B, Kern H, Muka T(2021) Nutritional and phytochemical characterization of radish (Raphanus sativus): a systematic review. Trends Food Sci Technol 113, 205-218.
-
Gulcin I(2020) Antioxidants and antioxidant methods: an updated overview. Arch Toxicol 94(3), 651-715.
[https://doi.org/10.1007/s00204-020-02689-3]

-
Guo R, Meng Q, Wang B, Li F(2021) Anti-inflammatory effects of Platycodin D on dextran sulfate sodium (DSS) induced colitis and E. coli Lipopolysaccharide (LPS) induced inflammation. Int Immunopharmac 94, 107474.
[https://doi.org/10.1016/j.intimp.2021.107474]

-
Han SR, Kim MJ, Oh TJ(2015) Antioxidant activities and antimicrobial effects of solvent extracts from lentinus edodes. J Korean Soc Food Sci Nutr 44(8), 1144-1149.
[https://doi.org/10.3746/jkfn.2015.44.8.1144]

-
Hao M, Song J, Zhai X, Cheng N, Xu C, Gui S, Chen J(2023) Improvement of loperamide-hydrochloride-induced intestinal motility disturbance by Platycodon grandiflorum polysaccharides through effects on gut microbes and colonic serotonin. Front Cell Infect Microbiol 13, 1105272.
[https://doi.org/10.3389/fcimb.2023.1105272]

-
Hossen MJ, Kim MY, Kim JH, Cho JY(2016) Codonopsis lanceolata: a review of its therapeutic potentials. Phytother Res 30(3), 347-356.
[https://doi.org/10.1002/ptr.5553]

-
Hwang KA, Hwang HJ, Hwang YJ(2021) Antioxidant effect of raphanus sativus L. through the suppression of reactive oxygen species production. J Korean Soc Food Sci Nutr 50(11), 1145-1151.
[https://doi.org/10.3746/jkfn.2021.50.11.1145]

- Jung JY, Lee JR, Byun SH, Jung JW, Kim YH, Kim SC(2010) Inhibitory effect of Dioscorea bulbifera MeOH extract on pro-inflammatory mediator in vitro and in vivo. J Physiol Pathol Korean Med 24(2), 310-318.
-
Kim MS, Lee YS, Sohn HY(2014) Anti-thrombosis and anti-oxidative activity of the root of Arctium lappa L. Korean J Food Preserv 21(5), 727-734.
[https://doi.org/10.11002/kjfp.2014.21.5.727]

-
Kim SR, Park EJ, Dusabimana T, Je J, Jeong K, Yun SP, Kim HJ, Cho KM, Kim H, Park SW(2020) Platycodon grandiflorus Fermented Extracts Attenuate Endotoxin-Induced Acute Liver Injury in Mice. Nutr 12(9), 2802.
[https://doi.org/10.3390/nu12092802]

-
Kim TY, Jeon S, Ko M, Du YE, Son SR, Jang DS, Kim S, Lee CJ(2022) Lancemaside a from Codonopsis lanceolata: studies on antiviral activity and mechanism of action against SARS-CoV-2 and its variants of concern. Antimicrob Agents Chemother 66(12), e0120122.
[https://doi.org/10.1128/aac.01201-22]

-
Kim TY, Yoon E, Lee D, Imm JY(2020) Antioxidant and anti-inflammatory activities of Platycodon grandiflorum seeds extract. CyTA-J Food 18(1), 435-444.
[https://doi.org/10.1080/19476337.2020.1770336]

-
Knez E, Kadac-Czapska K, Dmochowska-Ślęzak K, Grembecka M(2022) Root Vegetables-Composition, Health Effects, and Contaminants. Int J Environ Res Public Health 19(23), 15531.
[https://doi.org/10.3390/ijerph192315531]

-
Lee JS, Kim KJ, Kim YH, Kim DB, Shin GH, Cho JH, Kim BK, Lee BY, Lee OH(2014) Codonopsis lanceolata extract prevents diet-induced obesity in C57BL/6 mice. Nutr 6(11), 4663-4677.
[https://doi.org/10.3390/nu6114663]

-
Lee JY, Hwang WI, Lim ST(2004) Antioxidantand anticancer activities of organic extracts from Platycodongrandiflorum A. De Candolle roots. J Ethnopharmacol 93(2-3), 409-415.
[https://doi.org/10.1016/j.jep.2004.04.017]

-
Lee MJ, Nam JH, Um IE, Kang CK, Rho IR(2019) Determination the optimum extraction method for saponin lancemasides in Codonopsis lanceolata. Korean J Food Sci Technol 51(2), 103-108.
[https://doi.org/10.9721/KJFST.2019.51.2.103]

-
Lee SH, Hwang IG, Lee YR, Joung EM, Jeong HS, Lee HB(2009) Physicochemical characteristics and antioxidant activity of heated radish (Raphanus sativus L.) extracts. J Korean Soc Food Sci Nutr 38(4), 490-495.
[https://doi.org/10.3746/jkfn.2009.38.4.490]

-
Lee SJ, Bang WS, Hong JY, Kwon OJ, Shin SR, Yoon KY(2013) Antioxidant and antimicrobial activities of black Doraji (Platycodon grandiflorum). Korean J Food Preserv 20(4), 510-517.
[https://doi.org/10.11002/kjfp.2013.20.4.510]

-
Lee YJ, Kim DB, Lee JS, Cho JH, Kim BK, Choi HS, Lee BY, Lee OH(2013) Antioxidant activity and anti-adipogenic effects of wild herbs mainly cultivated in Korea. Molecules 18(10), 12937-12950.
[https://doi.org/10.3390/molecules181012937]

-
Lee YR(2016) Analysis of nutritional components and antioxidant activity of roasting Wooung (Burdock, Arctium lappaL.) and Jerusalem Artichoke (Helianthus tuberosus L.). Korean J Food Nutr 29(6), 870-877.
[https://doi.org/10.9799/KSFAN.2016.29.6.870]

-
Lin S, Chung T, Lin C, Ueng T, Lin Y, Lin S, Wang L(2000) Hepatoprotective effects of Arctium lappa on carbon tetrachloride-and acetaminophen-induced liver damage. Am J Chin Med 28(2), 163-173.
[https://doi.org/10.1142/S0192415X00000210]

-
Melbye EL, Hausken-Sutter SE, Lien N, Bjelland M(2021) Adolescent vegetable consumption: the role of socioemotional family characteristics. Public Health Nutr 24(17), 571-5719.
[https://doi.org/10.1017/S1368980021001658]

-
Nam YH, Kim EB, Kang JE, Kim JS, Jeon Y, Shin SW, Kang TH, Kwak JH(2023) Ameliorative effects of flavonoids from platycodon grandiflorus aerial parts on Alloxan-induced pancreatic islet damage in zebrafish. Nutr 15(7), 1798.
[https://doi.org/10.3390/nu15071798]

-
Olejnik A, Kowalska K, KidońM, Czapski J, Rychlik J, Olkowicz M, Dembczyński R(2016) Purple carrot anthocyanins suppress lipopolysaccharide-induced inflammation in the co-culture of intestinal Caco-2 and macrophage RAW264.7 cells. Food Funct 7(1), 557-564.
[https://doi.org/10.1039/c5fo00890e]

- Park YJ, Han SY, Lee JJ(2022) Comparison of the nutrition composition and antioxidant activity of carrots and parsnips. Korean J Community Living Sci 33(1), 83-99.
-
Predes F, Matta S, Monteiro J, Oliveira T(2009) Investigation of liver tissue and biochemical parameters of adult wistar rats treated with Arctium lappa L. Braz Arch Biol Technol 52(2), 335-340.
[https://doi.org/10.1590/S1516-89132009000200010]

-
Rasheed H, Shehzad M, Rabail R, Kowalczewski PŁ, KidońM, Jeżowski P, Ranjha MMAN, Rakha A, Din A, Aadil RM(2022) Delving into the nutraceutical benefits of purple carrot against metabolic syndrome and cancer: a review. Appl Sci 12(6), 3170.
[https://doi.org/10.3390/app12063170]

- Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C(1999) Antioxidant activity applying an improved ABTS radial cation decolorization assay. Free Radic Biol Med 26(9-10), 1231-1237.
- Sánchez-González I, Jiménez-Escrig A, Saura-Calixto F(2005) In vitro antioxidant activity of coffees brewed using different procedures (Italian, espresso and filter). Food Chem 90(1), 133-139.
-
Seo YH, Son MG, Park J(2021) Physiological activity and development of a beverage from radish leaves. J East Asian Soc Diet 31(4), 250-257.
[https://doi.org/10.17495/easdl.2021.8.31.4.250]

- Si-Cong L, Chaoqin R, Ge L, Xu-Ting L, Jin-Liang L, Bin W, Min Z, Wei H, Liang C, Xue G(2021) Platycodon grandiflorum extract attenuates lipopolysaccharide-induced acute lung injury via TLR4/NF-κBp65 pathway in rats. Pak J Pharm Sci 34(6), 2213-2218.
-
Sim JG, Lee JH, Shin TY, Shin HY, Jeong SH, Kim MH, Ku HJ, Park JS(2010) Anti-inflammatory effects of vegetable soup in murine macrophage RAW 264.7 cells. J Korean Soc Food Sci Nutr 39(8), 1097-1101.
[https://doi.org/10.3746/jkfn.2010.39.8.1097]

-
Tae MH, Kim KH, Yook HS(2016) Quality characteristics of castella with burdock (Arctium lappa L.) powder. J Korean Soc Food Sci Nutr 45(2), 215-221.
[https://doi.org/10.3746/jkfn.2016.45.2.215]

-
Wang L, Xu ML, Hu JH, Rasmussen SK, Wang MH(2011) Codonopsis lanceolata extract induces G0/G1 arrest and apoptosis in human colon tumor HT-29 cells--involvement of ROS generation and polyamine depletion. Food Chem Toxicol 49(1), 149-154.
[https://doi.org/10.1016/j.fct.2010.10.010]

-
Wang Z, Li C, He X, Xu K, Xue Z, Wang T, Xu Z, Liu X(2022) Platycodon grandiflorum root fermentation broth reduces inflammation in a mouse IBD model through the AMPK/NF-κB/NLRP3 pathway. Food Funct 13(7), 3946-3956.
[https://doi.org/10.1039/d1fo03969e]

-
Wu KC, Weng HK, Hsu YS, Huang PJ, Wang YK(2020) Aqueous extract of Arctium lappa L. root (burdock) enhances chondrogenesis in human bone marrow-derived mesenchymal stem cells. BMC Complement Med Ther 20(1), 364.
[https://doi.org/10.1186/s12906-020-03158-1]

-
Yang R, Pei T, Huang R, Xiao Y, Yan J, Zhu J, Zheng C, Xiao W, Huang C(2022) Platycodon grandiflorum triggers antitumor immunity by restricting PD-1 expression of CD8+ T cells in local tumor microenvironment. Front Pharmacol 13:774440.
[https://doi.org/10.3389/fphar.2022.774440]