녹차박 추출물의 생리활성 및 세포 생존율에 대한 영향 평가
This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Abstract
This study compared the physicochemical properties, physiological activities, and the effect on cell viability of green tea residue (GTR) extract with green tea (GT) and confirmed the potential of GTR as a functional food material. Significant differences were observed in the physicochemical properties between the GTR and GT extracts. The pH was higher in GTR, while the salinity and sweetness were higher in GT compared to GTR. In terms of color, the L and a values were higher in GTR than in GT, whereas the b and ΔE values were significantly higher in GT compared to GTR. Although GTR had lower total polyphenol and flavonoid contents than GT, the contents of GTR showed a gradual increase as the concentrations increased. A comparison of the antioxidant activities of GTR and GT revealed GTR to have similar DPPH and ABTS radical scavenging activities to GT at concentrations of 50, 75, and 100 mg/ml. The reducing power and lipase inhibitory activities of GTR were lower than those of GT, but GTR exhibited higher SOD-like activity at all concentrations than GT. In addition, GTR showed higher cell viability of Raw 264.7 at all concentrations than GT. These results provide fundamental information on using GTR as a functional food material and suggest that recycling food waste can contribute to sustainable resource development.
Keywords:
green tea, tea residue, upcycling, antioxidant activity, functional foodⅠ. 서론
녹차는 Camellia sinensis 식물의 잎을 덖은 후 용출하여 음용하는 전통적인 음료로(Miyoshi et al. 2015), 오랜 역사를 가지고 있으며 주로 동아시아 국가에서 널리 소비되어 왔다(Hicks 2009). 녹차는 한국, 태국 등 다양한 아시아 국가에서 선호도가 높았으나 최근 특유의 맛과 향 그리고 다양한 건강상의 이점으로 인해 서양권에서도 선호도가 증가하는 추세이다(Lee et al. 2010). 농식품수출정보 자료에 따르면 2019년 기준 유럽에서 녹차 소비량이 가장 큰 나라는 프랑스(연 1.6억 달러), 독일(연 1.4억 달러), 영국(연 8.9천만 달러), 폴란드(연 8.6천만 달러) 순으로, 위 네 나라의 각국 녹차 소비량은 한국(연 7.7천만 달러)보다 높은 것으로 나타나고 있다(Kati 2020). 또한 녹차를 첨가한 식음료 제품에 대한 소비자 선호도 조사에 따르면, 응답자의 53%가 녹차 분말이 함유된 제품의 맛을 선호하는 것으로 나타났다(Trimo et al. 2021). 이러한 연구 결과는 녹차를 기반으로 한 식음료 제품 시장의 가치와 함께 건강을 중시하는 소비 트렌드와 맞물려 녹차의 소비가 꾸준히 증가하고 있음을 시사한다.
인체의 건강에 미치는 녹차의 긍정적인 영향은 주로 녹차에 포함된 카테킨, 폴리페놀, 플라보노이드, 카페인, 아미노산 등 다양한 생리활성 성분들이 중요한 역할을 하기 때문이다(Chacko et al. 2010). 녹차에 포함된 대표적인 성분인 카테킨류에 속하는 에피갈로카테킨 갈레이트(Epigallocatechin gallate, EGCG)는 활성산소와 세포를 손상 시키는 자유 라디칼을 효과적으로 제거하는 효능을 가지고 있다(Farhan 2022). 또한, 녹차의 카테킨과 카페인은 지방산 산화 촉진 및 지방 합성을 억제하여 체내 지방분해 과정을 촉진시켜 체중 감소에도 효과적이다(Kwak & Shin 2022). 더불어, 녹차에 포함된 플라보노이드 성분은 혈중 LDL(저밀도 지단백) 콜레스테롤의 산화를 억제하여 동맥 내 콜레스테롤 축적과 동맥경화 발생을 감소시키는 데 기여한다(Miura et al. 2001). 이 외에도 녹차는 심혈관 질환 예방(Pullikotil et al. 2011), 암 발생률 저하(Ohishi et al. 2016), 집중력 강화(Ikar & Sable 2023), 신경 안정(Saeed et al. 2017) 및 신경보호 효과(Unno et al. 2016) 등 다양한 효과를 나타내며 녹차는 건강 증진 음료로서의 가치를 인정받고 있다(Gaur & Agnihotri 2014).
그러나 녹차의 소비가 증가하는 현상은 녹차 제조 과정에서 발생하는 차 잎의 부산물인 녹차박의 양도 함께 증가하는 결과로 이어진다. 녹차박은 다양한 유용 성분을 함유하고 있음에도 불구하고(Lai et al. 2020), 대부분 폐기되거나 제한적으로만 활용되고 있다(Verrillo et al. 2020). 이는 자원의 낭비일 뿐만 아니라 환경에도 부담을 주는 요인이다. 최근에는 녹차박을 활용하여 친환경 에너지 개발(Basumatary et al. 2018; Tunklová et al. 2022). 가축의 사료(Ding et al. 2020; Guo et al. 2023), 비료(Gunatilake 2016)를 제조하는 등 다양한 방면에서 폐기물인 녹차박을 재활용해 환경을 보호하고 경제적 가치를 창출하는 연구가 진행되고 있다. Tunklová et al.(2022)의 연구에서는 녹차박을 350°C의 온도로 가열하는 열처리 과정을 거쳐 바이오차로 전환하는 연구가 수행되었다. 유사한 연구로 한 녹차 공장에서는 녹차 폐기물을 400°C~700°C에서 열분해하여 바이오차와 바이오 오일을 생산하였으며 바이오차는 토양의 성질 개선 및 미생물 활동을 촉진시켜 식물 생장에 긍정적인 영향을 주어 토양 개량제로서의 가능성을 제공하며 바이오 오일은 화석 연료와 유사한 에너지 밀도를 가지고 있어 화석 연료의 대체재로서의 가능성을 제시하며 환경 친화적인 대안으로 주목받고 있다(Basumatary et al. 2018). Ding et al.(2020)의 연구에 따르면 가축 사료 제조 시 녹차박을 첨가하면 녹차박이 돼지의 성장 촉진, 소화 및 항산화 능력 향상에 긍정적인 영향을 미치는 것으로 나타났다. 유사한 연구로 Guo et al.(2023)의 연구에서는 양의 사료에 녹차박 첨가 시, 양의 성장 촉진, 장내 미생물 군집 구조가 최적화 되었으며, 항산화 능력이 유의미하게 향상된 것으로 나타났다. 또한, 녹차박을 활용한 유기 비료 개발에 관한 연구에서는 녹차박 비료가 토양 질 개선 및 작물 성장 촉진에 유의미한 효과가 있음을 확인하였다(Gunatilake 2016).
이처럼 녹차박은 다양한 상업적 이윤 및 환경문제 해결에 기여할 수 있는 자원으로 재인식되고 있으나, 녹차박을 활용한 건강 기능성 식품 연구는 현재 미흡한 실정이다. 본 연구는 녹차박을 녹차와 비교하여 인체에 긍정적인 생리활성을 가지고 있는지, 그리고 녹차박을 건강 기능성 식품 원료로 활용할 수 있는 가능성을 평가하기 위해 수행되었다. 본 연구를 통해 녹차박의 건강 기능성 식품으로서의 가치를 재인식하고 이를 활용한다면, 지속 가능한 식품 폐기물 활용 확대에 기여할 수 있을 것이다.
Ⅱ. 연구방법
1. 실험 재료
본 실험에서 사용한 녹차(Greennatural, Mokpo, Korea)는 원산지가 전라남도 보성군인 것을 온라인에서 구매하여 사용하였다. 녹차는 제품 매뉴얼에 따라 물 2 L에 녹차 20 g을 첨가하여 30분간 끓인 후 녹차 잎을 제거 후 사용하였다. 녹차박은 녹차 제조 후 남겨진 찌꺼기를 건져내어 식품 건조기(ZFD-C301, Zaigle, Seoul, Korea)를 이용해 55°C에서 8시간 열풍건조하여 사용하였다. 건조된 녹차박은 식품 분쇄기(M 20, IKA-WERKE, Staufen, Germany)로 30초간 분쇄하여 분말화한 후 녹차박 분말 5 g의 10배에 해당하는 물 50 mL를 첨가하여 끓는 순간부터 30분간 가열하여 열수추출을 진행하였다. 추출이 완료된 시료는 원심분리기(Avanti JXN-30, Beckman Coulter, Brea, USA)를 이용해 5℃에서 27,000 rpm으로 20분간 원심분리한 뒤 상등액을 녹차박 추출물로 실험에 사용하였다.
2. pH, 당도, 염도 및 색도
녹차와 녹차박 추출물의 pH는 pH meter(pH-200L, Istek, Seoul, Korea)를 이용하여 측정하였고, 당도는 굴절 당도계(N-1E Brix 0-32%, Atago, Tokyo, Japan)로 측정 후 °Brix 값으로 나타내었다. 염도는 Salt-meter(S/N 86024, ATAGO, Tokyo, Japan)를 이용하여 측정하였고 단위는 %(w/w)로 나타내었다. 색도 측정은 색차계(CM-700d, Konica Minolta, Tokyo, Japan)로 측정하였고 명도(L-value, lightness), 적색도(a-value, redness), 황색도(b-value, yellowness), Total color difference(ΔE) 값으로 나타내었다. 색도 측정 시 기기보정을 위해 사용된 백색판의 L, a, b 값은 각각 99.35, -0.13, 0.08이며 백색판과 비교한 녹차와 녹차박 추출물의 total color difference(ΔE) 값은 다음의 식으로 계산하였다.
3. 총 폴리페놀 함량 측정
총 폴리페놀 함량은 Velioglu et al.(1998)의 방법을 참조하여 측정하였다. 녹차와 녹차박 추출물 0.05 mL에 2% Na₂CO₃(Daejung Chemicals & Metals, Siheung, Korea) 5 mL를 혼합한 후 상온에서 30분간 반응시켰다. 반응 이후 50% Folin-Ciocalteu’s reagent(Junsei Chemical, Tokyo, Japan)를 0.05 mL 추가 혼합 후 상온에서 30분간 반응시켜 750 nm에서 Microplate spectrophotometer(Multiskan SkyHigh, Thermo Fisher Scientific, Jurong, Singapore)로 흡광도를 측정하였다. 총 폴리페놀 함량은 표준물질 ferulic acid(Sigma-Aldrich, St. Louis, USA)로 표준 곡선을 구하여 ferulic acid 당량(ferulic acid equivalent, FAE)으로 환산하여 나타내었다.
4. 총 플라보노이드 함량 측정
총 플라보노이드 함량은 Davis(1947)의 방법을 참조하여 측정하였다. 먼저, 녹차 및 녹차박 추출물 0.1 mL를 diethylene glycol(Daejung Chemicals & Metals) 1 mL 및 1N NaOH(Daejung Chemicals & Metals) 0.1mL와 혼합 후 37°C incubated shaker(ISS-4075R, Jeiotech, Daejeon, Korea)에서 1시간 동안 반응시켜 420 nm에서 흡광도를 측정하였다. 총 플라보노이드 함량은 표준물질 quercetin(Sigma-Aldrich)로 표준 곡선을 구하여 quercetin 당량(quercetin equivalent, QE)으로 환산하여 나타내었다.
5. DPPH radical 소거능 측정
DPPH radical 소거능은 Blois(1958)의 방법을 참조하여 측정하였다. 녹차 및 녹차박 추출물 0.1mL에 0.4mM DPPH(Sigma-Aldrich) 용액 1 mL를 첨가 후 30분 동안 암소에서 반응시켜 517 nm에서 흡광도를 측정하였다. 표준물질로는 trolox(Sigma-Aldrich)를 이용하여 표준 곡선을 구하였고, DPPH radical 소거능은 trolox 당량(trolox equivalent antioxidant capacity, TEAC)으로 환산하여 나타내었다.
6. ABTS radical 소거능 측정
ABTS radical 소거능은 Re et al.(1999)의 방법을 참조하여 측정하였다. 7 mM ABTS (Sigma-Aldrich) 용액에 14 mM potassium persulfite (Daejung Chemicals & Metals)를 혼합하여 12~16시간 동안 암소에서 반응시켜 ABTS 양이온을 형성시켰다. 형성된 ABTS 라디칼은 734 nm에서 0.7 ± 0.002의 흡광도 값이 되도록 100% 에탄올로 희석하여 사용하였다. ABTS solution 1 mL에 녹차 및 녹차박 추출물 0.05 mL를 첨가한 후 암소에서 2.5분간 반응시켜 734 nm에서 흡광도를 측정하였다. 표준물질로는 trolox (Sigma-Aldrich)를 이용하여 표준 곡선을 구하였고, ABTS radical 소거능은 trolox 당량(trolox equivalent antioxidant capacity, TEAC)으로 환산하여 나타내었다.
7. 환원력 측정
환원력은 Oyaizu(1986)의 방법을 참조하여 측정하였다. 녹차 및 녹차박 추출물 0.05 mL에 0.2M sodium phosphate buffer(Sigma-Aldrich, pH 6.6) 0.25 mL와 1% potassium ferricyanide(Sigma-Aldrich) 0.025 mL를 혼합하여 50°C 에서 20분간 반응시킨 후 10% trichloroacetic acid(Daejung Chemicals & Metals) 1.25 mL를 추가하였다. 그 후 시료의 상층액 0.1 mL를 3차 증류수 0.1 mL 및 1% ferric chloride(Junsei Chemical) 0.02 mL와 혼합하여 700 nm에서 흡광도를 측정하였다. 표준물질로는 trolox(Sigma-Aldrich)를 이용하여 표준 곡선을 구하였고, 환원력은 표준물질 trolox 당량(trolox equivalent reducing power, TERP)으로 환산하여 나타내었다.
8. SOD 유사활성 측정
SOD(Superoxide dismutase) 유사활성은 Marklund & Marklund(1974)의 방법을 참조하여 측정하였다. 녹차 및 녹차박 추출물 0.02 mL에 Tris-HCl buffer(Bioneer Corp, Daejeon, Korea) 0.3 mL를 첨가 후, 기질로 10 mM pyrogalol(Sigma-Aldrich) 0.02 mL를 첨가 후 25°C 에서 10분간 반응시켰다. 그 후 0.1N HCl(Daejung Chemicals & Metals) 0.1 mL를 추가하여 반응을 중지시킨 뒤 420 nm에서 흡광도를 측정하였다. 무첨가구로 시료 추출 용매인 물을 시료와 같은 과정으로 반응시켜 시료의 영향을 배제하기 위한 positive blank를 제조하였다. SOD 유사활성은 아래와 같은 식을 이용하여 계산하였다.
- A: 녹차 및 녹차박 추출물 첨가구 흡광도
- B: Pyrogallol을 대체하여 3차 증류수를 첨가한 Blank 흡광도
- C: 녹차 및 녹차박 추출물 무첨가구의 흡광도
9. Lipase 저해활성 측정
Lipase 저해활성은 Kim et al.(2007)의 방법을 참조하여 측정하였다. 실험에 사용된 10 mM MOPS(Thermo Fisher Scientific)/1 mM EDTA(Junsei Chemical, pH 6.8)와 100 mM Tris-HCl((Bioneer Corp)/5 mM CaCl2(Wako Pure Chemical Industries, Tokyo, Japan, pH 6.8)용액을 준비하였다. Enzyme solution은 porcine pancreatic lipase(Sigma-Aldrich) 0.3 mg, 10 mM MOPS/1 mM EDTA 30 μL, 100 mM Tris-HCl/5 mM CaCl2 0.85 mL를 혼합하여 제조하였다. Blank buffer는 10 mM MOPS/1 mM EDTA 0.03 mL와 100 mM Tris-HCl/5 mM CaCl2 0.085 mL로 구성하였다. 기질 용액은 10 mM 농도로 4-nitrophenylbutyrate(Sigma-Aldrich)를 dimethyl formamide(Daejung Chemicals & Metals)에 녹여서 준비하였다. 추출물 0.1 mL에 enzyme solution 0.88 mL를 혼합한 후 37°C에서 30분간 반응시킨 후 기질 용액을 0.02 mL 첨가하여 15분간 반응시켜 400 nm에서 흡광도를 측정하였다. Blank 시료는 enzyme solution 대신 blank buffer를 첨가하여 동일한 방식으로 수행되었다. Lipase 저해 활성은 SOD와 같은 식을 이용하여 계산하였다.
10. 세포 생존율 측정
세포 생존율은 WST-8(Water soluble tetrazolium salt-8) assay 방법으로 측정하였다. 실험은 Raw 264.7 대식세포를 DMEM media에 10% fetal bovine serum와 1% penicillin-Streptomycin을 첨가하여 37°C, 5% CO2에서 계대배양하여 사용하였다. 배양된 세포는 1×104 cells/mL의 농도로 준비하여 100 µL씩 분주 후 16시간 동안 배양한 뒤 녹차 및 녹차박 추출물을 농도별(12.5, 25, 50, 100, 200, 400, 800 μg/mL)로 희석하여 세포에 100 μL씩 처리 후 48시간 동안 배양하였다. 그 후 세포 생존율은 EZ-Cytox(DoGenBio Corp, Seoul, Korea)를 이용하여 측정하였다. 제품 매뉴얼에 따라 EZ-Cytox 시약 10 μL를 혼합하여 4시간 동안 반응 후 450 nm에서 흡광도를 측정하였다. 녹차와 녹차 추출물을 처리하지 않은 대조군(Negative control, NTC)과 시료 무첨가군(Positive control, PC)을 이용하여 아래와 같은 식을 이용하여 세포 생존율을 구하였다.
11. 통계처리
본 연구에서 얻은 실험 결과는 모두 3 반복하여 얻은 값을 평균 ± 표준편차로 표시하였으며 SPSS(Statistical Package for Social Science) program을 이용하여 통계 분석하였다. 두 집단 사이의 통계적 유의성 검증은 Student’s t-test로 각 실험군의 유의성을 검정하였으며 평균값의 유의성 검증은 ANOVA(one-way analysis of variance)로 분석 후 p<0.05 수준에서 Duncan’s multiple range test로 차이를 검증하였다.
Ⅲ. 결과 및 고찰
1. 녹차와 녹차박 추출물의 이화학적 특징
녹차(GT)와 녹차박 추출물(GTR)의 pH, 염도, 당도 및 색도의 측정 결과는 Table 1과 같다. pH 측정 결과, GT의 평균 pH는 5.89 ± 0.01로 나타났으며, GTR의 평균 pH는 6.52 ± 0.04로 나타났다. 염도 측정 결과, GT와 GTR 평균 염도는 각각 0.11 ± 0.00%, 0.00 ± 0.00%로 나타나 GT의 염도가 유의하게 높았다. 당도 측정 결과, GT의 평균 당도는 0.03 ± 0.00 °Brix, GTR의 평균 당도는 0.02 ± 0.00 °Brix로 유의미한 차이를 나타내지 않았다. 색도 측정 결과 명도(lightness)를 표현하는 L 값은 GT가 81.40 ± 0.29, GTR이 84.66 ± 0.30으로 나타났다. 적색도(redness)를 표현하는 a 값은 GT가 -2.28 ± 0.04로 약간의 녹색을 띠는 반면, GTR은 0.14 ± 0.01로 GT보다 옅은 녹색을 나타냈다. 황색도(yellowness)를 나타내는 b 값은 GT가 20.88 ± 2.45, GTR은 -4.11 ± 0.03을 나타낸다. 총 색차(total color difference)를 나타내는 ΔE 값은 GT가 27.61 ± 1.72, GTR이 15.28 ± 0.28로 나타났다. GTR의 ΔE 값이 더 낮은 것은 GT에 비해 더 높은 명도와 낮은 적색도에서 기인한 것으로 확인된다. Terakawa et al.(2015)의 연구에 따르면, 녹차에는 다양한 알칼리 성분이 포함되어 있으며 칼륨(K)과 루비듐(Rb)이 주요 알칼리 성분으로 확인되었고 이들은 뜨거운 물에 쉽게 용출되는 것으로 밝혀졌다. 또한, 녹차에 포함된 폴리페놀과 플라보노이드는 화학적 구조에서 다수의 페놀성 수산기를 포함하여 산성을 띠며, 이들 수산기는 수용액에서 수소 이온을 방출함으로써 산성 성질을 나타낸다(Scalbert & Williamson 2000). GTR의 pH가 GT보다 높은 이유는 산성을 띠는 폴리페놀과 플라보노이드 함량이 GT에 비해 낮기 때문에(Fig. 1) GTR이 상대적으로 낮은 산성 성분을 포함하고 있고, 이에 따라 다른 알칼리성 성분이 더욱 두드러져 GTR의 pH가 GT보다 높게 측정된 것으로 판단된다. 녹차의 색은 주로 엽록소와 카로티노이드에 의해 결정된다(Suzuki & Shioi 2003). 이들 성분은 식품의 신선도가 높을 때 더 많이 함유되어 있어 더욱 짙은 녹색을 나타낸다(Ferruzzi et al. 2001). Korus(2013)의 연구에 따르면, 조리된 케일과 신선한 케일 잎을 비교했을 때 신선한 케일에서 엽록소와 카로티노이드 함량이 더 높았다. 유사한 연구로 브로콜리, 시금치, 초록 피망 등을 70°C와 117°C로 고온 처리 시 엽록소는 고온에서 거의 완전히 분해되는 경향을 보이며 카로티노이드는 비교적 안정적이었으나 일부 함량이 손실되었다(Sanchez et al. 2014). 이러한 연구결과는 GTR이 GT보다 옅은 녹색을 띠는 이유를 설명하는 데 기여할 수 있다. 녹차박은 녹차를 추출한 후 남은 잔여물로, 녹차 추출 과정에서 고온 건조 및 추출 과정을 거치게 되어 녹색을 나타내는 엽록소와 카로티노이드 성분이 이미 다수 용출되어 녹차박에 잔존하는 양이 적은 결과로 판단된다.

pH, salinity, sugar, and color values of green tea (GT) and hot water extracts of green tea residues (GTR).
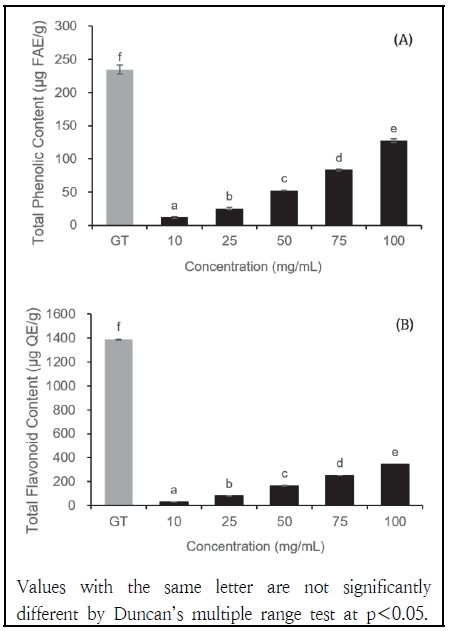
2. 녹차와 녹차박 추출물의 총 폴리페놀과 플라보노이드 함량
GT와 GTR 추출물의 총 폴리페놀과 총 플라보노이드 함량 측정 결과는 Fig. 1과 같다. GT의 총 폴리페놀 함량은 234.62 µg FAE/g로 나타났으며, GTR의 경우 농도에 따라 10 mg/mL에서 100 mg/g까지 다양하게 측정되었다. GTR의 총 폴리페놀 함량은 10 mg/mL에서 11.86 µg FAE/g, 100 mg/mL에서 127.16 µg FAE/g로 GT보다 낮은 값을 보였다. GT의 총 플라보노이드 함량은 1388.63 µg QE/g로 나타났으며, GTR의 총 플라보노이드 함량은 10 mg/g에서 29.06 µg QE/g, 100 mg/mL에서 341.03 µg QE/g로 GT보다 낮았다. 녹차의 폴리페놀에는 gallic acid, caffeic acid, cinnamic acid, ferulic acid 등의 페놀성 화합물이 포함되어 있고 플라보노이드에는 quercetin, naringenin, hesperitin 등의 화합물이 포함되어 있다(Maslov et al. 2021). Pasrija & Anandharamakrishnan(2015)의 연구에 따르면 녹차를 열수 추출했을 때 폴리페놀은 물에 잘 용해되는 성질을 가지고 있어, 메탄올과 에탄올 용매를 사용하여 추출한 결과 대비 폴리페놀과 플라보노이드 성분이 높은 수율로 추출된 것으로 밝혀졌다. 이러한 결과는 열수 추출이 녹차의 유효 성분을 높은 수율로 추출하는 데 중요한 역할을 하는 것으로 이어진다. 본 연구에서 GTR이 GT보다 낮은 폴리페놀과 플라보노이드 함량을 나타내는 것은 녹차 제조 과정에서 폴리페놀과 플라보노이드 성분이 이미 추출되어 GTR에는 상대적으로 적은 함량의 폴리페놀과 플라보노이드 성분이 포함된 것으로 사료된다. 그러나 GTR의 폴리페놀과 플라보노이드 함량은 농도 증가에 따라 점진적으로 증가하는 경향을 보였으며, 이는 고농도의 GTR은 GT와 유사한 성능을 나타낼 가능성을 제시한다.
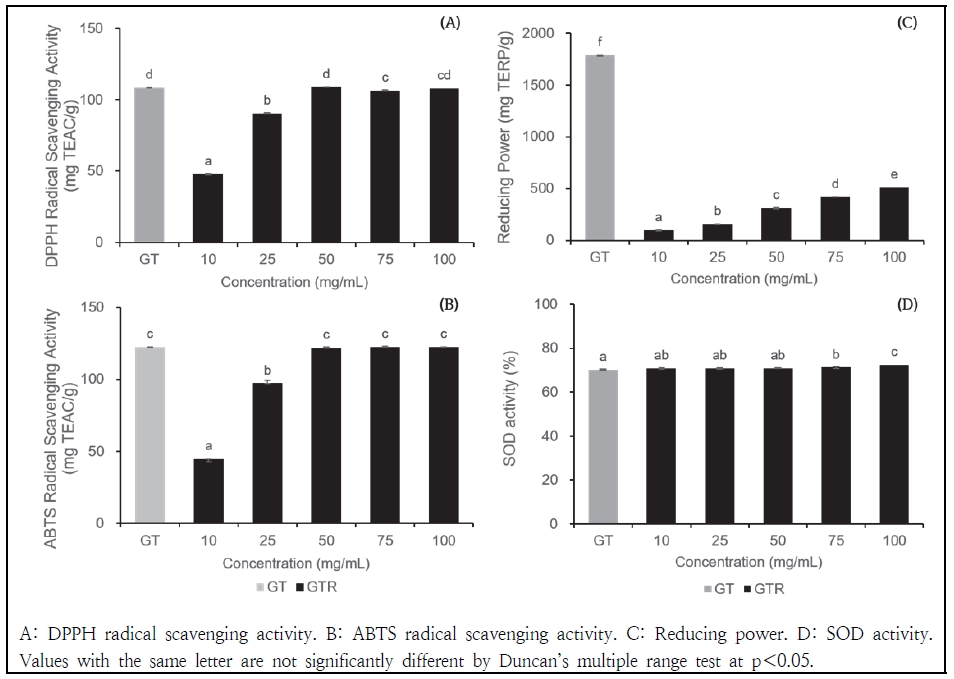
3. 녹차와 녹차박 추출물의 항산화 활성
GT와 GTR 추출물의 DPPH, ABTS 라디칼 소거능, 환원력 그리고 SOD 유사활성 측정 결과는 Fig. 2와 같다. DPPH 라디칼 소거능 측정 결과, GT의 DPPH 라디칼 소거능은 108.39 mg TEAC/g로 나타났으며, GTR의 경우 47.94, 90.66, 108.70, 106.67 및 107.78 mg TEAC/g으로 대체적으로 GT에 비해 낮은 값을 보였지만, 50 mg/mL와 100 mg/mL 농도에서는 GT와 동등한 수준의 라디칼 소거능을 나타냈다. ABTS 라디칼 소거능 측정 결과, GT의 ABTS 라디칼 소거능은 122.46 mg TEAC/g로 나타났으며, GTR의 경우 44.54, 97.24, 122.15, 122.49 및 122.39 TEAC/g으로 50 mg/mL 이상의 농도에서 GTR의 ABTS 라디칼 소거능은 GT와 동등하거나 더 높은 수준의 ABTS 라디칼 소거능을 나타냈다. 환원력 측정 결과, GT의 환원력은 1783.19 mg TERP/g로 측정되었으며, GTR의 경우 농도 증가에 따라 환원력이 증가하는 경향을 보였다. GTR의 환원력은 94.46, 156.04, 310.91, 417.24 및 514.32 mg TERP/g로 GT에 비해 낮은 환원력을 나타낸다. SOD 유사활성 측정 결과, GT의 SOD 유사활성은 70.24%로 측정되었으며, GTR의 경우 70.83, 70.80, 70.93, 71.26 및 72.46%로 모든 농도에서 GT보다 더 높은 SOD 유사활성을 나타낸다. 이는 GTR의 농도와 관계없이 SOD 유사활성이 GT와 동등하거나 그 이상일 수 있음을 시사한다. Yanagimoto et al.(2003)의 연구에 따르면 녹차에는 폴리페놀 이외에도 강력한 항산화 작용을 하는 터페노이드 성분이 포함되어 있으며 Nkhili et al.(2009)은 HPLC 분석을 통해 녹차의 폴리페놀 화합물 성분을 분석한 결과 녹차의 폴리페놀류에는 대표적인 성분인 카테킨을 제외하고도 갈릭산, 5-갈로일퀸산, 루틴, 퀘르세틴, 캠페롤 등 다양한 성분이 포함되어 있음을 밝혀냈다. 또한 Zheng et al.(2010)은 폴리페놀 및 플라보노이드 함량이 낮더라도 높은 항산화 활성을 나타낼 수 있는 주요 구조적 특징으로 오르토-다이하이드록실 구조와 3-하이드록실 그룹이 라디칼 제거 능력을 높이는 데 중요한 역할을 하며 퀘르세틴은 오르토-다이하이드록실 구조를 지니고 있는 것으로 밝혀냈다. 이는 Nanjo et al.(1996)의 연구와도 일치한다. 이러한 연구결과를 토대로 GTR의 DPPH, ABTS 라디칼 소거능이 GT와 동등한 수준을 보이는 이유는 GTR에는 항산화 활성을 보이는 터페노이드 및 다양한 폴리페놀 화합물들이 포함되어 GT와 동등한 수준의 효과를 나타내는 것으로 판단된다. 환원력은 항산화제 화합물의 항산화 활성을 측정하는 척도로, 이는 항산화제가 산화 스트레스를 줄이기 위해 전자를 전달하는 능력을 평가하는 것이다(Cheng & Li 2004). Benzie & Szeto(1999)의 연구에 따르면, FRAP 분석법과 Folin-Ciocalteu 방법을 사용하여 다양한 차의 환원력과 폴리페놀 함량을 측정하고 두 변수 간의 상관관계를 분석한 결과, 폴리페놀 함량이 높을수록 녹차의 환원력이 더 높아진다는 것을 확인했다. 이와 같이 GTR의 환원력이 GT보다 낮은 이유는 폴리페놀과 플라보노이드 함량이 GT보다 낮기 때문으로 판단되나, GTR의 환원력은 농도 증가에 따라 점진적으로 증가하는 경향을 보여 고농도에서 GTR의 건강 기능성 식품 소재로서의 활용 가능성을 시사한다. GTR의 SOD 유사 활성이 GT보다 높은 이유는 DPPH와 ABTS 라디칼 소거능과 같이 항산화 활성을 가지는 터페노이드, 폴리페놀 등과 함께 녹차에 포함된 셀레늄 성분의 작용으로 인한 것으로 판단된다. SOD란 슈퍼옥사이드 라디칼을 제거하는 필수 효소로 세포를 보호하는 데 도움을 주며 높은 SOD 유사 활성을 보이는 물질은 항산화 능력이 뛰어나다는 것을 의미한다(Mansuroglu et al. 2014). 셀레늄은 활성 산소종(ROS)을 제거하여 세포 손상을 방지하는 항산화 성분으로, 항산화 효소의 중요한 구성 요소로 작용한다(Hu et al. 2001). Sotelo et al.(2016)의 연구에 따르면 셀레늄은 알칼리성 조건에서 용출이 효과적이라고 밝혔으며, Iida et al.(2010)의 연구에서도 동일한 결과를 나타낸다. 셀레늄의 용출과 관련된 또 다른 연구로 Alemi et al.(1988)은 증류수로 셀레늄을 용출 했을 때 회수율이 가장 높다고 밝혀냈다. 따라서 GTR의 pH가 GT보다 높은 알칼리성을 띠고 있기 때문에 GT보다 셀레늄이 상대적으로 더 많이 용출되었을 가능성이 있어 SOD 유사 활성에 기여한 것으로 판단된다.
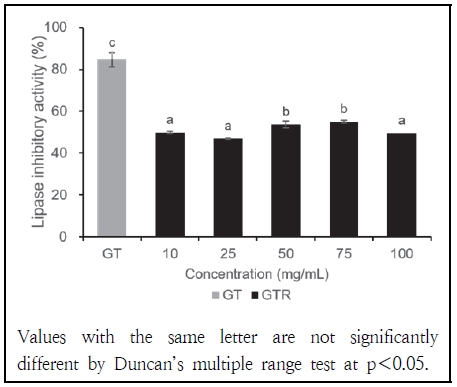
4. 녹차와 녹차박 추출물의 Lipase 저해 활성
GT와 GTR 추출물의 lipase 저해 활성 측정 결과는 Fig. 3과 같다. Lipase 저해 활성이란, 췌장 리파아제(Pancreatic lipase, PL) 효소가 음식물 속 지방을 글리세롤과 지방산으로 분해하는 능력을 억제하는 것을 의미하며 이 과정은 지방의 체내 흡수를 감소시켜 체중 감소와 비만 방지에 효과적이다(Liu et al. 2020). GT의 lipase 저해 활성은 84.58%로 측정되었으며, 이는 GTR의 모든 농도에서 측정된 값보다 유의미하게 높은 수치였다.
이러한 결과는 GT에 비해 GTR의 lipase 저해 효과가 낮음을 나타낸다. Bajes et al.(2020)의 연구에 따르면 식물 유래 성분인 폴리페놀, 플라보노이드, 사포닌, 알칼로이드, 카로티노이드는 천연 lipase 저해제로 작용한다고 밝혀졌다. 특히 Li et al.(2016)의 연구에서는 녹차에 포함된 폴리페놀 화합물이 다량 함유될 경우 lipase 저해 활성이 증가한다고 보고된 바 있다. GTR이 GT보다 lipase 저해 활성이 낮은 이유는 선행연구에서 보고된 바와 같이 천연 lipase 저해 활성을 갖는 폴리페놀과 플라보노이드 함량이 GT에 비해 낮기 때문으로 판단된다. 그러나, GTR의 리파아제 저해 활성은 25 mg/mL에서 49.95%, 50 mg/mL에서 53.71%, 75 mg/mL에서 55.06%로 증가하는 경향을 보여, GTR의 농도 증가에 따라 리파아제 저해 효과가 일정 부분 증가할 가능성을 시사한다.
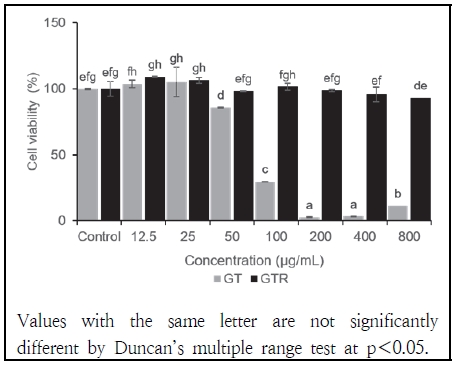
5. 녹차와 녹차박 추출물에 의한 세포 생존율 측정
GT와 GTR 추출물을 처리한 세포 생존율 측정 결과는 Fig. 4와 같다. WST-8 assay는 세포 생존율 측정에 널리 사용되는 수용성 테트라졸륨 염으로, NAD(P)H와 반응하여 생성된 주황색 포르마잔을 450 nm의 흡광도에서 측정하여 세포의 대사 활성을 평가하는 방법이다(Chamchoy et al. 2019). GT는 50 μg/mL 농도에서 세포 생존율이 85.86%로 감소하는 반면, GTR은 동일 농도에서 98.20%의 세포 생존율을 보였다. 이러한 경향은 농도가 증가할수록 더욱 두드러지며 GT는 800 μg/mL 농도에서 11.12%의 생존율을 나타내지만, GTR은 800 μg/mL 농도에서도 93.07%의 높은 세포 생존율을 나타낸다. GTR은 12.5, 25, 100 μg/mL 농도에서 모두 100% 이상의 세포 생존율을 유지하였으나 GT는 동일 농도에서 GTR보다 낮은 세포 생존율을 나타낸다. Moon et al.(2021)의 연구에 따르면 국내외 다양한 원산지의 홍차 10종을 50, 100, 200 μg/mL의 농도로 Raw 264.7 세포에 처리하였을 시 홍차의 원산지와 관계없이 50, 100 μg/mL의 농도에서 가장 높은 세포 생존율을 보이며 200 μg/mL에서는 세포 생존율이 유의하게 낮은 결과를 나타낸다. 이와 비교했을 때 본 연구에서 GT의 농도가 높아짐에 따라 세포 생존율이 저하된다는 것과 일치한 경향을 보이며 GTR은 고농도에서도 높은 세포 생존력을 보여 생체에 적용하기에는 GT보다 GTR이 더욱 효과적일 것으로 판단된다.
Ⅳ. 요약 및 결론
본 연구는 녹차박(GTR) 추출물의 이화학적 특성, 생리활성 및 세포 생존율을 녹차(GT)와 비교 평가하여 GTR의 건강 기능성 식품으로서의 가능성을 확인하기 위해 수행되었다. GTR의 pH, 염도, 당도 및 색도 측정 결과, GT에 비해 높은 pH와 낮은 염도를 보였으며, 밝은색을 나타냈다. GT와 GTR의 총 폴리페놀 및 플라보노이드 함량은 GTR이 GT보다 낮았으나, GTR의 농도가 증가함에 따라 항산화 성분이 점진적으로 증가하는 경향을 보였다. DPPH 및 ABTS 라디칼 소거능 측정 결과, GTR은 50, 75, 100 mg/mL 농도에서 GT와 유사한 라디칼 소거능 활성을 보였으며, 환원력과 lipase 저해 활성은 GTR이 GT보다 낮게 측정되었으나 GTR의 농도가 증가함에 따라 환원력과 lipase 저해 활성이 증가하는 경향을 보였다. SOD 유사 활성은 모든 농도에서 GTR이 GT보다 높은 것으로 나타났으며 세포 생존율 측정 시에도, GTR은 모든 농도에서 GT보다 높은 세포 생존율을 보여 이는 GTR의 세포 독성이 GT보다 낮으며 세포 활성을 유지하는 데 더 효과적임을 나타낸다. 본 연구를 통해 녹차박 추출물의 건강 기능성 식품 소재로서의 가능성을 확인함과 동시에 녹차박의 활용 방안을 제시하여 식품 폐기물의 감소에 기여할 수 있을 것으로 기대한다.
References
-
Alemi MH, Goldhamer DA, Grismer ME, Nielsen DR (1988) Elution of selenium from contaminated evaporation pond sediments. J Environ Qual 17(4), 613-618.
[https://doi.org/10.2134/jeq1988.00472425001700040016x]

-
Bajes HR, Almasri I, Bustanji Y(2020) Plant products and their inhibitory activity against pancreatic lipase. Rev Bras Farmacogn 30(3), 321-330.
[https://doi.org/10.1007/s43450-020-00055-z]

-
Basumatary V, Saikia R, Narzari R, Bordoloi N, Gogoi L, Sut D, Bhuyan N, Kataki R(2018) Tea factory waste as a feedstock for thermo-chemical conversion to biofuel and biomaterial. Mater Today Proc 5, 23413-23422.
[https://doi.org/10.1016/j.matpr.2018.11.081]

-
Benzie IFF, Szeto YT(1999) Total antioxidant capacity of teas by the ferric reducing/antioxidant power assay. J Agric Food Chem 47(2), 633-636.
[https://doi.org/10.1021/jf9807768]

-
Blois MS(1958) Antioxidant determinations by the use of a stable free radical. Nature 181(4617), 1199-1200.
[https://doi.org/10.1038/1811199a0]

-
Chacko SM, Thambi PT, Kuttan R, Nishigaki I(2010) Beneficial effects of green tea: a literature review. Chin Med 5(1), 13.
[https://doi.org/10.1186/1749-8546-5-13]

-
Chamchoy K, Pakotiprapha D, Pumirat P, Leartsakulpanich U, Boonyuen U(2019) Application of WST-8 based colorimetric NAD(P)H detection for quantitative dehydrogenase assays. BMC Biochem 20, 4.
[https://doi.org/10.1186/s12858-019-0108-1]

-
Cheng Z, Li Y(2004) Reducing power: the measure of antioxidant activities of reductant compounds? Redox Rep 9(4), 213-217.
[https://doi.org/10.1179/135100004225005994]

-
Davis WB(1947) Determination of flavanones in citrus fruits. Anal Chem 19(7), 476-478.
[https://doi.org/10.1021/ac60007a016]

-
Ding X, Li H, Wen Z, Hou Y, Wang G, Fan J, Qian L(2020) Effects of fermented tea residue on fattening performance, meat quality, digestive performance, serum antioxidant capacity, and intestinal morphology in fatteners. Animals 10(2), 185.
[https://doi.org/10.3390/ani10020185]

-
Farhan M(2022) Green tea catechins: nature’s way of preventing and treating cancer. Int J Mol Sci 23(18), 10713.
[https://doi.org/10.3390/ijms231810713]

-
Ferruzzi MG, Failla ML, Schwartz SJ(2001) Assessment of degradation and intestinal cell uptake of carotenoids and chlorophyll derivatives from spinach puree using an in vitro digestion and Caco-2 human cell model. J Agric Food Chem 49(4), 2082-2089.
[https://doi.org/10.1021/jf000775r]

-
Gaur S, Agnihotri R(2014) Green tea: a novel functional food for the oral health of older adults. Geriatr Gerontol Int 14, 238-250.
[https://doi.org/10.1111/ggi.12194]

-
Gunatilake SK(2016) Production of quality organic fertilizer using firewood ash and tea residues produced from tea factories in Sri Lanka. IOSR J Appl Chem 9(8), 48-53.
[https://doi.org/10.9790/5736-0908014853]

-
Guo L, Yu S, Cao F, Zheng K, Li M, Peng Z, Shi X, Liu L(2023) Dried tea residue can alter the blood metabolism and the composition and functionality of the intestinal microbiota in Hu sheep. Front Microbiol 14, 1289743.
[https://doi.org/10.3389/fmicb.2023.1289743]

- Hicks A(2009) Current status and future development of global tea production and tea products. AU J Technol 12(4), 251-264
-
Hu Q, Xu J, Pan G(2001) Effect of selenium spraying on green tea quality. J Sci Food Agric 81(14), 1387-1390.
[https://doi.org/10.1002/jsfa.952]

-
Iida Y, Yamaguchi T, Tanaka T, Nakayama S(2010) Solubility of selenium at high ionic strength under anoxic conditions. J Nucl Sci Technol 47(5), 431-438.
[https://doi.org/10.1080/18811248.2010.9711633]

-
Ikar M, Sable S(2023) Tea, coffee and green tea consumption and mental health outcomes: a systematic review and meta-analysis of observational and intervention studies on stress and related conditions. J Pharmacogn Phytochem 12(2), 209-221.
[https://doi.org/10.22271/phyto.2023.v12.i2c.14660]

- Kati(2020) European green tea market trends. Available from https://www.kati.net/board/globalVillageReportView.do?board_seq=92195&menu_dept2=35, [cited 2020 November 20]
-
Kim JH, Kim HJ, Park HW, Youn SH, Choi DY, Shin CS(2007) Development of inhibitors against lipase and α-glucosidase from derivatives of monascus pigment. FEMS Microbiol Lett 276(1), 93-98.
[https://doi.org/10.1111/j.1574-6968.2007.00917.x]

-
Korus A(2013) Effect of preliminary and technological treatments on the content of chlorophylls and carotenoids in kale (Brassica oleracea L. var. acephala). J Food Process Preserv 37(4), 335-344.
[https://doi.org/10.1111/j.1745-4549.2011.00653.x]

-
Kwak JK, Shin DY(2022) Association between green tea consumption and abdominal obesity risk in middle-aged Korean population: Findings from the Korean Genome and Epidemiology Study. Int J Environ Res Public Health 19(5), 2735.
[https://doi.org/10.3390/ijerph19052735]

-
Lai X, Pan S, Zhang W, Sun L, Li Q, Chen R, Sun S(2020) Properties of ACE inhibitory peptide prepared from protein in green tea residue and evaluation of its anti-hypertensive activity. Process Biochem 92, 277-287.
[https://doi.org/10.1016/j.procbio.2020.01.021]

-
Lee J, Chambers IV E, Chambers DH, Chun SS, Oupadissakoon C, Johnson DE(2010) Consumer acceptance for green tea by consumers in the United States, Korea, and Thailand. J Sens Stud 25(1), 109-132.
[https://doi.org/10.1111/j.1745-459X.2010.00287.x]

-
Liu TT, Liu XT, Chen QX, Shi Y(2020) Lipase inhibitors for obesity: a review. Biomed Pharmacother 128, 110314.
[https://doi.org/10.1016/j.biopha.2020.110314]

-
Li YF, Chang YQ, Deng J, Li WX, Jian J, Gao JS, Wan X, Gao H, Kurihara H, Sun PH, He RR(2016) Prediction and evaluation of the lipase inhibitory activities of tea polyphenols with 3D-QSAR models. Sci Rep 6, 34387.
[https://doi.org/10.1038/srep34387]

-
Mansuroglu B, Derman S, Yaba A, Kızılbey K(2015) Protective effect of chemically modified SOD on lipid peroxidation and antioxidant status in diabetic rats. Int J Biol Macromol 72, 79-87.
[https://doi.org/10.1016/j.ijbiomac.2014.07.039]

-
Marklund G, Marklund S(1974) Involvement of the superoxide anion radical in the autoxidation of pyrogallol and a convenient assay for superoxide dismutase. Eur J Biochem 47(3), 469-474.
[https://doi.org/10.1111/j.1432-1033.1974.tb03714.x]

-
Maslov OY, Kolisnyk SV, Komisarenko MA, Akhmedov EY, Poluian SM, Shovkova ZV (2021) Study of flavonoids and phenolic acids in green tea leaves. Curr Issues Pharm Medical Sci 14(3), 287-291.
[https://doi.org/10.14739/2409-2932.2021.3.240287]

-
Miura Y, Chiba T, Miura S, Tomita I, Koizumi H, Miura S, Umegaki K, Hara Y, Ikeda M, Tomita T(2001) Tea catechins prevent the development of atherosclerosis in apoprotein E-deficient mice. J Nutr 131(1), 27-32.
[https://doi.org/10.1093/jn/131.1.27]

-
Miyoshi N, Pervin M, Suzuki T, Unno K, Isemura M, Nakamura Y(2015) Green tea catechins for well-being and therapy: prospects and opportunities. Botanics 5, 85-96.
[https://doi.org/10.2147/BTAT.S91784]

-
Moon GH, Kim GJ, Lee YR, Kim JC, Shim DB, Chung KH, Lee KJ, An JH(2021) Antioxidant and nitric oxide inhibition effect of domestic and foreign fermented black tea extracts. J Food Sci Techol 58(3), 454-462.
[https://doi.org/10.9721/KJFST.2021.53.4.454]

-
Nanjo F, Goto K, Seto R, Suzuki M, Sakai M, Hara Y(1996) Scavenging effects of tea catechins and their derivatives on 1,1-diphenyl-2-picrylhydrazyl radical. Free Radic Biol Med 21(6), 895-902.
[https://doi.org/10.1016/0891-5849(96)00237-7]

-
Nkhili E, Tomao V, El Hajji H, El Boustani ES, Chemat F, Dangles O(2009) Microwave-assisted water extraction of green tea polyphenols. Phytochem Anal 20(5), 408-415.
[https://doi.org/10.1002/pca.1141]

-
Ohishi T, Goto S, Monira P, Isemura M, Nakamura Y(2016) Anti-inflammatory action of green tea. Antiinflamm Antiallergy Agents Med Chem 15(2), 74-90.
[https://doi.org/10.2174/1871523015666160915154443]

-
Oyaizu M(1986) Studies on products of browning reaction: Antioxidative activities of products of browning reaction prepared from glucosamine. Jpn J Nutr 44(6), 307-315.
[https://doi.org/10.5264/eiyogakuzashi.44.307]

-
Pasrija D, Anandharamakrishnan C(2015) Techniques for extraction of green tea polyphenols: a review. Food Bioproc Tech 8(5), 935-950.
[https://doi.org/10.1007/s11947-015-1479-y]

-
Pullikotil P, Chen H, Muniyappa R, Greenberg CC, Yang S, Reiter CEN, Lee JW, Chung JH, Quon MJ(2011) Epigallocatechin gallate induces expression of heme oxygenase-1 in endothelial cells via p38 MAPK and Nrf-2 that suppresses proinflammatory actions of TNF-α. J Nutr Biochem 23(9), 1134-1145.
[https://doi.org/10.1016/j.jnutbio.2011.06.007]

-
Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C(1999) Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med 26(9-10), 1231-1237.
[https://doi.org/10.1016/S0891-5849(98)00315-3]

-
Saeed M, Naveed M, Arif M, Kakar MU, Manzoor R, Abd El-Hack ME, Alagawany M, Tiwari R, Khandia R, Munjal A, Karthik K, Dhama K, Iqbal HMN, Dadar M, Sun C(2017) Green tea (Camellia sinensis) and l-theanine: Medicinal values and beneficial applications in humans—A comprehensive review. Biomed Pharmacother 95, 1260-1275.
[https://doi.org/10.1016/j.biopha.2017.09.024]

-
Sanchez C, Baranda AB, Martinez de Marañon I(2014) The effect of high pressure and high temperature processing on carotenoids and chlorophylls content in some vegetables. Food Chem 163, 37-45.
[https://doi.org/10.1016/j.foodchem.2014.04.041]

-
Scalbert A, Williamson G(2000) Dietary intake and bioavailability of polyphenols. Adv Nutr 130(8), 2073S-2085S.
[https://doi.org/10.1093/jn/130.8.2073S]

-
Sotelo M, Hinchliff J, Evans NDM, Read D(2016) Solubility constraints affecting the migration of selenium through the cementitious backfill of a geological disposal facility. J Hazard Mater 305, 21-29.
[https://doi.org/10.1016/j.jhazmat.2015.11.024]

-
Suzuki Y, Shioi Y(2003) Identification of chlorophylls and carotenoids in major teas by high-performance liquid chromatography with photodiode array detection. J Agric Food Chem 51(18), 5307-5314.
[https://doi.org/10.1021/jf030158d]

-
Terakawa A, Ishii K, Matsuyama S, Matsuyama T, Sato T, Inano K, Shigihara K, Saneshige Y, Sera K(2015) Concentrations of alkali elements in green tea leaves evaluated using PIXE analysis. Int J PIXE 24(1-2), 35-39.
[https://doi.org/10.1142/S0129083514500041]

-
Trimo L, Deliana Y, Fatimah S, Nainggolan MF, Djali M(2021) Driving factor of consumer preferences for food and beverages product enriched with green tea powder. Jordan J Biol Sci 14(3), 581-586.
[https://doi.org/10.54319/jjbs/140326]

-
Tunklová B, Jeníček L, Malaťák J, Neškudla M, Velebil J, Hnilička F(2022) Properties of biochar derived from tea waste as an alternative fuel and its effect on phytotoxicity of seed germination for soil applications. Mater 15(24), 8709.
[https://doi.org/10.3390/ma15248709]

-
Unno K, Hara A, Nakagawa A, Iguchi K, Ohshio M, Morita A, Nakamura Y(2016) Anti-stress effects of drinking green tea with lowered caffeine and enriched theanine, epigallocatechin and arginine on psychosocial stress induced adrenal hypertrophy in mice. Phytomed 23(12), 1365-1374.
[https://doi.org/10.1016/j.phymed.2016.07.006]

-
Velioglu YS, Mazza G, Gao L, Oomah BD(1998) Antioxidant activity and total phenolics in selected fruits, vegetables, and grain products. J Agric Food Chem 46(10), 4113-4117.
[https://doi.org/10.1021/jf9801973]

-
Verrillo M, Salzano M, Cozzolino V, Spaccini R, Piccolo A(2020) Bioactivity and antimicrobial properties of chemically characterized compost teas from different green composts. Waste Manag 120, 98-107.
[https://doi.org/10.1016/j.wasman.2020.11.013]

-
Yanagimoto K, Ochi H, Lee KG, Shibamoto T(2003) Antioxidative activities of volatile extracts from green tea, oolong tea, and black tea. J Agric Food Chem 51(25), 7396-7401.
[https://doi.org/10.1021/jf030127i]

-
Zheng CD, Li G, Li HQ, Xu XJ, Gao JM, Zhang AL(2010) DPPH-scavenging activities and structure-activity relationships of phenolic compounds. Nat Prod Commun 5(11), 1759-1765.
[https://doi.org/10.1177/1934578X100050111]